
Метод. указан. к лаб.работам / Работа № 7
.docxРабота № 7
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Скорость химической реакции (v) характеризуется изменением количества реагирующего вещества за единицу времени в единице реакционного пространства.
В гомогенной (однородной по агрегатному состоянию) системе реакционным пространством служит объем сосуда, в котором происходит реакция.
Скорость
гомогенной химической реакции измеряется
по изменению концентрации за единицу
времени для одного из веществ, участвующих
в реакции. Концентрация (С) выражается
обычно в моль/л, поэтому размерность
скорости моль/л с.
При химической реакции концентрация
каждого из исходных веществ уменьшается
во времени (С2<С1;
с.
При химической реакции концентрация
каждого из исходных веществ уменьшается
во времени (С2<С1;
 С<0),
а концентрация каждого из продуктов
реакции возрастает (С2>С1
С<0),
а концентрация каждого из продуктов
реакции возрастает (С2>С1
 С>0).
С>0).
Различают два вида скорости — среднюю и истинную (или мгновенную). Средняя скорость (v) равна отношению:
 =
=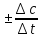
где
 С=С2-
С=С2- ;
;
 t=
t= -t1.
-t1.
Чтобы величина скорости всегда была положительной перед дробью ставят знаки ±.
Истинная
скорость химической реакции

т. е. является производной концентрации по времени:
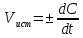
Скорость химических реакций зависит от многих факторов, важнейшие из них: природа реагирующих веществ, концентрация, давление (для реакций с участием газообразных веществ), температура, участие катализаторов.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действия, масс. Формулировка закона: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, причем каждая концентрация входит в произведение в степени, равной коэффициенту, стоящему перед формулой данного вещества в уравнении реакции. Представим уравнение химической реакции в общем виде:
аА +bB = cC + dD.
Тогда закон действия масс можно записать в форме

где [А] и [В] — молярные концентрации вступающих в реакцию веществ; а и b — коэффициенты в уравнении реакции; k—'константа скорости реакции, величина которой зависит от 'природы реагирующих веществ, температуры и присутствия катализаторов, но не зависит от концентраций веществ; k численно равна скорости реакции при [A]=[В]=1 моль/л.
Все химические реакции можно разделить на два типа: необратимые и обратимые. Реакции, которые протекают в одном направлении и идут до конца, называются необратимыми. Большинство реакций являются обратимыми, т. е. протекают в противоположных направлениях и не идут до конца. Изобразим обратимую реакцию в общем виде
аА+bВ сС+dD
сС+dD
зависимости скорости прямой v1, и обратной v2 реакции от концентраций реагирующих веществ выражаются соотношениями:
v1=k1[A]a [B]b,v2
=k2[C]c
[B]b,v2
=k2[C]c [
[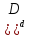 .
.
Состояние, при котором скорость прямой реакции равна скорости обратной, называется химическим равновесием, а концентрации четырех веществ—равновесными. Следовательно, когда vl = v2,
k1 [A]a
[A]a [B]b=k2
[B]b=k2 [C]c
[C]c [
[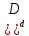 .
.
Отсюда
 =
= =R
=R
где К — константа химического равновесия реакции.
К в отличие от константы скорости химической реакции не зависит от катализатора, так как он в одинаковой степени изменяет скорости прямой и обратной реакций.
Переход системы из одного равновесного состояния в другое в результате изменения одного из условий равновесия (С, Р, Т) называется смещением химического равновесия. Смещение равновесия определяется принципом Ле Шателье: если в системе, находящейся в равновесии, изменить одно из условий, то происходит смещение равновесия в направлении той реакции, которая (противодействует указанному изменению. Применяя принцип Ле Шателье, можно сделать следующие выводы:
-
Увеличение концентрации одного из веществ вызывает смещение равновесия в сторону реакции, которая понижает концентрацию этого вещества.
-
Увеличение давления смещает равновесие в направлении уменьшения общего числа молей газообразных веществ, то есть в направлении, приводящем к понижению давления.
-
Нагревание смещает равновесие в сторону эндотермической реакции, охлаждение — в сторону экзотермической реакции.
Порядок работы
-
Влияние на равновесие изменения концентраций реагирующих веществ.
Смешивают в пробирках растворы (разбавленные) FeCl3 и NH4NCS в равных объемах. В растворе в равновесии находятся четыре вещества:
FeCI3
+ 3NH4NCS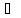 Fe(NCS)3
+ 3NH4CI,
Fe(NCS)3
+ 3NH4CI,
одно из которых Fe(NCS)3 окрашено в темно-красный цвет. По интенсивности окрашивания раствора, пропорциональной концентрации Fe(NCS)3 можно судить о смещении равновесия. Полученный раствор делят на четыре порции в четыре пробирки. В одну добавляют несколько капель концентрированного раствора FeCl3, в другую — несколько капель концентрированного раствора NH4NCS. В третью пробирку добавляют несколько капель концентрированного раствора NH4Cl. Четвертая пробирка остается в качестве контрольной. Результаты наблюдений запишите в таблицу 1, отметив изменение окраски раствора и указав стрелкой направление химической реакции.
Таблица 1
|
№ пробирки |
Добавленное вещество |
Изменение окраски раствора |
Направление cмещения равновесия |
Напишите выражение для константы химического равновесия и объясните смещение равновесия в соответствии с принципом Ле Шателье.
2. Смещение ионного равновесия.
В разбавленных растворах слабых электролитов устанавливается равновесие:
AB
Константа
равновесия
 называется
константой диссоциации.
называется
константой диссоциации.
а) К разбавленному раствору гидроксида аммония добавить одну каплю раствора фенолфталеина. Малиновая окраска указывает на значительную концентрацию гидроксильных ионов. Прибавить в пробирку концентрированный раствор хлорида аммония. Почему исчезает окраска раствора?
б) К разбавленному раствору уксусной кислоты СН3СООН добавить 1—2 капли лакмуса и затем щепотку кристаллической соли — ацетата натрия (CH3COONa). Встряхивая раствор, добиться наиболее полного растворения соли. Объяснить изменение окраски раствора. Как изменится степень диссоциации уксусной кислоты в присутствии ацетата натрия?
Результаты опытов «а» и «б» записать в таблицу 2, указав стрелкой смещение ионного равновесия.
Таблица 2
|
№ п/п |
Электролит |
Индика-тор |
Окраска раствора |
Добавлен- ное веще- ство |
Измене- ние ок- раски раст- вора |
Направ- ление сме-щения равнове- сия |
|
1 |
NH4OH |
Фенол-фталеин |
Малино- вая |
NH4CI |
|
|
|
2 |
СНзСООH |
Лакмус |
Красная |
CH3COONa |
|
|
Написать константы равновесия для ионных процессов:
NH4OH
CH3COOH +
+
3. Влияние температуры на равновесие (учебно-исследовательская работа).
При взаимодействии иода с водным раствором крахмала образуется вещество сложного состава (иодокрахмал),
которое окрашивает раствор в синий цвет. Реакция обратима и может быть представлена следующей схемой:
иод+крахмал иодокрахмал.
иодокрахмал.
Синяя окраска исчезает при нагревании, что свидетельствует о смещении положения равновесия данной реакции.
Налить в пробирку 8—10 мл раствора крахмала, добавить 3—5 капель йодной воды. Полученный синий раствор разделить на две порции в две пробирки, оставив одну из них в качестве контрольной.
а) Нагреть синий раствор на водяной бане до полного обесцвечивания. В каком направлении смещается равновесие при нагревании?
б) Охладить пробирку с раствором под струей холодной воды из-под крана. Что наблюдается? В каком направлении смещается равновесие данной реакции при охлаждении?
Какая из реакций (прямая или обратная) является экзотермической, а какая эндотермической? Согласуются ли ваши наблюдения относительно смещения равновесия с принципом Ле Шателье?
