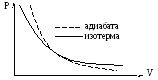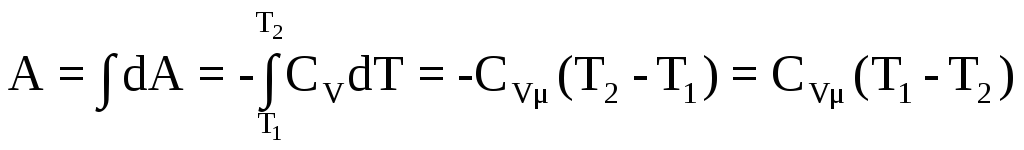Лекция №35. Процессы в газах.
I. Первый закон термодинамики и его применение к изопроцессам в газах.
Если тело не получает извне никакой энергии, то работа А при расширении совершается за счет внутренней энергии U(U= кинетической энергии теплового движения атомов вещества + потенциальной энергии их взаимодействия друг с другом).
Нужно учесть еще и то, что энергия может передаваться от одного тела к другому путем теплопередачи. Эту энергию, называемую количеством тепла Q, будем считать: ΔQ> 0 – тело получает тепло, ΔQ< 0 – тело отдает тепло.
Таким образом, бесконечно малое изменение внутренней энергии складывается из двух частей и может быть записано в дифференциальной форме в виде:
dU= δQδA, (1)
где dU– изменение внутренней энергии тела;
δQ– сообщенное телу количество тепла;
δA– (знак «+») – работа, совершенная внешними силами (сжатие газа); (знак «–») – работа, совершенная телом (расширение газа).
В уравнении (1) QиAне являются полными дифференциалами, т.к. их величины зависят от пути перехода системы из одного состояния в другое, т.е. не являются функциями состояния. Они обычно обозначаются δQи δA(неполный дифференциал).
Уравнение (1) – первое начало термодинамикиили закон сохранения энергии в тепловых процессах. Если произошли конечные изменения системы, то первое начало термодинамики можно записать в виде:
ΔQ= ΔUΔA(2)
Рассмотрим применение первого начала к изопроцессам в газах.
1. Изохорический процесс(V=const)
dU = dQ – dA,
т.к. dA=PdV= 0, то
–
dU=dQ
По определению dQ=CудVmdT, для данного процесса
![]()
Т
dU~dT![]() ,
т.е. –закон Джоуля
,
т.е. –закон Джоуля
2. Изобарический процесс (P=const)
dU = dQ – dA (3)
По определению для данного процесса: ![]()
Подставляя в (3) имеем, с учетом (2): ![]()
Используя уравнение состояния: ![]() и выражение работыdA=PdV, получим:
и выражение работыdA=PdV, получим:
CvμdT=CpμdT–RdT
Cvμ=Cpμ–R
R=Cpμ–Cvμ
3. Изотермический процесс(T=const)
dU = dQ – dA,
т.к. ![]() ,
то
,
то
dQ=dA– подводимое тепло идет на внешнюю работу (расширение).
II. Адиабатический процесс.
Процесс, протекающий без теплообмена с внешней средой, называется адиабатическим(не переходимым).
Адиабатическими можно считать быстропротекающие процессы. Т.к. передачи теплоты нет, то dQ= 0.
dU+dA= 0
Для произвольной массы газа: ![]()
Из объединенного газового закона: ![]()
![]()
![]()
По уравнению Майера: R=Cpμ–Cvμи![]()
Обозначим
![]() ,
тогда:
,
тогда:![]() интегрируем
интегрируем
lnT+ (γ– 1)V=const→ потенциируем
|
Уравнение адиабаты идеального газа |
TVγ-1=const, (5) |
используя уравнение состояния можно получить уравнение адиабаты в координатах PиV.
|
Уравнение Пуассона |
РVγ=const, (6) |
Показатель степени в уравнении Пуассона γназываетсяпоказатель адиабаты, т.к. СРμ>CVμ, тоγ> 1.
Построим график уравнения (6) и сравним его с графиком изотермы.
|
|
Вычислим работу при адиабатическом процессе в идеальном газе (для 1 моля) dA+dU= 0, т.к.dU=CvμdT, то
Используя уравнение газового состояния,уравнение Майера,уравнение Пуассона, можно получить другие виды формулы работы для адиабатического процесса. |
Чтобы вычислить работу для произвольной
массы газа mнужно значение
работы умножить на число молей:![]() .
.