
- •1. Предмет орг.Химии. Этапы развития. Сырьевые источники. Функциональная группа. Классификация и номенклатура.
- •3. Теория строения Бутлерова. Формулы органических соединений. Формулы Льюиса. Электронная теория строения. Атомная и молекулярная орбитали. Способы образования ковалентной связи.
- •Формулы органических веществ по классам
- •4. Взаимное влияние атомов в молекулах органических соединений. Эффекты электронных смещений. Индуктивный и мезомерный эффекты. Эффект гиперконьюгации. Стерический эффект.
- •Классификация по направлению реакции
- •Нуклеофильные реагенты
- •Электрофильные реагенты
- •6. Кислоты и основания в орг.Химии. Сопряженная кислота и сопряженное основание. Кислотно-основные равновесия, примеры. Влияние заместителей в молекуле на кислотность и основность.
- •7. Типы изомерии в органической химии. Структурная, пространственная и оптическая изомерии. Хиральность. Комформация и конфигурация. R,s, z,e – номенкулатуры.
- •8. Строение алканов. Sp3- состояние углерода. Характеристика связей с-с и с-н. Принцип свободного вращения. Конформация. Способы изображения и номенклатуры. Физические свойства алканов.
- •10. Предельные углеводороды (алканы). Химические и физические свойства: реакции радикального замещения. Галогенирования, нитрирование, сульфохлорирование, сульфоокисление. Понятие о цепных реакциях.
- •Реакции радикального замещения
- •12. Алкены. Гомологический ряд. Номенклатура. Строение. Sp2 – гибридизация. Изомерия. Физические свойства. Способы получения из алканов. Механизм элиминирования. Правило Зайцева.
- •Дегидрирование алканов
- •Гидрирование алкинов
- •Реакции электрофильного присоединения
- •Применение
- •Физические свойства
- •Гидрогенизированный атом углерода – тот атом, к которому присоединен водород. Наиболее гидрогенизированный – там где больше всего н
- •Реакции олигомеризации
- •Строение бензола
- •Изомерия
- •Номенклатура
- •Изомерия
- •Номенклатура
- •1. Нитрование:
- •2. Галогенирование:
10. Предельные углеводороды (алканы). Химические и физические свойства: реакции радикального замещения. Галогенирования, нитрирование, сульфохлорирование, сульфоокисление. Понятие о цепных реакциях.
Физические свойства
В обычных условиях первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, а начиная с C18 – твердые вещества. Температуры плавления и кипения алканов их плотности увеличиваются с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями.
Химические свойства
Тривиальное (историческое) название алканов - "парафины" - означает "не имеющие сродства". Алканы химически малоактивны. Низкая реакционная способность алканов обусловлена очень малой полярностью связей С-С и С-Н в их молекулах вследствие почти одинаковой электроотрицательности атомов углерода и водорода. Предельные углеводороды в обычных условиях не взаимодействуют ни с концентрированными кислотами, ни со щелочами, ни даже с таким активным реагентом как перманганат калия.
Для них свойственны реакции замещения водородных атомов и расщепления.
Реакции радикального замещения
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть.
Галогенирование — это одна из реакций замещения. CH4 + Cl2 → CH3Cl (хлорметан) + HCl
Нитрование: RH + HNO3 → RNO2 + H2O.
Сульфохлорирование
(реакция Рида):
При
облучении УФ-излучением алканы реагируют
со смесью SO2 и
Cl2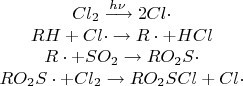
11. Предельные углеводороды ряда метана. Химические свойства: крекинг, дегидрирование, изомеризация, дегидроциклизация. Реакция окисления, частичное окисление, образование и распад гидропероксидов (автоокисление). Применение алканов.
|
Формула |
Название |
|
CH4 |
метан |
|
C2H6 |
этан |
|
C3H8 |
пропан |
|
C4H10 |
бутан |
|
C4H10 |
изобутан |
|
C5H12 |
пентан |
|
C5H12 |
изопентан |
|
C5H12 |
неопентан |
|
C6H14 |
гексан |
|
C7H16 |
гептан |
|
C10H22 |
декан |
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп - СН2-.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами.
Крекинг. При высокой температуре в присутствии катализаторов предельные углеводороды подвергаются расщеплению, которое называется крекингом. При крекинге происходит гомолитический разрыв углерод-углеродных связей с образованием насыщенных и ненасыщенных углеводородов с более короткими цепями.
CH3–CH2–CH2–CH3(бутан) ––400°C> CH3–CH3(этан) + CH2=CH2(этилен)
Окисление. В обычных условиях алканы устойчивы к действию кислорода и окислителей. При поджигании на воздухе алканы горят, превращаясь в двуокись углерода и воду и выделяя большое количество тепла.
В общем виде реакцию горения алканов можно записать следующим образом:
СnН2n+2 +(1,5n+0,5)O2 → nCO2 + (n+1)H2O.
Повышение температуры процесса ведет к более глубоким распадам углеводородов и, в частности, к дегидрированию, т.е. к отщеплению водорода. Так, метан при 1500ºС приводит к ацетилену. 2CH4 ––1500°C> H–C=C–H(ацетилен) + 3H2
Изомеризация.
Алканы нормального строения под влиянием катализаторов и нагревании способны превращаться в разветвленные без изменения состава молекул – изомеризация.
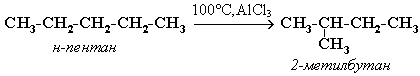
Применение
Первый в ряду алканов – метан – является основным компонентом природных и попутных газов и широко используется в качестве промышленного и бытового газа.
Средние члены гомологического ряда применяются как растворители и моторные топлива.
Жидкие углеводороды используются как горючее (они входят в состав бензина и керосина). Алканы широко используются в органическом синтезе.
