
- •1. Предмет орг.Химии. Этапы развития. Сырьевые источники. Функциональная группа. Классификация и номенклатура.
- •3. Теория строения Бутлерова. Формулы органических соединений. Формулы Льюиса. Электронная теория строения. Атомная и молекулярная орбитали. Способы образования ковалентной связи.
- •Формулы органических веществ по классам
- •4. Взаимное влияние атомов в молекулах органических соединений. Эффекты электронных смещений. Индуктивный и мезомерный эффекты. Эффект гиперконьюгации. Стерический эффект.
- •Классификация по направлению реакции
- •Нуклеофильные реагенты
- •Электрофильные реагенты
- •6. Кислоты и основания в орг.Химии. Сопряженная кислота и сопряженное основание. Кислотно-основные равновесия, примеры. Влияние заместителей в молекуле на кислотность и основность.
- •7. Типы изомерии в органической химии. Структурная, пространственная и оптическая изомерии. Хиральность. Комформация и конфигурация. R,s, z,e – номенкулатуры.
- •8. Строение алканов. Sp3- состояние углерода. Характеристика связей с-с и с-н. Принцип свободного вращения. Конформация. Способы изображения и номенклатуры. Физические свойства алканов.
- •10. Предельные углеводороды (алканы). Химические и физические свойства: реакции радикального замещения. Галогенирования, нитрирование, сульфохлорирование, сульфоокисление. Понятие о цепных реакциях.
- •Реакции радикального замещения
- •12. Алкены. Гомологический ряд. Номенклатура. Строение. Sp2 – гибридизация. Изомерия. Физические свойства. Способы получения из алканов. Механизм элиминирования. Правило Зайцева.
- •Дегидрирование алканов
- •Гидрирование алкинов
- •Реакции электрофильного присоединения
- •Применение
- •Физические свойства
- •Гидрогенизированный атом углерода – тот атом, к которому присоединен водород. Наиболее гидрогенизированный – там где больше всего н
- •Реакции олигомеризации
- •Строение бензола
- •Изомерия
- •Номенклатура
- •Изомерия
- •Номенклатура
- •1. Нитрование:
- •2. Галогенирование:
7. Типы изомерии в органической химии. Структурная, пространственная и оптическая изомерии. Хиральность. Комформация и конфигурация. R,s, z,e – номенкулатуры.
Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле, стерео-изомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Структурная изомерия: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Структурная изомерия
+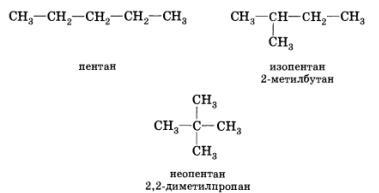
Изомерия углеродного скелета
Изомерия
положения обусловлена различным
положением кратной связи, заместителя,
функциональной группы при одинаковом
углеродном скелете молекулы: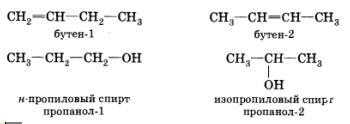
Пространственная изомерия Пространственная изомерия подразделяется на два вида: геометрическую и оптическую.
Геометрическая
изомерия характерна для соединений,
содержащих двойные связи, и циклических
соединений. Так как свободное вращение
атомов вокруг двойной связи или в цикле
невозможно, заместители могут располагаться
либо по одну сторону плоскости двойной
связи или цикла (цис-положение), либо по
разные стороны (транс-положение). 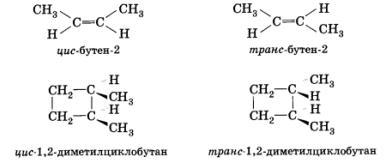
Оптическая
изомерия возникает, если молекула
несовместима со своим изображением в
зеркале. Это возможно, когда у атома
углерода в молекуле четыре различных
заместителя. Этот атом называют
асимметрическим. 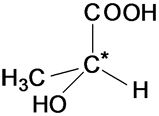
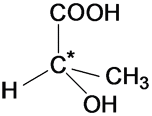
ХИРАЛЬНОСТЬ, св-во объекта быть несовместимым со своим отображением в идеальном плоском зеркале.
Различные пространственные структуры, возникающие за счет вращения вокруг простых связей без нарушения целостности молекулы (без разрыва химических связей), называют КОНФОРМАЦИЯМИ.
8. Строение алканов. Sp3- состояние углерода. Характеристика связей с-с и с-н. Принцип свободного вращения. Конформация. Способы изображения и номенклатуры. Физические свойства алканов.
Все
атомы углерода в молекулах алканов
находятся в состоянии sр3-гибридизации,
угол между связями С-C составляет
109°28',
поэтому молекулы нормальных алканов с
большим числом атомов углерода имеют
зигзагообразное строение (зигзаг). Длина
связи С-С в
предельных углеводородах равна 0,154 нм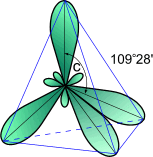
Связь С-С ковалентная неполярная. Связь С-Н ковалентная слабополярная, тк С и Н близки по электроотрицательности.
Физические свойства
В обычных условиях первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, а начиная с C18 – твердые вещества. Температуры плавления и кипения алканов их плотности увеличиваются с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями..
Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным.
Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Вращение атомов вокруг s-связи не будет приводить к ее разрыву. В результате внутримолекулярного вращения по s-связям С–С молекулы алканов, начиная с этана С2Н6, могут принимать разные геометрические формы. Различные пространственные формы молекулы, переходящие друг в друга путем вращения вокруг s-связей С–С, называют конформациями или поворотными изомерами (конформерами). Поворотные изомеры молекулы представляют собой энергетически неравноценные ее состояния. Их взаимопревращение происходит быстро и постоянно в результате теплового движения. Поэтому поворотные изомеры не удается выделить в индивидуальном виде, но их существование доказано физическими методами.
Общее (родовое) название предельных углеводородов — алканы. Названия первых четырех членов гомологического ряда метана тривиальные: метан, этан, пропан, бутан. Начиная с пятого названия образованы от греческих числительных с добавлением суффикса –ан
9. Углеводороды. Классификация. Предельные углеводороды ряда метана. Гомологический ряд. Номенклатура. Изомерия. Радикалы. Природные источники. Синтез Фишера-Тропша. Методы получения ( из алкенов, карбоновых кислот, галогенпроизводных, по реакции Вюрца)
|
УГЛЕВОДОРОДЫ | ||||
|
Ациклические Нет замкнутых цепей в углеродном скелете |
Циклические В углеродном скелете есть хотя бы один цикл | |||
|
Насыщенные Все связи в молекуле одинарные |
Ненасыщенные Есть хотя бы одна кратная связь |
Алициклические Нет ароматической системы связей |
Ароматические Ароматическая система связей присутствует | |
Общее (родовое) название предельных углеводородов — алканы. Названия первых четырех членов гомологического ряда метана тривиальные: метан, этан, пропан, бутан. Начиная с пятого названия образованы от греческих числительных с добавлением суффикса –ан
Свою номенклатуру имеют и радикалы (углеводородные радикалы). Одновалентные радикалы называют алкилами и обозначают буквой R или Alk. Их общая формула CnH2n+ 1 . Названия радикалов составляют из названий соответствующих углеводородов заменой суффикса -ан на суффикс -ил (метан — метил, этан — этил, пропан — пропил и т.д.). Двухвалентные радикалы называют, заменяя суффикс -ан на -илиден (исключение - радикал метилен ==СН2). Трехвалентные радикалы имеют суффикс -илидин
Изомерия. Для алканов характерена структурная изомерия. Если в молекуле алкана содержится более трех углеродных атомов, то порядок их соединения может быть различным. Один из изомеров бутана (н-бутан) содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную (изостроение).
Важнейшим источником алканов в природе является природный газ, минеральное углеводородное сырье- нефть и сопутствующие ей нефтяные газы.
Получение алканов можно осуществить реакцией Вюрца, заключающейся в действии металлического натрия на моногалогенопроизводные углеводородов. 2CH3–CH2Br(бромистый этил) + 2Na ––> CH3–CH2–CH2–CH3(бутан) + 2NaBr
Из алкенов
CnH2n + H2 → CnH2n+2
Синтез Фишера — Тропша
nCO + (2n+1)H2 → CnH2n+2 + nH2O
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп - СН2-.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами.
|
Формула |
Название |
|
CH4 |
метан |
|
C2H6 |
этан |
|
C3H8 |
пропан |
|
C4H10 |
бутан |
|
C4H10 |
изобутан |
|
C5H12 |
пентан |
|
C5H12 |
изопентан |
|
C5H12 |
неопентан |
|
C6H14 |
гексан |
|
C7H16 |
гептан |
|
C10H22 |
декан |
|
|
|
