
- •Книга выпущена при содействии оао "Газпром"
- •Скобло а.И., Молоканов ю.К., Владимиров а.И., Щелкунов вл-
- •Гэрячая струя
- •1 Потери II Нефть *н.О f отбензиненная
- •Глава I основные понятия
- •Глава II равновесные системы
- •Глава III испарение и конденсация
- •Глава IV ректификация
- •Глава V азеотропная и экстрактивная
- •Глава VI абсорбция и десорбция
- •Глава VII основные типы и расчет
- •Глава IX экстракция
- •Глава X сушка
- •Глава XII отстаивание
- •Глава XV электрическое осаждение
- •XlnR2/ я,dx
- •0,7(Лг£ iVin 106
- •Глава XVI разделение газовых
- •Глава XVII перемешивание жидкостей
- •Глава XVIII гидродинамика слоя
- •Глава XX классификация и дозирование
- •0 “ Ccpw
- •Расчет конвекционной поверхности
- •Нефтяного сырья
- •Глава XXIII основные закономерности
- •X, % (масс.)
- •Глава XXIV реакционные аппараты
- •Нагреватели 566 огневые 504
Глава III испарение и конденсация
СУЩНОСТЬ ПРОЦЕССОВ ИСПАРЕНИЯ И КОНДЕНСАЦИИ
Испарение
—процесс перехода вещества из жидкого
или твердого состояния в парообразное
(газообразное). Испарение твердых тел
— процесс непосредственного перехода
при нагревании твердого тела в
парообразное, минуя жидкое состояние,
называют возгонкой или сублимацией.
Испарение
лежит в основе многих процессов
нефтегазопереработки при разделении
веществ (например, ректификация,
перегонка,нагрев сырья втрубчатых
печах,регенерация растворителей), регазификации
сжиженных газов,сушке.
Испарение может происходить с поверхности жидкости и в ее объеме, последнее называют кипением.Процесс испарения интенсифицируется с повышением температуры и понижением давления. Для отрыва молекул от жидкой фазы и перехода их в паровую или газовую необходимо затратить энергию, называемуюскрытой теплотой испарения.Теплота испарения по своей величине равна теплотеконденсациии зависит от температуры и давления процесса, уменьшаясь с приближением их ккритическим величинам.При испарении в адиабатических условиях тепло отбирается от испаряющейся жидкости, вследствие чего происходит ее охлаждение. Испарение в закрытой емкости происходит до тех пор, пока насыщенные пары вещества не заполнят пространство над жидкостью.
Конденсация— процесс перехода вещества из
парообразного состояния в жидкое;
осуществляется путем охлаждения или
сжатия и охлаждения пара при температурах
ниже критических для данного вещества,
при этом процесс сопровождается
выделением теплоты конденсации. При
конденсации резко уменьшается объем
среды и образуется вакуум. Это
обстоятельство обусловило использование
конденсаторов для создания вакуума.
Конденсация применяется для: получения
в жидком виде продуктов, выводимых
из аппаратов в парообразном состоянии;
сжижения природных, попутных газов,
паров хладагентов в холодильных
установках и т.п.
Процесс
частичного испарения жидкости или
конденсации паров, проводимый для
получения одного из продуктов обогащенного
НКК или высококипящим ВКК, называется
перегонкой.Образующийсяпри
этом отгон
в паровой фазе, обогащенный НКК, подвергают
в дальнейшем конденсации.
Испарение жидкости или конденсацию паров осуществляют различными способами: однократным, многократным и постепенным.
Однократное испарение (ОН) и однократная конденсация (ОК). Эти
процессы характеризуются тем, что образовавшиеся паровая и жидкая фазы не разделяются до окончания процесса, а при достижении конечной температуры их разделяют в один прием, однократно. При этом принимают, что образовавшиеся паровая и жидкая фазы находятся в состоянии равновесия. Примером процесса ОН является частичное испарение жидкого сырья, поступающего в ректификационную колонну из трубчатой печи.
Многократное испарение и многократная конденсация. Эти процессы состоят в неоднократном повторении процессов ОН или ОК для более полного разделения исходной смеси. Так, многократное испарение состоит из повторяющегося процесса однократного испарения. Образовавшиеся
Рис.
ИМ. Схемы основных видов процессов
испарения и конденсации:
а
— в —испарение: а — однократное (ОИ);6
—многократное (двукратное);в
—
постепенное;
г
— е—
конденсация:z— однократная
(ОК);д— многократная (двукратная)1, е
— постепенная.1,
V
—испарители;2,
2\ 5,
5’ —сепараторы;3,
3'—
конденсаторы;4
— приемники
при испарении пары отделяют в несколько ступеней. Причем во второй ступени осуществляется ОИ жидкой фазы, образовавшейся в первой ступени, а в третьей ступени — ОИ жидкой фазы, поступающей из второй ступени разделения, и т.д. Соответственно при многократной конденсации на последующую ступень разделения поступают пары, оставшиеся после отделения от них конденсата на предшествующей ступени разделения.
Постепенное испарение и постепенная конденсация. Эти процессы осуществляются так, что пары, образовавшиеся при испарении (или жидкость при конденсации), удаляются из системы непрерывно в момент их образования. Образовавшиеся в системе паровая и жидкая фазы всегда находятся в состоянии равновесия. Процессы постепенного испарения и конденсации можно рассматривать как предельный случай многократного процесса при бесконечно большом числе ступеней разделения. Примером процесса постепенного испарения является перегонка из куба периодического действия.
В промышленных установках процессы испарения и конденсации проводятся при изобарных или близких к ним условиях.
На рис. Ill-1 приведены схемы основных видов процессов испарения и конденсации.
ОДНОКРАТНОЕ ИСПАРЕНИЕ (КОНДЕНСАЦИЯ)
Бинарные смеси. Рассмотрим материальный и тепловой балансы процесса ОИ двухкомпонентной смеси.
Материальный баланс процесса однократного испарения может быть представлен уравнениями: общий
F=G+ д;
для
низкокипящего компонента Fxf
=
Gy+
дх.
Совместное
решение приведенных уравнений дает
выражение xF= еу + (l-ejx,
где
отношение массы образовавшихся паров
Gк массе исходной смесиF
называетсямассовой
долей отгонаи обозначается через е.
Аналогично может быть составлено уравнение материального баланса ОИ в мольных единицах:
Хр
= е'у'+ (l-е'^х'. (III.
1)
Отношение
GкFестьмольная
доля отгона,обозначаемая через е'. Поскольку
образовавшийся пар и жидкий остаток
находятся в равновесии, т.е.
У'
= Ках\
уравнение
(III. 1) можно представить
в виде
Заменив
хсогласно уравнению (11.29), получим
X'f [Ка -Kw- 1 — К,
е' =
Ka-l^l-Kw^
Из
уравнения (III.2) можно
определить мольную долю отгонаепри заданной мольной концентрации НКК
в исходной смесиxFи известных температуреtи давлениипв сепараторе.
Для взаимного пересчета массовой еи мольнойе’долей отгона проведем следующие преобразования. Число молей образовавшихся при ОИ паров равноFe/MytгдеМу —средняя мольная масса паров. Это же число молей будет равноFeVMCM,гдеМсм —мольная масса исходной жидкой смеси. Отсюда получим соотношение
еМсм - с'Му. (Ш.З)
Обычно Мсм>Му,поэтому е' > е.
Возможны случаи, когда значения давлений насыщенных паров компонентов существенно различаются, т. е. Ра » PwилиКа » Kw .В этих условиях ВКК можно считать практически нелетучим (например, отгонка растворителя от масла) и для расчета доли отгона е' можно использовать более простое соотношение
Процесс
ОИ связан с подводом тепла Qa.Без учета теплопотерь тепло, которое
содержится в паровой и жидкой фазах,
образовавшихся в результате процесса
ОИ, должно быть равно теплу исходной
жидкостиOf
и
теплуQBtподведенному со стороны для осуществления
процесса испарения:
О F+Qв ~Fhtp + Ов — GHt+ght .
Имея
в виду, что д=
F-
G,
(
он
'
К*
у
V
г
У
ч-
-Л/
Введем понятие о приведенной энтальпии сырья 0, которая определяет количество введенного тепла, приходящегося на единицу массы исходного сырья
0
= ht
+
*F
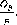
Тогда можно записать
Gв - л,xF-х е = — = — = —
(III
.4)
F Ht -ht У-*
На
энтальпийной диаграмме уравнение
(III.4) представляет собой
уравнение прямой, проходящей через три
точки (рис.III-2):c(xfl0),w(x,
ht)
иd(y,Н,).
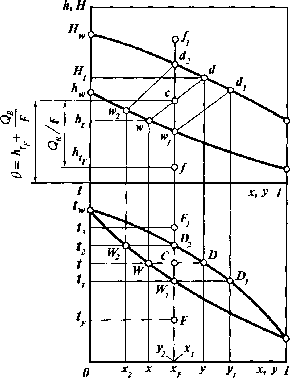
Процесс однократного испарения (однократной конденсации) можно проанализировать при помощи изобарных температурных кривых и энтальпийной диаграммы.
Исходной
жидкой смеси, поступающей на ОИ при
температуре tFи концентрации НККxFtотвечает точкаFна графике изобар и точка / на энтальпийной
диаграмме. На обеих диаграммах нагревание
исходной жидкой смеси от температурыtFдо температурыt,соответствует перемещению по
вертикали: на графике изобар от точкиFдо точкиWitа на энтальпийной диаграмме от точки
/ доwt,при этом состав исходной смеси не
меняется. В точкеWt(илиWj) температура смесиtf(или энтальпия) соответствует
температуре ее кипения при е = 0.
Образующийся при этом пар у;находится в равновесии с исходной жидкостью.
Для
осуществления нагрева сырья от температуры
tFдоtему сообщается теплоОв(точки С и с). Положение точки с определяется
ординатой 0 и абсциссойxF,а точки С — ординатойtи абсциссойxF.
В
точке С (или с) система будет состоять
из жидкой и паровой фаз составов хи у. Составы и энтальпии жидкости и пара,
образовавшихся в процессе ОИ, определяются
точкамиW(илиw)
и
D(илиd).
Уравнение
(III.4) соответствует прямой wd.Сопоставив это уравнение с отрезками
прямых на рис. Ш-2, получим соотношение:
Рис. Ш-2. Процесс ОИ (ОК) бинарной смеси на изобарных температурных кривых и энтальпийной диаграмме
н
а

WC wc е = —,
WD wd
т.е.
отрезок WC(илиwc)пропорционален массе отгонаG.Соответственно отрезокCD(илиcd)пропорционален массе жидкого остатка.
Длина конодыWD(илиwd)пропорциональна массе исходной жидкой
смесиF.
При
нагреве смеси до температуры t2она полностью перейдет в парообразное
состояние (е = 1). Состав образовавшегося
парау2соответствует точкеD2(илиd2),при этому2=xF.Состав и энтальпия последней порции
жидкости определяются точкамиW2иw2.
Величина
х2показывает, что четкого разделения
компонентов путем ОИ достичь не удается,
так как в конце испарения в жидкости
еще содержится значительное количество
НКК;t2есть температура конца однократного
испарения.
При
температуре системы t2
>
t2(точкиF,
иf}),
более высокой, чем температура конца
однократного испарения, система будет
состоять из перегретых паров составаxF.
При
понижении температуры системы от t3доtFбудет происходить охлаждение паров, а
начиная с точки £>2(илиd2)
— их конденсация.
Степень
конденсации гпаровой фазы при температуреtопределится следующим образом:
1 д F -G CD cd
Г
=1-е = — = = = .
F F WD wd
При
понижении температуры паров длина
отрезка CD(илиcd)увеличивается, что соответствует
повышению степени конденсации.
Многокомпонентные смеси. При разделении многокомпонентных и сложных смесей, характерных для нефтегазопереработки и нефтехимии, любой компонент путем однократного испарения будет распределяться в определенном соотношении между отгоном и остатком.
Материальный баланс процесса однократного испарения для любого (z-го) компонента многокомпонентной смеси запишется в виде
*Ь=е'У\+(l-e')x;. (III.5)
Образовавшаяся паровая фаза состава у/ будет находиться в равновесии с жидким остатком состава х/, т. е.
у/ = к, х; .
С
учетом этого, уравнение (III.5) можно
представить в виде x'F
=
е'К, х'+ (l- е')х'.
Следовательно, покомпонентный состав жидкого остатка будет определяться выражением
(Ш.6)

Поскольку
I*; =i.
/=1
то из уравнения (III.6) получим
i,F
1 + е'\ К; - 1

л
= 1.
(III.7)
у
Уравнение (III.7) связывает долю отгонае,температуру и давление системы. В этом уравнении температура системы присутствует в косвенном виде, оказывая влияние через посредство давления насыщенных паров (констант фазового равновесия) компонентов, являющегося функцией температуры.
При заданных составе исходной смеси x‘iF,давлениики температуреtуравнение (III .7) используется для определения методом последовательных приближений доли отгона е'. С этой целью задают значение доли отгонае\определяют по уравнению (III.6) концентрации компонентов в жидкой фазе и затем проверяют выполнение уравнения (III.7). Если полученная сумма равна единице, то значение доли отгона е' выбрано правильно. В противном случае необходимо задать новую величинуе\добиваясь, чтобы сумма, стоящая в левой части уравнения (III.7), стала равной единице с желаемой степенью точности.
При полном ОИ исходной смеси е' = 1, тогда из уравнения (III.7)
получим
т.е. приходим, к уравнению изотермы паровой фазы.
Из
уравнения (IIL8) можно
определить температуру начала конденсации
паров при заданном давлениик.
Уравнение (III.7) дает большую точность при больших долях отгона. При малых долях отгона используют другое уравнение.
Выразив
х/через у/ согласно уравнению равновесия,
и подставив полученное в уравнение
(III.5), получим
Kf
=
е'к,у; +(l-e')-—
' К]
или
l + e'lKj - 1
Поскольку
±у;=i-
то
=
1. (III.9)
Это
уравнение и используется для расчетов
при малых долях отгона ё.
Из
уравнения (III.9) методом
последовательных приближений можно
найти температуру кипения смеси прие= 0:
п

1=1
Это и есть уравнение изотермы жидкой фазы.
Мольные массы паровой и жидкой фаз, образующихся в процессе ОИ, определяют по уравнениям: для паровой фазы
= X М, у';
;=1
для
жидкой фазы м,=£
м,
/=1
Массовую долю отгона находят по уравнению (III.3).
Массовые
концентрации любого компонента в
равновесной паровой и жидкой фазах
определяют из соотношений
Приведенные выше уравнения для расчета однократного испарения многокомпонентной смеси могут быть использованы и для расчета однократной конденсации многокомпонентной смеси, так как составы фаз и их относительные количества зависят только от конечных температуры и давления, а не от того, каким путем данная система получена: нагревом и однократным испарением жидкости или охлаждением и однократной конденсацией паров.
При однократной конденсации многокомпонентной смеси е‘(илие) определяет мольную (или массовую) долю несконденсировавшихся паров, а 1 —е —г' (или 1 — е = г) — мольную (или массовую) долю образовавшегося конденсата.
Уравнения (III.7) и (Ш.9) могут быть использованы также для определения температуры смеси при заданных давлении и доле отгона или давления при заданных температуре и доле отгона.
Сложные смеси. При расчете ОН (или ОК) нефти и нефтепродуктов, содержащих весьма большое число компонентов (так называемые сложные смеси), исходный продукт разбивают на ряд фракций, кипящих в узких температурных пределах. Свойства каждой узкой фракции отождествляют со свойствами индивидуального компонента, температура кипения которого равна средней температуре кипения данной узкой фракции. За концентрацию принимают относительное содержание рассматриваемой узкой фракции в смеси. Определение доли отгона, состава фаз и температуры системы производят по уравнениям, приведенным выше для многокомпонентной смеси.
Более точные результаты могут быть получены при представлении нефтяных смесей, состоящих из бесконечно большого числа компонентов и характеризуемых непрерывными (интегральные и дифференциальные) кривыми распределения составов.
На рис. Ш-З приведены типичные кривые распределения составов сложной смеси.
Кривые
распределения отражают зависимость
состава смеси от коэффициента
относительной летучести а, который
соответствует определенной температуре
кипения компонента t.При изображении кривых распре-
б
а
и
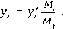
Х(а)
Х(а)
Рис. Ш-З. Кривые распределения составов сложной смеси: а — интегральная; 6 — дифференциальная
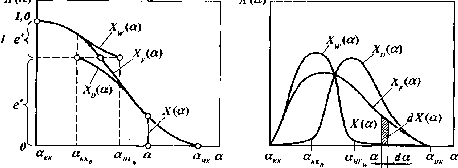
деления составов малыми концентрациями ВКК в отгоне и НКК в остатке можно пренебречь и определять составы в пределах изменения относительной летучести от акк^ до анк, и от аккдо анк^ соответственно для отгона и остатка.
Наибольшую
величину коэффициента относительной
летучести (анк)
имеет
НКК, наименьшую (акк)— ВКК. На интегральной кривойх'(а)дано суммарное содержание всех
компонентов, коэффициенты относительной
летучести которых имеют пределы от а
доанк.Одна из форм уравнения для представления
таких кривых имеет вид
(ШЛО)
|
|
|
1 а 1д |
2 |
|
х((а) = ехр |
-а |
| |
|
|
|
^ ®кк у |
|
где
а
—постоянный коэффициент для данной
смеси.
Дифференциальная
кривая распределения Х'(а)
дает зависимость
*,(<*)
dx'(a)
da
Если
продифференцировать уравнение (ШЛО) по
переменной а,то получим
ig-
a
X'
(a)
=
- = 0,8686a
—exp
da
a
|
|
(. а ' |
2~ |
|
-а |
ig— |
|
|
|
1
aKK
|
|
Очевидно, что
a
x'(a)=j*X'(a)da.
«НК
Материальный баланс процесса ОИ сложной смеси можно записать следующим образом:
x'F
(a) = e'x'D
(a) + (l - e')x^ (a)
или в дифференциальной форме
X'F(a)da=e'X'D(a)da+ (l-e')x^,(a)da. (III.
11)
Поскольку пары отгона и жидкий остаток находятся в равновесии, то можно записать, что
X'D
(a) = tf(a)x^
. (III. 12)
Из уравнений (III. 11) и (ШЛ2) получим:
Из
уравнения (III. 15) методом последовательных
приближений можно определить долю
отгона епри заданных температуре и давлении
системы, а затем по уравнениям (III. 14) и
(III* 12) рассчитать кривые распределения
остатка и отгона (см. рис. Ш-З).
При
е= 1 получаем уравнение изотермы паровой
фазы сложной смеси
1
+ e'fff(a)
- ll
<*ккПроинтегрировав
выражение (III.
13) в
пределах от до а**, получим
X’F
(a)da = (l + e'[x(a - l)|x^ (a)da, откуда
, x X'F (ajda
Xw
«^a
= г1/, ,
v ' 1 + еШ-1
(III.
13)
ИЛИ
X^(a)
=
X'F (a)
(III.
14)
I
«НК
X'F |ajda 1 + е'[к(а) - l]
-1.
(III.
15)
Из выражения (III. 16) методом последовательных приближений может быть найдена температура начала конденсации сложной смеси.
При малых долях отгона для расчета е' можно использовать аналогичное выражение, полученное из уравнения (III. 11) в случае замены
Х^(а) на согласно уравнению равновесия.
Из уравнения (III. 11) получим
Хо
(a)d
a
=
K(ajXp (ajda 1 + e |к(а) - l|
(III.17)
или
tf(ajx^
(a)
1 + е'[к(а) - lj
(111*18)
акк
J
“нк
к[ар(р (ajda 1 + e'|/((aj - lj
=
1.
Долю отгона е' сложной смеси находят методом последовательных приближений по уравнению (III. 18).
При
е= 0 получим уравнение изотермы жидкой
фазы для сложной смеси
«кк
Jк(aJXF(ajda= 1.
aHK
Из этого выражения методом последовательных приближений можно определить температуру начала кипения сложной смеси.
При
расчете однократного испарения
(конденсации) многокомпонентных и
сложных смесей углеводородов в присутствии
водяного пара используются приведенные
выше уравнения при условии замены
величины общего давления кна парциальное давление углеводородовк—р
2.
МНОГОКРАТНОЕ ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
Процессы многократного испарения или конденсации состоят из повторяющихся в несколько ступеней процессов однократного испарения или конденсации с отводом паров и жидкости после каждой ступени (см. рис. Ill-1). При этом могут быть получены несколько продуктов, в различной степени обогащенных НКК.
Процесс многократного испарения (конденсации) бинарной смеси можно наглядно проанализировать при помощи графика изобарных температурных кривых и энтальпийной диаграммы.
Пусть многократному испарению (рис. Ш-4) подвергается жидкость с
содержанием
НКК xF,находящаяся первоначально при температуреtF
(точкаF).
Если
первое ОИ произвести при температуре
tuто будут получены составы жидкой и
паровой фаз х, и у,. При этом доля отгона
на первой ступени составит
л -
* 1 -ЩС\
- w\
с\
с\»
У\ - х\ Щ D\ щ d\
а относительное количество неиспарившейся жидкости
У\ - х\ w\ Di wi d\
Если
масса исходной жидкости составляла F,то после первой ступени ОИ масса жидкого
остатка будет равна
д - рг — р У\ ~ XF _ р Cj Dj -- р С1 dl У\ - *1 Щ D\ w\ <k
Жидкий
остаток после первой ступени ОИ подвергают
однократному испарению во второй ступени
при температуре t2.Образовавшаяся паровая и жидкая фазы
будут иметь составых2и у2.
оз

Доля
отгона на второй ступени ОИ будет равна
Рис. III-4. Графическое представление процесса многократного испарения бинарной смеси
„ _
*1-*2_W2
С2_W2C2
с2
-х2W2°2
W2d2
а доля
неиспарившейся жидкости
У2
- *2
=
1 - е
У2 ~х2 W2°2 w2d2
Масса
жидкого остатка, полученная на второй
ступени ОИ равна
У'у ~ Хг C-yDsy C2d2
g-i = дд2 = д . ——- = д\ т^Чг- = ?•
w2D2
^2d2
или
д2
= gt
г2=ftjг2
=р( 1 - е,)(l
- е2).
После
третьей ступени испарения при температуре
t3доля отгона равна
„ * х2 “*3 _ W3C3 -W3C3
е3 -
Уз ~х3 W3°3 w3d3
доля неиспарившегося остатка
г. _ 1лУз ~ х2 _C3D3 __c3d3
i3 — i— с3 ,
Уз - *3 W3D3 w3d3 а масса оставшейся жидкости
9з = 92гз = ^ ЬЬ = F(l - ei )(l - e2)(l - е3).
Продолжая
аналогичные рассуждения, получим, что
после проведения кступеней однократного испарения масса
жидкости составит
я. ='Т[(>-4
Г = 1 1=1
Поскольку г, = ^1 - е, ) < 1, то увеличение числа ступеней ОН приводит
к уменьшению массы остатка в каждой последующей ступени.
В
рассматриваемом примере температура
третьей ступени испарения t3
(рис.
Ш-4) равна температуре полного однократного
испарения жидкости с той же начальной
концентрацией НКК, равнойxF.В условиях трехкратного испарения
такая жидкость не переходит полностью
в паровую фазу и вес оставшейся жидкости
равенд3.Следовательно, при нагреве до одной и
той же температуры в условиях однократного
испарения обеспечивается большая доля
отгона, чем при многократном испарении.
Очевидно,
что для достижения одинаковой доли
отгона в условиях однократного
испарения требуется более низкая
температура, чем при многократном
испарении; при этом остающаяся после
однократного испарения жидкая фаза
будет содержать больше НКК, чем жидкий
остаток той же массы, полученный при
многократном испарении. Таким образом,
при многократном испарении обеспечивается
лучшее разделение компонентов, чем при
однократном испарении. Процесс
многократного испарения может
осуществляться при температурах выше
температуры полного однократною
испарения t3и продолжен вплоть до температуры
кипения чистого ВКК, равнойtw.Однако выход достаточно чистого ВКК
будет весьма мал.
Как
видно из рис. Ш-4, течение процесса
многократного испарения характеризуется
линией WC{WJC2W2C3W3.Увеличение числа ступеней испарения
графически характеризуется уменьшением
площадокWClW]
,
w;C2W2,W2C3W3.
При
бесконечно большом числе ступеней
испарения эти площадки превратятся в
точки и течение процесса испарения
изобразится перемещением из точки
Wв точкуW3по кривой кипения. Такой процесс является
процессомпостепенного
испарения.
На энтальпийной диаграмме (рис. Ш-4) процесс трехкратного испарения изобразится ступенчатой линией wc] WjC2w2c3w3.
Рассмотрим
процесс многократной конденсации (рис.
Ш-5). При охлаждении паров с начальной
концентрацией НКК yFот температурыtF
(точкаF]до температуры произойдет их частичная
конденсация. Масса парового остатка
будет равна
G,
=
Fe,
=
Fу—
X-±=F=F^L£x.,
У i-X|W,D,Wi<*,
Рис. III-5. Графическое представление процесса многократной конденсации бинарной смеси
У2
-*2t2,в результате чего часть паров вновь
сконденсируется. При этом остаток паров
G2
=
G,e2
=
G,
^
= G,
=
F
w2d2
ЩС\
W,D,
W2C2
_
w2d2
= F-^ .^ = Fee = F(1 - r )(1 - r ).
^1d1w2d21212
Паровой остаток после &-й ступени однократной конденсации составит
с.=рйе.^ПН)-
1=1 i=l
Поскольку е, = - г, ) < 1 гто увеличение числа ступеней ОК приводит
к уменьшению массы остатка в каждой последующей ступени.
Процесс
многократной конденсации можно проводить
вплоть до ta
—
температуры
кипения НККГоднако выход НКК
высокой степени чистоты будет мал.
При сопоставлении однократной и многократной конденсации соображения, аналогичные предыдущим, позволяют сделать следующие выводы.
При одинаковой конечной температуре конденсации вес конденсата при однократном процессе больше, чем при многократной конденсации. При одинаковой степени конденсации конечная температура процесса в условиях однократной конденсации выше, чем при многократной конденсации, и потому концентрация НКК в остатке паров меньше.
Процесс
конденсации в три ступени на графике
изобарных температурных кривых
характеризуется ступенчатой линией
DC^
DlC2D2C2D2.С увеличением числа ступеней конденсации
площадкиDQЦ ,D(C2D2иD2C2D2уменьшаются и при бесконечном числе
ступеней они превращаются в точки.
Течение процесса в этом случае изобразится
перемещением из точкиDв точкуD3по кривой
конденсации. Такой процесс называется
ло-степенной
конденсацией.
Процесс
трехкратной конденсации на энтальпийной
диаграмме характеризуется ступенчатой
линией dc,d]
c2d2c3d2.
ПОСТЕПЕННОЕ ИСПАРЕНИЕ (КОНДЕНСАЦИЯ)
Бинарные
смеси. Рассмотрим постепенное испарение
бинарной системы. Пусть в какой-то
произвольный момент времени масса
загрузки в испарителе будет д, а
концентрация НКК в ней х, При бесконечно
малом изменении температуры часть
жидкости dgиспарится, а состав жидкой фазы изменится
на величинуdxи станет равным х —dx.
При
этом образуется паровая фаза состава
у.
Уравнение материального баланса по НКК для такого элементарного процесса запишется следующим образом:
дх = ydg+ {д -dg)[x-dx).
Отбросив бесконечно малые второго порядка, после преобразований получим
dg _ dx
д У ~ х
Проинтегрировав
это дифференциальное уравнение в
пределах от начального состояния
системы FиxFдо некоторого промежуточного состояниядих, получим
(IIIЛ
9)
Это уравнение носит название уравнения Рейлея,
Поскольку образующиеся в процессе постепенного испарения пары состава у находятся в равновесии с жидкостью состава х, то, заменив у в уравнении (III. 19) согласно уравнению равновесия
4 - 1Я К)
97
У =
Fxp-g*
=
Fxf
-
ях
р-д
о
+
1
(а
- l|x
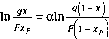
(III.20)
В
таком виде уравнение Рейлея используется
для определения средней величины
коэффициента относительной летучести
а
по результатам постепенной перегонки.
Из
материального баланса постепенной
перегонки определяются средний
состав отогнанного продукта (фракции)
_ Я>х> _ 9,хI -9i+iXj+\
Я, -9i+\ Д
и
средний состав отгона
У о ~
Аналогичный
анализ может быть проведен и для процесса
постепенной конденсации.
Материальный
баланс процесса для бесконечно малой
массы сконденсированных паров
запишется следующим образом:
Gy
=
xdG
+
(G
-
dG)(y
+ cfy).
Отсюда
получим следующее дифференциальное
уравнение:
dG _ dy ~G ~ у - x ‘
Проинтегрировав
это уравнение в пределах от F
и
yF
до
G
и
у,
получим
I
dG
G
у
Г dy J у - х Ур
или (F >G; уF < у)
dy
у- х
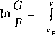
Если
принять во внимание состояние равновесия
между паровым остатком состава у и
конденсатом состава х,
то после интегрирования получим
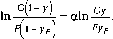
Это уравнение также может быть использовано для определения средней величины коэффициента относительной летучести в интервале температур конденсации.
Средний состав образовавшегося конденсата (жидкой фракции) определяется из материального баланса процесса постепенной конденсации:
для жидкой фракции
v — 6f| У/ — б, +1 У Г +1 .
Ам-1 I
6, - Q+i
для всего конденсата
_ Fy р ~ Gy _ Fyp - Gy w F-G W
Из
полученных уравнений определяются
массы неиспарившейся жидкости дпри постепенном испарении и
нескоцденсировавшихся паровG
при
постепенной конденсации.
Многокомпонентные смеси. При постепенном испарении многокомпонентной смеси происходит постепенное изменение ее состава по мере увеличения температуры перегонки.
Обозначим число молей жидкости в произвольный момент времени
через
д\а то же для 1-го компонента — черезд*, тогда
<7' = £д;-
1=1
При бесконечно малом изменении температуры жидкости образуется масса паров
dg' = Y^dg’
1-1
и
соответствующие порции компонентов
dg{перейдут из жидкой в паровую фазу.
Концентрации любого компонента будут
равны: в паровой фазе
v'
-d3i_d$;.
У'
" dg'
1
dg;
/-1
в жидкой фазе
.
/ _ Qj
Qj
i~~п~ '
1=1
При этом образовавшиеся пары будут находиться в равновесии с жидкостью, т.е.
= Ktх;
Yi
Приняв во внимание вышеприведенные уравнения, получим
Проинтегрировав это дифференциальное уравнение в пределах от
-0- = к SL
dg' ' g'
f
Щ- = к{
9l
dg'
F(дод'и отF'дод\получим его решение в следующем виде
(при постоянной величинеК,}:
lnii-=
к
in£l.
F’ F’
1 i
Аналогичное
уравнение можно записать и для другого
к-го
компонента смеси
ln-^-
=КЛп—.
с* F'
Приняв
во внимание, что коэффициент относительной
летучести z-го компонента
по сравнению ск-м
а
i.k
К
к
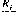
Г
придем к следующему уравнению:
In
——
= аа1п
F!
F'
гк
Если обозначить мольную долю отгона в дистиллят через
е' = 1-£-, F'
то
д; =F'(l-e')x;, g'=F'(l-e'), F' =F%f,
=
a,itlnv(*
- е'К
1 0 - е')х*
In
*i.F
xk,F
Это
же уравнение можно использовать для
расчета постепенной конденсации,
имея в виду, что при конденсации 1 -е' =
г'есть доля конденсации исходных паров,
а начальный состав жидкостих'по любому компоненту определяется
из условия равновесия с исходным паромy\F.
Концентрации
компонентов смеси x'iдолжны удовлетворять уравнению
изотермы жидкой фазы
п

Обычно предварительно задаются температурой конца процесса, определяющей величины Р(, затем по уравнению (III.22) определяют составы
х\при заданныхеих'ки проверяют их на соответствие уравнению
изотермы жидкой фазы.
Для бинарной смеси уравнение (III.22) приводится к виду
(l-eV fl-e'Yl-x')
In^=CClnА А1,
x'F 1 - Хр
т. е. к виду, аналогичному уравнению (III.20).
