
Тест по теме 2.3.: Химическая кинетика
|
|
1-й уровень |
|||||||||||||||||||||||||
|
2.3.1.2./1 |
1. Средняя скорость гомогенной реакции выражается формулой: Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.7./1 |
2. Математическая зависимость скорости реакции от температуры описывается:
Эталон ответа: в).
|
|||||||||||||||||||||||||
|
2.3.2.7./2 |
3. Математическая зависимость скорости реакции от температуры описывается уравнением: Эталон ответа: г).
|
|||||||||||||||||||||||||
|
2.3.2.7./3 |
4. Температурный коэффициент скорости химической реакции принимает значения:
Эталон ответа: в).
|
|||||||||||||||||||||||||
|
2.3.1.3./2 2.3.2.11./1 |
5. Измельчение твердого вещества скорость химической реакции
Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.9./1 2.3.2.11./2 |
6. Катализатор скорость химической реакции:
Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.4./1
|
7. Скорость химической реакции при увеличении концентрации реагирующих веществ:
Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.11./3 |
8. Cкорость химической реакции зависит от
Эталон ответа: а); в).
|
|||||||||||||||||||||||||
|
|
2-й уровень |
|||||||||||||||||||||||||
|
2.3.1.2./2 |
1. В уравнении VСР = С/t выбирают знак минус, если скорость реакции вычисляют…
Эталон ответа: а).
|
|||||||||||||||||||||||||
|
2.3.2.6./1 |
2. Порядок реакции - это сумма показателей степеней
Эталон ответа: в).
|
|||||||||||||||||||||||||
|
2.3.2.4./2 |
3. Константа скорости химической реакции равна скорости химической реакции …
Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.2./1
|
4. Энергия активации на энергетической диаграмме реакции обозначена цифрой
Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.4./3 |
5. Тепловой эффект на энергетической диаграмме реакции обозначен цифрой
Эталон ответа: в).
|
|||||||||||||||||||||||||
|
2.3.2.9./2 |
6. Катализатор изменяет скорость реакции, потому что…
Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.4./4 |
7. Скорость обратной химической реакции CaCO3(Т) CaO(Т) + CO2(Г): Эталон ответа: б).
|
|||||||||||||||||||||||||
|
2.3.2.7./4 |
8. Температурный коэффициент показывает:
Эталон ответа: а).
|
|||||||||||||||||||||||||
|
2.3.2.1./1 |
9. Активные молекулы обладают
Эталон ответа: а).
|
|||||||||||||||||||||||||
|
2.3.2.5./1 |
10.
Константа скорости реакции
Эталон ответа: а); б).
|
|||||||||||||||||||||||||
|
|
3-й уровень |
|||||||||||||||||||||||||
|
2.3.2.11./4 |
1. Константа скорости реакции PCl3(Г) + Cl2(Г) PCl5(Г) изменится при
Эталон ответа: г).
|
|||||||||||||||||||||||||
|
2.3.2.4./5 2.3.2.7./5 2.3.2.8./1 |
2. Соответствие:
Эталон ответа: а - 2); б - 4); в - 1).
|
|||||||||||||||||||||||||
|
2.3.2.8./2 |
3. Предэкспоненциальный множитель в уравнении Аррениуса
Эталон ответа: а).
|
|||||||||||||||||||||||||
|
2.3.2.4./6 |
4. Закон действующих масс строго соблюдается для
Эталон ответа: г).
|
|||||||||||||||||||||||||
|
2.3.2.4./7 |
5.
Выражение для скорости
Эталон ответа: б).
|
|||||||||||||||||||||||||
|
|
4-й уровень |
|||||||||||||||||||||||||
|
2.3.2.4./8 |
1. Скорость прямой реакции CO2(Г) + СТВ 2CO(Г) …….. ,если увеличить давление в 2 раза.
Эталон ответа: в).
|
|||||||||||||||||||||||||
|
2.3.2.4./9 |
2. Скорость обратной реакции CO2(Г) + СТВ 2CO(Г) ….., если увеличить давление в 2 раза.
Эталон ответа: а).
|
|||||||||||||||||||||||||
|
2.3.2.7./6 |
3. Температуру надо ……., для того чтобы скорость реакции CO2(Г) + СТВ 2CO(Г) увеличилась в 32 раза (температурный коэффициент 2).
Эталон ответа: г).
|
|||||||||||||||||||||||||
|
2.3.2.4./10 |
4. Скорость реакции N2 + 3H2 2NH3. ……, если концентрацию азота увеличить в 4 раза и концентрацию водорода - в 2 раза:
Эталон ответа: а).
|
|||||||||||||||||||||||||
|
2.3.2.4./11 |
5. Скорость реакции 4HCl(Г) + O2(Г) 2Cl2(Г) + 2H2O(Г) ….. при увеличении давления в 3 раза:
Эталон ответа: в).
|
Тест по теме 2.4.: Химическое и фазовое равновесие
|
Код |
1-й уровень |
|||||||||||||||||||||
|
2.4.2.1./1
|
1. Смещение положение химического равновесия описывает:
Эталон ответа: б).
|
|||||||||||||||||||||
|
2.4.2.1./2 2.4.2.2./1 2.4.2.4./1
|
2. Положение химического равновесия зависит от
Эталон ответа: а); б).
|
|||||||||||||||||||||
|
2.4.2.1./3
|
3. Обратимая реакция
Эталон ответа: г).
|
|||||||||||||||||||||
|
2.4.1.4./1
|
4. Общий вид выражения для константы равновесия:
Эталон ответа: д ).
|
|||||||||||||||||||||
|
2.4.3.1./1
|
5. Совокупность однородных (по химическим и физическим свойствам) частей системы называется …
Эталон ответа: г).
|
|||||||||||||||||||||
|
2.4.1.1./1 |
6. Химическое равновесие - это такое состояние системы, когда
Эталон ответа: в).
|
|||||||||||||||||||||
|
2.4.1.1./2 |
7. Реакции, в результате протекания которых выпадает осадок, выделяется газ или образуется малодиссоцирующее вещество, называются
Эталон ответа: б).
|
|||||||||||||||||||||
|
|
2-й уровень |
|||||||||||||||||||||
|
2.4.1.1./3 2.4.1.2./1 |
1. На каком из рисунков показано состояние равновесия;
Эталон ответа: г).
|
|||||||||||||||||||||
|
2.4.1.2./2
|
2. Кинетическим условием равновесия системы A + B AB является:
Эталон ответа: а).
|
|||||||||||||||||||||
|
2.4.1.3./1
|
3. Термодинамическим условием равновесия системы A + B AB является:
Эталон ответа: е).
|
|||||||||||||||||||||
|
2.4.2.1./4
|
4. Принцип Ле-Шателье: если на систему, которая находится в состоянии равновесия, оказать внешнее воздействие, то положение равновесия …
Эталон ответа: а).
|
|||||||||||||||||||||
|
2.4.1.4./2
|
5. Положение равновесия смещено в сторону… реакции при KP > 1
Эталон ответа: а).
|
|||||||||||||||||||||
|
2.4.1.4./3
|
6. Положение равновесия смещено в сторону… реакции при KP < 1
Эталон ответа: б).
|
|||||||||||||||||||||
|
|
3-й уровень |
|||||||||||||||||||||
|
2.4.1.4./4
|
1. Константе равновесия системы CH4(Г) + CO2(Г) 2CO(Г) +2H2(Г) соответствует выражение
Эталон ответа: в).
|
|||||||||||||||||||||
|
2.4.1.4./5
|
2. Состояние равновесие в системе 2H2S(Г) 2H2(Г) + S2(Т) описывает уравнение
Эталон ответа: в).
|
|||||||||||||||||||||
|
2.4.1.4./6
|
3. Состояние равновесия системы CH4(Г) + CO2(Г) 2CO(Г) + 2H2(Г) описывается выражением
Эталон ответа: б).
|
|||||||||||||||||||||
|
2.4.1.1./4 |
4. Положение равновесия системы 2NO2(Г) 2NO(Г) + O2(Г) зависит от
Эталон ответа: а); в); г).
|
|||||||||||||||||||||
|
2.4.2.4./2 |
5. Увеличение температуры вызовет смещение равновесия системы N2(Г) + O2(Г) 2NO(Г); H = 180 кДж/моль
Эталон ответа: б); г).
|
|||||||||||||||||||||
|
2.4.1.4./7 |
6.
Константа равновесия имеет вид
Эталон ответа: г).
|
|||||||||||||||||||||
|
2.4.2.1./5 2.4.2.2./2 2.4.2.3./1 2.4.2.4./3 |
7. Влево будут смещать положение равновесия системы N2(Г) + O2(Г) 2NO(Г); H = 180 кДж.
Эталон ответа: в); г).
|
|||||||||||||||||||||
|
2.4.2.3./2
|
8. Давление не будет изменять положение равновесия в системе:
Эталон ответа: а).
|
|||||||||||||||||||||
|
2.4.2.4./4
|
9. Положение равновесия системы MgCO3(Т) MgO(Т) + CO2(Г); H > 0 будет смещаться при повышении температуры
Эталон ответа: б).
|
|||||||||||||||||||||
|
2.4.3.2./1 2.4.3.3./1 |
10. Соответствие между
обозначениями в формуле
Эталон ответа: а - 2); б - 4); в - 6); г - 7.
|
|||||||||||||||||||||
|
2.4.2.1./6 |
11. Соответствие между воздействием на систему H2(Г) + S(Т) H2S(Г); H < 0 и направлением смещения равновесия.
Эталон ответа: 1- б); 2 - а); 3 - в).
|
|||||||||||||||||||||
|
|
4-й уровень |
|||||||||||||||||||||
|
2.4.1.4./8
|
1.
Константа равновесия системы 2NO2
2NO + O2
при равновесных концентрациях
Эталон ответа: в).
|
|||||||||||||||||||||
|
2.4.1.4./9
|
2.
Константа равновесия гомогенной
системы A + B
2С при равновесных концентрациях
Эталон ответа: б).
|
|||||||||||||||||||||
|
2.4.2.3./3 2.4.2.4./5
|
3. Положение равновесия системы N2(Г) + O2(Г) 2NO(Г); H = 180 кДж. сместится в ту же сторону, что и повышение температуры при:
Эталон ответа: д).
|
Тест по теме 2,5.: Растворы. Растворы неэлектролитов
|
Код |
1 й уровень |
|||||||||||||||||||||||||||||||||||
|
2.5.1.2./1 |
1. Массовая доля вещества в растворе вычисляется по формуле:
Эталон ответа: а).
|
|||||||||||||||||||||||||||||||||||
|
2.5.1.2./2 |
2. Молярная концентрация вещества в растворе вычисляется по формуле:
Эталон ответа: в).
|
|||||||||||||||||||||||||||||||||||
|
2.5.1.2./3 |
3. Нормальная концентрация вещества в растворе вычисляется по формуле:
Эталон ответа: в).
|
|||||||||||||||||||||||||||||||||||
|
2.5.1.2./4 |
4. Моляльная концентрация вычисляется по формуле:
Эталон ответа: б).
|
|||||||||||||||||||||||||||||||||||
|
2.5.1.2./5 |
5. Мольная доля вещества вычисляется по формуле:
Эталон ответа: д).
|
|||||||||||||||||||||||||||||||||||
|
2.5.1.1./1 |
6. Растворами называют …
Эталон ответа: в).
|
|||||||||||||||||||||||||||||||||||
|
2.5.1.2./5 |
7. Концентрация - это количественная мера…
Эталон ответа: в).
|
|||||||||||||||||||||||||||||||||||
|
2.5.1.1./2 |
8. Гидратация - это взаимодействие растворенного вещества …
Эталон ответа: б).
|
|||||||||||||||||||||||||||||||||||
|
|
2-й уровень |
|||||||||||||||||||||||||||||||||||
|
2.5.2.2./1 |
1. Осмосом называют процесс…
Эталон ответа: в).
|
|||||||||||||||||||||||||||||||||||
|
2.5.1.2./6 |
2. Соотнесите способ выражения концентрации и формулу:
Эталон ответа: а - 3); б - 4); в - 2); г - 6); д - 1).
|
|||||||||||||||||||||||||||||||||||
|
2.5.2.3./1 |
3. Закон Рауля: при постоянной температуре относительное понижение давления насыщенного пара растворителя над раствором равно … растворенного вещества.
Эталон ответа: г).
|
|||||||||||||||||||||||||||||||||||
|
2.5.2.4./1 |
4. Понижение температуры замерзания раствора прямопроцорционально… растворенного вещества.
Эталон ответа: в).
|
|||||||||||||||||||||||||||||||||||
|
2.5.2.4./2 |
5.
Повышение температуры кипения
вычисляется по формуле
а) масса вещества б) масса растворителя в) молярная масса вещества г) молярная масса растворителя Эталон ответа: в)
|
|||||||||||||||||||||||||||||||||||
|
2.5.2.4./3 |
6. Температура замерзания раствора …
Эталон ответа: в).
|
|||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
3-й уровень |
|||||||||||||||||||||||||||||||||||
|
2.5.2.2./2 |
1. Соответствие
между обозначение и его физическим
смыслом в формуле закона Вант-Гоффа
Эталон ответа: а - 2); б - 4); в - 3); г-7).
|
|||||||||||||||||||||||||||||||||||
|
2.5.2.4./4 |
2. Соответствие
между обозначением и его физическим
смыслом в формуле
Эталон ответа: а - 1); б - 6); в - 4).
|
|||||||||||||||||||||||||||||||||||
|
2.5.2.2./3 |
3. Осмотическое давление зависит от ….
Эталон ответа: б); в).
|
|||||||||||||||||||||||||||||||||||
|
2.5.1.1./3 |
4. Зависимость растворимости газов от парциального давления
Эталон ответа: г).
|
|||||||||||||||||||||||||||||||||||
|
2.5.1.2./7 |
5. Соответствие между способом выражения концентрации вещества в растворе и размерностью:
Эталон ответа: а - 5); б - 6); в - 4); г - 1); д - 2); е - 1).
|
|||||||||||||||||||||||||||||||||||
|
|
4-й уровень |
|||||||||||||||||||||||||||||||||||
|
2.5.1.2./8 |
1. Гидроксида натрия для приготовления 200 г 20%-ного раствора требуется
Эталон ответа: б).
|
|||||||||||||||||||||||||||||||||||
|
2.5.1.2./9 |
2. Гидроксида натрия для приготовления 3 л раствора с массовой долей гидроксида натрия 10% и плотностью 1,109 г/мл необходимо
Эталон ответа: г).
|
|||||||||||||||||||||||||||||||||||
|
2.5.1.2./10 |
3. Азотной кислоты в 100 миллилитрах 0,2 М раствора содержится (Молярная масса кислоты 63 г/моль)
Эталон ответа: а).
|
|||||||||||||||||||||||||||||||||||
|
2.5.1.2./11 |
4. Раствор, содержащий в 300 мл 10,5 г КОН, имеет молярную концентрацию (молярная масса гидроксида калия 56 г/моль)…
Эталон ответа: а).
|







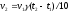
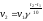



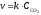



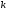 зависит от
зависит от



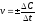
 соответствует реакции
соответствует реакции .
. .
. .
. .
. .
.




 .
. .
. .
.
 .
.
 .
.
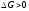 .
. .
. .
. .
. .
. .
. .
. .
. .
. .
. .
. .
.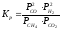 .
. .
. .
. для системы:
для системы: и их физическим смыслом
и их физическим смыслом ,
,
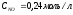 ,
,
 равна
равна ,
,
 ,
,
 равна
равна .
. .
. .
. .
. .
. .
. .
.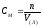 .
. .
. .
. .
. .
.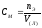 .
. .
. .
. .
. .
. .
. .
. .
. .
. .
. .
. .
. .
.





 ,
где М
,
где М :
:



 :
:





