
ЛБ экология / л.р. №5 Чикина
.doc
Лабораторная работа № 5
ОПРЕДЕЛЕНИЕ КИСЛОТНОСТИ СТОЧНЫХ ВОД С ПОМОЩЬЮ рН-МЕТРА
Цель работы
Изучение методов определения кислотности воды, а также конструкции прибора pH-метра.
Основные теоретические положения
Одним из показателей наличия примесей в природных и сточных водах является водородный показатель pH.
![]() ,
(1)
,
(1)
где
![]() – концентрация ионов водорода, моль/дм3.
– концентрация ионов водорода, моль/дм3.
От величины рН зависит жизнедеятельность и развитие гидробионтов в водоемах, формы миграции различных элементов, агрессивное воздействие воды на металл, бетон. Значение рН характеризует состояние кислотно-основного равновесия воды.
На
величину рН поверхностных вод влияет
соотношение форм карбонатного равновесия
(![]() и
и
![]() ),
интенсивность процесса фотосинтеза и
распада органических соединений,
содержание гуминовых веществ и
гидролизующихся соединений.
),
интенсивность процесса фотосинтеза и
распада органических соединений,
содержание гуминовых веществ и
гидролизующихся соединений.
В большинстве водных объектов pH воды колеблется от 6,3 до 8,5; в атмосферных осадках – от 4,1 до 6,1; в речных и озерных водах зимой pH = 6,8 ÷ 7,4, летом – 4,7 ÷ 8,2.
Величина pH поверхностных вод, подверженных загрязнению сточными водами, изменяется в широких пределах из-за присутствия в их составе щелочей или сильных кислот.
При pH > 7 вода имеет щелочную реакцию, при pH < 7 – кислую.
Значение pH может быть определено приблизительно с помощью специальной индикаторной бумаги, изменяющей свою окраску в кислой или щелочной среде. Более точное определение значения pH осуществляется pH-метром, с помощью которого осуществляется измерение ЭДС электродной системы, включающей стеклянный электрод, потенциал которого зависит от концентрации ионов Н+, и вспомогательным электродом сравнения с известным потенциалом.
На рис. 5.1 показана зависимость потенциала Е, μВ, от pH водной среды.
Рис. 5.1. Зависимость потенциала Е, μВ, от pH водной среды
Описание лабораторной установки
На рис. 5.2 представлена схема подключения электродной системы при измерении pH, а на рис. 5 3 – структурная схема pH-метра.
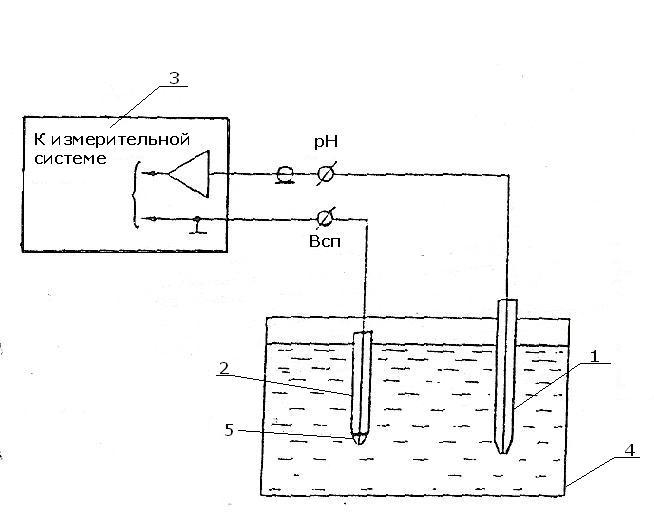
Рис. 5.2. Схема подключения электродной системы при измерении pH:
1 – измерительный стеклянный электрод; 2 – вспомогательный электрод;
3 – преобразователь pH–150; 4 – стакан с раствором; 5 – солевой контакт вспомогательного электрода
В химический стаканчик 4 (рис. 5.2) наливается исследуемая проба воды для измерения значения pH в ней. В этот стаканчик опускаются два стеклянных электрода: измерительный 1 и вспомогательный 2, от которых отходят провода к pH-метру 3. С помощью мешалки перемешивается исследуемый раствор.
Структурная схема pH-метра представлена на (рис. 5.3).

Рис. 5.3. Структурная схема pH-метра:
1 – электродная система; 2 – входной усилитель; 3 – блок измерений;
4 – блок питания; 5 – блок сетевого питания;
6 – аналого-цифровой преобразователь
Электрический потенциал с электродной системы 1 поступает на входной усилитель 2 и усиленный сигнал передается на блок измерения 3, на который через систему блока сетевого питания 5 и блока питания 4 осуществляется подача напряжения на аналого-цифровой преобразователь 6 и блок измерения 3.
Изменение значения pH водной системы приводит к изменению ЭДС.
На рис. 5.4 представлена лицевая панель преобразователя pH–150, на которой показаны экран индикатора 1, ручка регулировки температуры вручную 2, настройка по буферному раствору 3, вилка для подключения электродов 4, кнопки измерения температуры воды 5, окислительно-восстановительного потенциала Eh – 6, измерения pH – 7, питания прибора 8 и подключения термокомпенсатора 9.

Рис. 5.4. Преобразователь pH–150
Порядок выполнения работы
Измерение pH водного раствора осуществляется следующим образом.
-
Анализируемую пробу объемом 30 см3 наливают в химический стаканчик емкостью 50 см3.
-
Электроды 1, 2 (рис. 5.2) и мешалку ополаскивают дистиллированной водой, удаляют остатки воды фильтровальной бумагой. Затем дважды их обмывают исследуемой водой и помещают в центр стакана 4. При этом шарик измерительного стеклянного электрода 1 необходимо полностью погрузить в раствор, солевой контакт вспомогательного электрода 5 должен быть погружен в воду на глубину 5–6 мм.
-
Подать напряжение из сети к преобразователю pH–150, нажав кнопку 8 (рис. 5.4).
-
Якорь мешалки погружают в стаканчик 4 с пробой (рис. 5.2) и включают мешалку.
-
Нажатием кнопки 7 преобразователя pH–150 (рис. 5.4), осуществляют измерение pH раствора.
-
Отсчет величины pH по шкале прибора проводится, когда показания прибора не будут изменяться более чем на 0,2 единицы pH в течение 1 мин. Через минуту измерения повторяются и, если значение pH отличается не более, чем на 0,2, то за результат анализа принимается среднее арифметическое значение.
-
После измерений преобразователь отключается от сети, электроды ополаскиваются дистиллированной водой, протираются фильтровальной бумагой и погружаются в стаканчик с дистиллированной водой.
-
Значение pH определяют как среднеарифметическое результатов двух измерений х1 и х2:
![]() .
.
Контрольные вопросы
1 Что называется водородным показателем?
2 При каких значениях pH находятся щелочные растворы?
3 При каких значениях pH находятся кислые растворы?
4 Какие факторы влияют на величину pH поверхностных вод?
5 В чем сущность потенциометрического измерения pH водной среды?
Литература
1 Савенкова М.А., Шатихина Т.А. Примеси в гидросфере и методы их анализа : учеб. пособие. – Ростов н/Д : РГУПС, 2002. – С. 32–34.

