
- •Основні позначення фізичних величин та формули для їх визначення
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язання
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язання
- •Розв’язання
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Обчислення за рівняннями хімічних реакцій між розчином солі та металом
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язання
- •Розв’язок
- •Розв’язок
- •Виведення молекулярної формули речовини
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Розв’язок
- •Лабораторні заняття Заняття 1
- •Тема 1. Розв’язування хімічних задач як важливий метод і засіб навчання. Методика розв’язування задач за хімічною формулою та на встановлення хімічного елемента чи формули речовини (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Тема 2. Методика розв’язування задач на знаходження молекулярної формули сполуки за масою, об’ємом та кількістю речовин – продуктів згоряння (4 год.).
- •Тема 3. Методика розв’язування задач на приготування розчинів (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Варіант 14
- •Варіант 15
- •Варіант 16
- •Тема 4. Обчислення швидкості хімічної реакції (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Тема 5. Розв’язування задач, за умовою яких реагенти містять домішки. Обчислення практичного виходу продукту реакції (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Варіант 14
- •Варіант 15
- •Варіант 16
- •Варіант 17
- •Варіант 18
- •Варіант 19
- •Варіант 20
- •Варіант 21
- •Варіант 22
- •Варіант 23
- •Варіант 24
- •Варіант 25
- •Варіант 26
- •Варіант 27
- •Варіант 28
- •Варіант 29
- •Варіант 30
- •Варіант 31
- •Варіант 32
- •Варіант 33
- •Варіант 34
- •Варіант 35
- •Варіант 36
- •Варіант 37
- •Варіант 38
- •Варіант 39
- •Варіант 40
- •Тема 6. Розв’язування задач з використанням закону об’ємних відношень (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Тема 7. Розв’язування задач на знаходження маси, об’єму, масової чи об’ємної частки компонентів суміші (4 год.).
- •Варіант 1/7
- •Варіант 2/7
- •Варіант 3/7
- •Варіант 4/7
- •Варіант 5/7
- •Варіант 6/7
- •Варіант 7/7
- •Варіант 8/7
- •Варіант 9/7
- •Варіант 10/7
- •Варіант 11/7
- •Варіант 12/7
- •Варіант 13/7
- •Варіант 14/7
- •Варіант 15/7
- •Варіант 16/7
- •Варіант 17/7
- •Варіант 18/7
- •Варіант 19/7
- •Варіант 20/7
- •Варіант 21/7
- •Варіант 22/7
- •Варіант 23/7
- •Варіант 24/7
- •Тема 8. Обчислення за хімічними рівняннями кількості, маси, об’єму речовини, якщо один із реагентів узятий у надлишку (4 год.).
- •Варіант 1/8
- •Варіант 2/8
- •Варіант 3/8
- •Варіант 4/8
- •Варіант 5/8
- •Варіант 6/8
- •Варіант 7/8
- •Варіант 8/8
- •Варіант 9/8
- •Варіант 10/8
- •Варіант 11/8
- •Варіант 12/8
- •Варіант 13/8
- •Варіант 14/8
- •Варіант 15/8
- •Варіант 16/8
- •Варіант 17/8
- •Варіант 18/8
- •Варіант 19/8
- •Варіант 20/8
- •Варіант 21/8
- •Варіант 22/8
- •Варіант 23/8
- •Варіант 24/8
- •Варіант 25/8
- •Варіант 26/8
- •Варіант 27/8
- •Варіант 28/8
- •Варіант 29/8
- •Варіант 30/8
- •Тема 9. Розв’язування задач за рівнянням реакції заміщення між металом і розчином солі (4 год.).
- •Варіант 1
- •Варіант 2
- •Варіант 3
- •Варіант 4
- •Варіант 5
- •Варіант 6
- •Варіант 7
- •Варіант 8
- •Варіант 9
- •Варіант 10
- •Варіант 11
- •Варіант 12
- •Варіант 13
- •Варіант 14
- •Варіант 15
- •Варіант 16
- •Варіант 17
- •Варіант 18
- •Варіант 19
- •Варіант 20
- •Контрольно-екзаменаційна робота в-1
- •Література
Розв’язок
. I спосіб
Задачі на молярну концентрацію теж можна розв’язувати через „правило хреста”.
2 7-4

 7 4-2
7 4-2
 4
4 
 C1
C3-C2
C1
C3-C2

 C3
C3
C2 C1-C3

ІІ спосіб
V1(р-ну) = x; 1(H2SO4) = 7x; 2(H2SO4) = CV = 20,120 = 0,24 моль

Задача 9. Визначте молярну концентрацію 22,54%-вого розчину фосфатної кислоти (=1,315).
Розв’язок
Приймемо масу розчину за 100 г. Тоді маса фосфатної кислоти в розчині становитиме 22,54 г.
=
![]() ;(Н3РО4)
=
;(Н3РО4)
=![]() = 0,23 моль
= 0,23 моль
V(р-ну)
=
![]() ;V(р-ну)
=
;V(р-ну)
=
![]() мл = 0,076 л
мл = 0,076 л
С =
![]() ;
С =
;
С =![]()
3,03 моль/л
3,03 моль/л
Розчини
Задача 10. У 100 г 20%-ного (за масою) водного розчину натрій гідроксиду обережно ввелиxграм металічного натрію. У результаті реакції утворилосяyг 40%-ного (за масою) розчину натрій гідроксиду.
а). Знайдіть значення x i y.
б). Обчисліть молярну концентрацію 40%-ного розчину натрій гідроксиду, якщо об’єм y грамів цього розчину в 7 разів менший об’єму 1 М розчину сульфатної кислоти, необхідної для його нейтралізації.
Розв’язок
a).
![]()
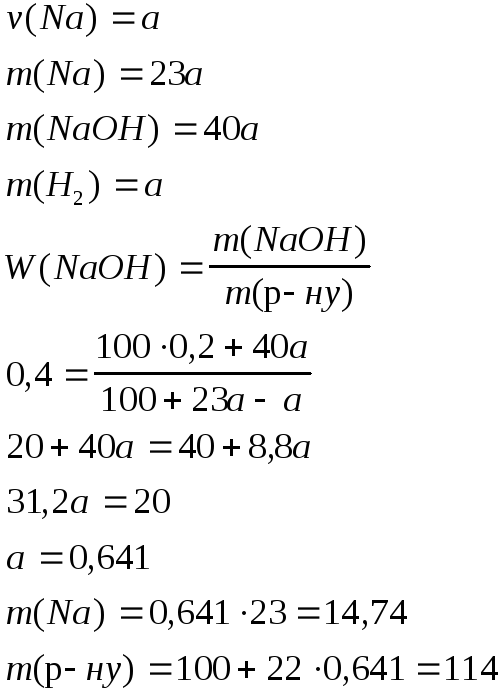
б).
![]()
m(NaOH) = 1000,2+400,641 = 45,64

Задача 11. Визначте об’єм 7 М розчину сульфатної кислоти, який треба добавити до 120 мл 2 М розчину, щоб утворився 4 М розчин.
Розв’язок
. I спосіб

 C1
C3-C2
C1
C3-C2
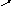
 C3
C3
C2 C1-C3

ІІ спосіб
V1(р-ну) = x; 1(H2SO4) = 7x; 2(H2SO4) = CV = 20,120 = 0,24 моль

Задача 12. Яку масу натрію слід добавити до 100 мл розчину натрій гідроксиду з масовою часткою 8% (густина розчину 1,085 г/мл), щоб одержати розчин з масовою часткою натрій гідроксиду 10%?
Розв’язок
2Na+ 2H2O= 2NaOH+H2
m1(NaOH) = 1001,0850,08 = 8,68 г
(Na) = x = 2(NaOH); (H2) = 0,5x
m(Na) = 23x; m2(NaOH) = 40x; m(H2) = x
W(NaOH)
=
![]() =0,1
=0,1
8,68 + 40x = 10,85 + 2,2x
37,8x = 2,17
x = 0,0574
m(Na) = 0,057423 = 1,32
Лекція № 4. Розрахунки за законом об’ємних відношень газів
Задача 1. До суміші 2 л метану й ацетилену добавлено 2 л водню. Після того, як уся суміш була пропущена над нагрітим платиновим каталізатором, її об’єм зменшився до 3,2 л, а продукти реакції не містили ненасичених вуглеводнів. Визначити об’ємні частки вуглеводнів у вихідній суміші якщо всі об’єми газів виміряні за однакових умов.
Розв’язок
З воднем реагуватиме лише ацетилен.
НССН + 2Н2Н3С–СН3
Нехай об’єм водню, який вступив у реакцію становить хл. Об’єми газів відносяться як кількості їх речовин, тоді об’єм ацетилену в 2 рази менший від об’єму водню і становить 0,5хл. Об’єм етану теж становить 0,5хл.
0,5х+х – 0,5х = 2 л +2 л – 3,2 л
х= 0,8 л
Об’єм ацетилену у вихідній суміші становив 0,4 л. Тоді об’єм метану був рівним:
2 л – 0,4 л = 1,6 л
=
![]()
(СН4) =![]() = 0,8 або 80%
= 0,8 або 80%
(С2Н2) =![]() = 0,2 або 20%
= 0,2 або 20%
Задача 2. Спалили 42 мл суміші кисню і водню. Після реакції залишилося 6 мл кисню, що не прореагував. Визначте об’ємну частку кисню у вихідній суміші, якщо всі об’єми газів виміряні за однакових умов.
