
- •РЕАКЦИИ ЭКЗОЦИКЛИЧЕСКИХ ЗАМЕСТИТЕЛЕЙ ГЕТЕРОЦИКЛИЧЕСКИХ ОСНОВАНИЙ НУКЛЕИНОВЫХ КИСЛОТ
- •РЕАКЦИИ ПРИСОЕДИНЕНИЯ-ЗАМЕЩЕНИЯ С УЧАСТИЕМ ЭКЗОЦИКЛИЧЕСКОЙ АМИНОГРУППЫ
- •Тетраэдрический механизм нуклеофильного замещения
- •Тетраэдрический механизм нуклеофильного замещения
- •РЕАКЦИИ ПРИСОЕДИНЕНИЯ-ЗАМЕЩЕНИЯ С УЧАСТИЕМ ЭКЗОЦИКЛИЧЕСКОЙ АМИНОГРУППЫ
- •Одну из групп коферментов составляют ацилкоферменты, выполняющие функцию переносчиков ацильных групп. Из них
- •Тиоэфиры - серные аналоги сложных эфиров - находят весьма ограниченное применение в классической
- ••По ацилирующей способности все ацилкоферменты А и в том числе ацетилкофермент А, будучи
- •Постсинтетическое ацилирование гетероциклов
- •РЕАКЦИИ N-АЦИЛИРОВАНИЯ
- •РЕАКЦИИ N-АЦИЛИРОВАНИЯ
- •ХИМИЧЕСКАЯ МОДИФИКАЦИЯ ЭКЗОЦИКЛИЧЕСКИХ АМИНОГРУПП
- •Для защиты A, dA, C и dC используется бензоильная защита (Bz), тогда как
- •Ациламинопиримидины и ациламинопурины
- •Амидная группа представляет собой р, -сопряженную систему, в
- •Отщепление протона от имидного азота в сильнощелочной среде приводит к тому, что он
- •При обработке подобных амидов концентрированными водными растворами аммиака протекает аммонолиз. Атака аммиаком возможна
- •Отличительной чертой диэтилпирокарбоната является то, что он в отличие от ацилирующих реагентов реагирует
- •РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ и РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ
- •МЕХАНИЗМ ГАЛОГЕНИРОВАНИЯ
- •Реакции фторирования по С-5. Реагент Бартона.
- •РЕАКЦИИ ПИРИМИДИНОВЫХ ОСНОВАНИЙ С НУКЛЕОФИЛЬНЫМИ ГРУППАМИ БЕЛКОВ
- •Что нужно знать после лекций
РЕАКЦИИ ЭКЗОЦИКЛИЧЕСКИХ ЗАМЕСТИТЕЛЕЙ ГЕТЕРОЦИКЛИЧЕСКИХ ОСНОВАНИЙ НУКЛЕИНОВЫХ КИСЛОТ
•Для понимания вопросов реакционной способности и химической модификации нуклеиновых кислот важное значение имеют реакции, в которых участвуют экзоциклические заместители пуриновых и пиримидиновых оснований, т.е. аминогруппы цитозина, аденина или гуанина, карбонильные группы урацила, гуанина, ксантина, а также реакции атомов серы тиопроизводных (минорных компонентов РНК). Как мы уже обсуждали, n-электроны атомов азота аминогрупп и кислорода карбонильных групп оснований нуклеиновых кислот в значительной степени взаимодействуют с -
электронной системой гетероциклического кольца, вследствие чего свойства соответствующих компонентов нуклеиновых кислот сильно отличаются от свойств простых аминов, амидов и тиоамидов.
1
РЕАКЦИИ ПРИСОЕДИНЕНИЯ-ЗАМЕЩЕНИЯ С УЧАСТИЕМ ЭКЗОЦИКЛИЧЕСКОЙ АМИНОГРУППЫ
•Экзоциклические аминогруппы пуриновых и пиримидиновых оснований при образовании сопряженной системы отдают в нее два электрона неподеленной пары и приобретают вследствие этого некоторый положительный заряд. Однако учет -электронной плотности показывает,
что суммарный заряд на атомах азота экзоциклических аминогрупп оснований будет все же отрицательным, и, таким образом, становится возможной атака электрофильных реагентов по этим центрам. К числу подобных реакций относится взаимодействие нуклеозидов и нуклеотидов с активированными производными карбоновых кислот.
2
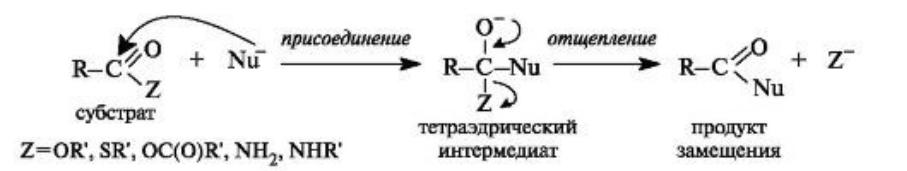
Тетраэдрический механизм нуклеофильного замещения
3
Тетраэдрический механизм нуклеофильного замещения
•Сначала нуклеофил присоединяется к атому углерода группы С=О с образованием нестабильного промежуточного аниона (интермедиата). Механизм реакции называют тетраэдрическим, так как атом углерода при этом переходит из sp2- в sр3- гибридное состояние и принимает тетраэдрическую конфигурацию.
•На второй стадии от интермедиата отщепляется частица Z и атом углерода вновь становится sp2- гибридизованным. Таким образом, эта реакция замещения включает
стадии присоединения и отщепления.
4
РЕАКЦИИ ПРИСОЕДИНЕНИЯ-ЗАМЕЩЕНИЯ С УЧАСТИЕМ ЭКЗОЦИКЛИЧЕСКОЙ АМИНОГРУППЫ
•По своему химическому поведению аминогруппа в компонентах нуклеиновых кислот наиболее близка, по- видимому, к аминогруппе ароматических аминов, содержащих сильные электроноакцепторные заместители, например, к аминогруппе n-нитроанилина. Дополнительное осложнение состоит здесь, однако, в том, что даже простейшие производные данного ряда (нуклеозиды) содержат также и другие функциональные группы, способные вступать в реакцию с электрофильными реагентами. Это атомы азота пиридиниевого типа в гетероциклическом ядре, гидроксильные группы остатка сахара. При переходе от нуклеозида к нуклеотиду проведение реакции осложняется еще больше: за счет появления в молекуле функциональной группы с сильными нуклеофильными свойствами – остатка фосфорной кислоты
– создается возможность новых побочных реакций. Поэтому подбор оптимальных условий проведения реакции по экзоциклическим заместителям ядер на олиго- и полинуклеотидах является обычно достаточно трудной
задачей. |
5 |
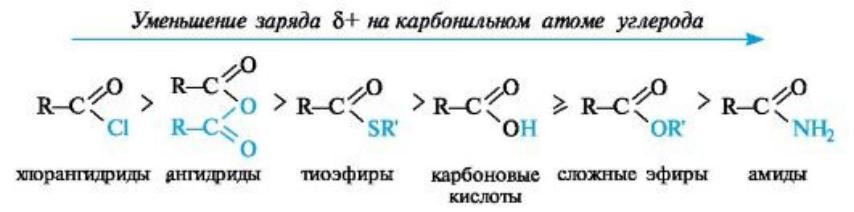
Легкость нуклеофильной атаки зависит от величины частичного положительного заряда δ+ на атоме углерода карбонильной группы. В функциональных производных карбоновых кислот он увеличивается с ростом -I-эффекта заместителя Z и уменьшается с увеличением его M-эффекта.
Функциональные производные кислот обладают разной реакционной |
|
способностью в реакциях ацилирования. Наиболее активны |
|
хлорангидриды и ангидриды; из них можно получать практически |
|
любые производные кислот. Сами кислоты и сложные эфиры (с |
|
остатками алифатических спиртов) - значительно менее активные |
|
ацилирующие агенты. Реакции замещения с их участием проводятся в |
|
присутствии катализаторов. Амиды вступают в реакции ацилирования |
|
еще труднее, чем кислоты и сложные эфиры. |
6 |
Одну из групп коферментов составляют ацилкоферменты, выполняющие функцию переносчиков ацильных групп. Из них наиболее распространен ацетилкофермент А.
•В качестве тиола, участвующего в его образовании, выступает кофермент
А (сокращенно обозначаемый CoASH), молекула которого построена из остатков трех компонентов - 2-аминоэтантиола, пантотеновой кислоты и аденозиндифосфата (дополнительно фосфорилированного по положению 3’ в рибозном фрагменте). Пантотеновая кислота образует, с одной стороны, амидную связь с 2- аминоэтантиолом, а с другой - сложноэфирную связь с остатком ADP.
•
7
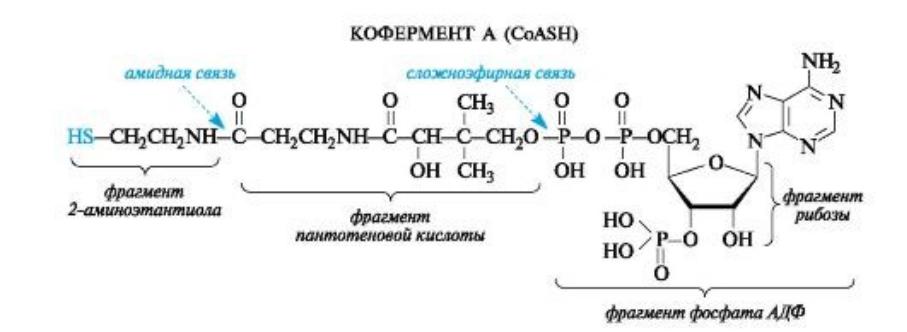
Тиоэфиры - серные аналоги сложных эфиров - находят весьма ограниченное применение в классической органической химии, но играют важную роль в организме.
При всей сложности строения молекулы ацетилкофермента А с позиций химического подхода можно определить, что этот кофермент функционирует как тиоэфир.
8
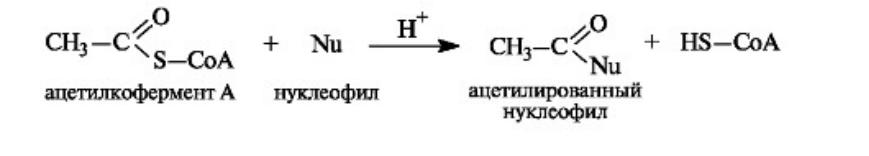
•По ацилирующей способности все ацилкоферменты А и в том числе ацетилкофермент А, будучи тиоэфирами, занимают «золотую середину» между высокореакционными ангидридами и малоактивными карбоновыми кислотами и сложными эфирами. Их достаточно высокая активность обусловлена, в частности, повышенной стабильностью уходящей группы - аниона CoA-S- - по сравнению с гидроксид- и алкоксид-ионами кислот и сложных эфиров соответственно.
9
Постсинтетическое ацилирование гетероциклов
|
O |
|
O |
|
|
|
|
|
HN C CH3 |
|
HN C CH3 |
|
N |
N |
N |
|
|
||
O |
N |
N |
N |
|
Ribose
Ribose
N4-Ацетилцитидин (oc4C)
10
