
- •ХИМИЧЕСКАЯ И ПОСТТРАНСЛЯЦИОННАЯ
- •Модификаций много, а память и время ограничены. Продолжаем обсуждать
- •Неферментативное гликозилирование (гликирование) белков
- •НЕФЕРМЕНТАТИВНОЕ ГЛИКОЗИЛИРОВАНИЕ БЕЛКОВ
- •Коллаген – основной белковый элемент межклеточного матрикса (семейство близкородственных фибриллярных белков). Функции межклеточного
- •Коллаген – основной белок соединительной ткани
- •ГИСТОНОВЫЙ КОД
- •РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ (по конечному результату)
- •АЛКИЛИРОВАНИЕ ФУНКЦИОНАЛЬНЫХ ГРУПП БЕЛКОВ
- ••Было показано, что в гистоне Н3 триметилированный Lys4 необходим для активации процесса транскрипции,
- •АЛКИЛИРУЮЩИЕ РЕАГЕНТЫ
- •АЛКИЛИРОВАНИЕ БЕЛКОВ (реакция по боковому радикалу остатка лизина)
- •Вспомним схему синтеза S-аденозилметионина. С вашей точки зрения по какому механизму протекает реакция
- •Вспомним, что может произойти, если будет повышаться уровень гомоцистеина. Это наблюдается при развитии,
- •N-Homocysteinylation of proteins
- •ДЕМЕТИЛИРОВАНИЕ ОСТАТКА МОДИФИЦИРОВАННОГО ЛИЗИНА
- •ДЕМЕТИЛИРОВАНИЕ ДИ- И МОНОМЕТИЛИРОВАННЫХ ОСТАТКОВ ЛИЗИНА В ГИСТОНАХ, КАТАЛИЗИРУЕМОЕ
- •ДЕМЕТИЛИРОВАНИЕ ТРИ-, ДИ- И МОНОМЕТИЛИРОВАННЫХ ОСТАТКОВ ЛИЗИНА В ГИСТОНАХ, КАТАЛИЗИРУЕМОЕ ГИСТОНДЕМИТИЛАЗОЙ, ФУНКЦИОНИРУЮЩЕЙ В
- ••Таким образом, метилирование-диметилирование наряду с ацетилированием-деацетилированием определенных аминокислотных остатков в гистонах является одним
- •N-метилирование по остаткам Lys и Arg в гистонах; введение фрагментов, содержащих изопренильные группы
- ••Изопренилированию подвергаются белки семейств Ras, Rab, Rho (продукты протоонкогенов ras, rab, rho, участвующие
- •Белок, обладая большим сродством к липидным мембранам, служит уникальным местом опознавания для определенных
- •Наблюдается дальнейший процессинг: протеолитическое удаление Суs-А-А-Х-протеазой трипептида А-А-Х с С-конца и карбоксиметилирование остатка
- •Молекулярные механизмы формирования и движения пузырьков
- •Rab-белки участвуют в транспорте пузырьков в клетке
- ••Для каждой внутриклеточной мембраны существуют специфические Rab-белки, которые обеспечивают определенное направление пузырьков. От
- •• CAAX мотив запускает три последовательных ферментативных
- •ВЗАИМОДЕЙСТВИЕ С АЛКИЛИРУЮЩИМИ РЕАГЕНТАМИ
- •ХИМИОТЕРАПИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
- •Примеры наиболее распространенных повреждений ДНК
- •ADP-рибозилирование белков
- •Процесс синтеза поли(ADP-рибозы) предшествует началу репарации повреждений ДНК. Большие затраты энергии на биосинтез
- •ПОЛИ(ADP)-РИБОЗИЛИРОВАНИЕ
- •Поли(ADP-рибозил)ирование PARP1
- •ADP-рибозилирование аспарагина
- •УКАЖИТЕ ТИП МОДИФИКАЦИЙ
- •ГЛИКОЗИЛИРОВАНИЕ БЕЛКОВ
- •ГЛИКОЗИЛИРОВАНИЕ БЕЛКОВ
- •ГЛИКОЗИЛИРОВАНИЕ ОСТАТКОВ Ser и Thr
- •ГЛИКОЗИЛИРОВАНИЕ ОСТАТКОВ Ser и Thr
- •карбоний-ион изображается как резонансный гибрид двух состояний, в одном из которых (оксоний-ион)
- •N-гликозилирование белков происходит по карбоксамидному атому азота остатка аспарагина в последовательности Asn-X-Ser/Thr. Образование
- •ГЛИКОЗИЛИРОВАНИЕ БЕЛКОВ
- •МОДИФИКАЦИЯ АСПАРАГИНА
- •N-Гликозилирование белка осуществляется в процессе посттрансляционной модификации в эндоплазматическом ретикулуме с помощью трансгликозидаз,
- •Гликозидазы «подстригают» олигосахариды, отщепляя
- •ПРОЦЕССЫ ГЛИКОЗИЛИРОВАНИЯ БЕЛКОВ В КОМПЛЕКСЕ ГОЛЬДЖИ
- •ПРОЦЕССЫ ГЛИКОЗИЛИРОВАНИЯ БЕЛКОВ В КОМПЛЕКСЕ ГОЛЬДЖИ
- •ГЛИКОЗИЛИРОВАНИЕ АСПАРАГИНА БЕЛКОВ
- •Для О-гликозидов этих аминокислот имеется тенденция к -
- ••N-гликозиламидная связь относительно устойчива в мягких щелочных и кислотных условиях, но расщепляется при
- •РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ
- ••Тироглобулин – гликопротеин с молекулярной массой 660 кДа, содержит 115 остатков тирозина, синтезируется
- ••В крови йодтиронины находятся в связанной форме в комплексе с тироксинсвязывающим белком. Только
- •Тиреоглобулин с Т4
- •Окислительно-восстановительные реакции
- •ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.
- •ГИДРОКСИЛИРОВАНИЕ ЛИЗИНА, ПРОЛИНА, АСПАРАГИНА
- •Известно два класса монооксигеназ. Ферменты, требующие присутствия косубстрата, называются внешними моноокисгеназами. Другую группу
- •Гидроксилирование остатков пролина и лизина в молекуле проколлагена катализируется в присутствии аскарбиновой кислоты
- •Механизм реакции гидроксилирования
- •МУЛЬТИМОДИФИКАЦИЯ. Синтез коллагена
- •Гликозилирование аминокислотных остатков гидроксилизина под действием гликозилтрансфераз
- •Как отмечалось выше, в фибробластах проходит посттрансляционная модификация определенных остатков пролина и лизина.
- •Превращения незрелых фибрилл в зрелые путем формирования сшивок между полипептидными цепями
- ••Возникшие альдегидные группы участвуют в образовании ковалентных связей, которые стабилизируют фибриллы коллагена.
- •Коллаген – основной белковый элемент межклеточного матрикса (семейство близкородственных фибриллярных белков). Функции межклеточного
- •Уникальные свойства коллагенов
- •Окислительно-восстановительные реакции. Детекция аминокислот
- •Детекция пролина
- •Взаимодействие нингидрина с другими аминами
- •Окислительно-восстановительные реакции
- •Химические модификации
- •Химические модификации
- •Протромбин – белок, состоящий из 582 аминокислотных остатков; его протеолитическое расщепление по связям
- •КАРБОКСИЛИРОВАНИЕ ОСТАТКА ГЛУТАМАТА
- •Механизм участия витамина К в карбоксилировании остатков глутамата
- •КАРБОКСИЛИРОВАНИЕ ОСТАТКА ГЛУТАМАТА
- •Что необходимо знать после лекции

Для О-гликозидов этих аминокислот имеется тенденция к -
конфигурации (a). В коллагене, углеводный остаток присоединен к гидроксилизину (б).
|
OH |
|
à) |
HO |
O |
|
|
|
|
|
|
HO |
|
|
NH |
|
MeCONH |
O |
|
|
CH2CH |
||
|
|
|
|
|
|
|
CO |
|
OH |
NHCHCO |
á) |
|
(CH2)3 |
||
HO |
O |
|
|
|
O CH |
|
|
HO |
|
|
OCH2NH2
OH
O
HO
OH
 OH
OH
В щелочных условиях О-гликозиды серина и треонина легко претерпевают -элиминацию
•N-гликозиламидная связь относительно устойчива в мягких щелочных и кислотных условиях, но расщепляется при более жестком гидролизе (2 н. HCl, 100 0С, 10–12 мин или 0,2–2 н. NaOH, 100 0С, 16 ч). В связи с этим следует иметь ввиду, что значительное количество углеводов будет разрушаться в жестких условиях гидролиза, используемых при аминокислотном анализе. Если для белка присуще аномальное поведение при гель-фильтрации, ультрацентрифугировании, измерении ультрафиолетового поглощения, то его можно “заподозрить” в принадлежности к гликопротеинам и последующее определение стратегии секвенирования проводить с учетом данного типа модификации.
РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ
•Посттрансляционная модификация, включающая стадию йодирования приводит к образованию тироидных гормонов щитовидной железы: тироксину и 3,3’,5-трииодтиронину. Биосинтез их протекает по механизму окислительного сочетания фенолов из двух определенным образом расположенных остатков иод-L-
тирозина в белковой молекуле тироглобулина. Ниже представлена схема синтеза йодтиронинов.

Т и р о г л о б у л и н |
|
|
|
|
Т и р о г л о б у л и н с Д И Т |
|
|
|
|
|
|
|
Т и р о г л о б у л и н с Т 4 |
|
|
|||||
с о с т а т к а м и т и р о з и н а |
I |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
O |
H |
|
|
I + |
|
O |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
2 O 2 , |
|
I |
|
|
|
|
|
|
|
|
|
I |
I |
|
||
т и р о п е р о к с и д а з а |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
I |
|
|
|
|
|
|
|
|
|
O |
O |
H |
||||||||
|
|
Й о д и р о в а н и е |
К о н д е н с а ц и я |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
I |
I |
|
|||||||||||
|
|
O |
H |
|
|
|
|
O |
H |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
Э |
к |
з о |
ц |
и т |
о з |
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Т и р о г л о б у л и н |
|
Л и з о |
с о м |
ы |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
Б |
и |
о |
с и |
н т |
е з |
|
В |
т |
о |
р |
и |
ч |
н |
а |
я |
|
|
|
|
|
|
л |
и з о |
с |
о |
м |
а |
|
|
|
|
|
|||||||
|
|
б |
е |
л |
к а |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Э |
Р |
|
|
|
Ф о л л и к у л я р н о е |
T 3 |
|
|
||||||||
|
|
|
|
|
|
|
п р о с т р а н с т в о |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
I |
К |
р о |
в |
ь |
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
||
•Тироглобулин – гликопротеин с молекулярной массой 660 кДа, содержит 115 остатков тирозина, синтезируется в базальной части клетки и хранится во внеклеточном коллоиде в тироидных фолликуллах. Под действием тиропероксидазы окисленный йод реагирует с остатками тирозина с образованием монойодтиронинов (МИТ) и дийодтиронинов (ДИТ). Две молекулы ДИТ конденсируются с образованием тироксина (Т4), а МИТ и ДИТ с образованием трийодтиронина (Т3). Йодтиреоглобулин транспортируется в клетку путем эндоцитоза и гидролизуется ферментами лизосом с освобождением тироксина и 3,3’,5-трииодтиронина.
•В крови йодтиронины находятся в связанной форме в комплексе с тироксинсвязывающим белком. Только 0,03 % Т4 и 0,3 % Т3 находятся в свободном состоянии. Биологическая активность йодтиронинов обусловлена несвязанной фракцией. Транспортные белки служат своеобразным депо, которое может обеспечить дополнительное количество свободных гормонов. Йодтиронины регулируют рост и дифференцировку тканей и энергетический обмен. Их синтез и секреция регулируется гипоталамо-гипофизарной системой. Повышение скорости синтеза йодтиронинов приводит к развитию базедовой болезни, основными симптомами которой является мышечная слабость, потеря массы тела, повышенный аппетит, повышение температуры тела. Гипофункция щитовидной железы в раннем детстве приводит к задержке физического и умственного развития – кретинизму. У взрослых снижение уровня синтеза йодтиронинов проявляется в сонливости, снижении толерантности к холоду, увеличению массы и снижению температуры тела.

Тиреоглобулин с Т4
NH |
|
I |
I |
|
|
|
|
HC |
H2 |
O |
OH |
C |
|||
C |
O |
I |
I |
|
|
Тиреоглобулин с ДИТ
OH OH
I  I I
I I  I
I
I2, H2O2
лактопероксидаза
CH2 |
O |
|
CH2 |
O |
H |
C |
H |
C |
C |
N C |
N |
|||
H |
|
|
H |
|
|
|
O |
|
|
|
O |
P |
O |
|
|
|
O |
|
|
ATP
протеинкиназа
H2C O
N C C
H H
|
|
OH |
|
|
OH |
|
|
|
|
I |
I |
|
I |
|
|
|
|
I |
|
|
|
|
|
|
pH 8 - 9 |
|
|
I |
|
CH2 |
O |
|
CH2 |
O |
pH 8 - 9 |
N |
C |
C |
N |
C |
C |
|
H |
H |
|
H |
H |
|
OH |
O |
|
|
|
|
|
|
|
OH |
|
O |
|
N Br |
Br |
Br |
Br |
Br |
|
|
O
|
H2C |
O |
pH 8 - 9 |
|
|
N |
C |
C |
|
H2C |
O |
H |
H |
|
N |
C |
C |
|
|
|
|||
|
|
|
H |
H |
|
|
C(NO2)4 |
|
|
O |
|
C CH3
|
OH |
O |
|
O |
|
|
|
N |
CH3 |
|
|
|
|
N C |
|
|
|
|
|
NO2 |
|
|
|
|
H2C |
O |
|
H C |
O |
|
|
|
|
2 |
|
N |
C |
C |
N |
C |
C |
H |
H |
|
H |
H |
|
|
H2C |
O |
N |
C |
C |
H |
H |
O |
|
|
Окислительно-восстановительные реакции
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.
РЕАКЦИИ ГИДРОКСИЛИРОВАНИЯ
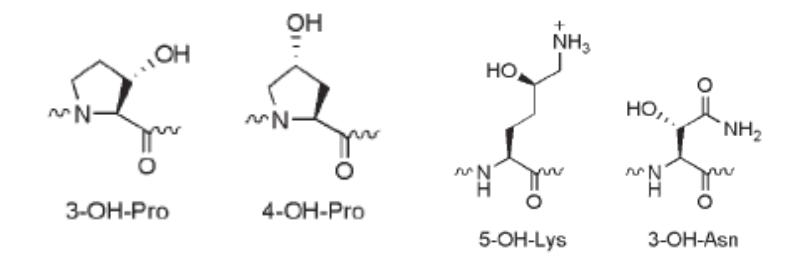
ГИДРОКСИЛИРОВАНИЕ ЛИЗИНА, ПРОЛИНА, АСПАРАГИНА
•Перенос гидроксильного радикала ОН от Fe3+ ОН к С Н
приводит к гидроксилированию боковой цепи аминокислотного остатка, которая не является электрондонорной и не выступает в качестве нуклеофила. Монооксигеназы, катализирующие реакцию гидроксилирования, присоединяют гидроксильный радикал стереоспецифически.
•Окисленные остатки пролина и лизина играют важную роль в образовании водородных связей в трехнитевой пространственной структуре белка соединительной ткани коллагена. Окисление происходит в последовательностях Pro- Gly и Lys-Gly. 4-гидроксипролин встречается на порядок чаще, чем 3-гидроксипролин.
•Помимо этого гидроксилирование определенных аминокислотных остатков играет роль в функционировании индуцированного гипоксией транскрипционного фактора HIF (hypoxia inducible factor). Этот белок активируется в условиях
недостатка кислорода. Он индуцирует транскрипцию большого количества генов, в том числе гена, кодирующего белок эритропоэтин, стимулирующий образование эритроцитов из клеток-предшественников, усиливая перенос кислорода к клеткам, страдающим от гипоксии.
