
- •Методы определения первичной структуры ДНК (секвенирование):
- •Предпосылки возникновения методов секвенирования
- •Основные принципы секвенирования по Максаму и Гилберту
- •Основные принципы секвенирования по Максаму и Гилберту
- •Основные принципы секвенирования по Максаму и Гилберту
- •Основные принципы секвенирования по Максаму и Гилберту
- •Основные принципы секвенирования по Максаму и Гилберту
- •Основные принципы секвенирования по Максаму и Гилберту
- •Рисунок электрофореграммы,
- •Основные принципы секвенирования по Сэнгеру
- •Секвенирование ДНК по Сэнгеру: "плюс-минус" метод
- •Секвенирование ДНК по Сэнгеру: "плюс-минус" метод
- •Секвенирование ДНК по Сэнгеру: "плюс-минус" метод
- •Секвенирование ДНК по Сэнгеру: "плюс-минус" метод
- •Секвенирование ДНК по Сэнгеру: метод "терминаторов"
- •Автоматическое секвенирование ДНК по м.м. Сэнгера
- •Сравнение методов секвенирования по Сэнжеру и Максаму-Гилберту
- •Из истории разработки техники быстрого секвенирования
- •Из истории разработки техники быстрого секвенирования
- •Сравнение методов секвенирования по Сэнгеру и по Ротбергу
- •Принцип метода пиросеквенирования
- •Принцип метода секвенирования по Ротбергу
- •ДЕТЕКЦИЯ ПИРОФОСФАТА
- •Принцип метода пиросеквенирования
- •Недостатки метода
- •Полони-секвенирование
- •(А) Амплификация полоний. Библиотека линейной ДНК с универсальными сайтами для посадки праймеров амплифицируется
- •Секвенирование с помощью нанопор
- •Секвенирование с помощью нанопор
- •Модель ДНК, находящейся в наносеквенаторе (А) и проходящей через нанопору (Б)
- •Секвенирование с помощью нанопор
- •Секвенирование с помощью нанопор

Основные принципы секвенирования по Сэнгеру
К концу 60-х годов Ф.Сэнгером были разработан метод секвенирования РНК, получаемой с ДНК-матрицы при помощи РНК-полимеразы. Применив этот способ, Ш.Вейссман и У.Фирс смогли к концу 1976 г. определить последовательность более половины молекулы ДНК SV40, длина которой превышает 5200 нуклеотидных пар. Следующим шагом должна была стать разработка методов прямого секвенирования ДНК.
Ферментативный синтез олиго- и поли-дезоксирибонуклеотидов с помощью ДНК-полимераз, заключающийся в копировании матричного полинуклеотида нашел блестящее применение в качестве эффективных методов установления первичной структуры ДНК. Метод состоит в получении блоков-копий полидезоксирибонуклеотида, структура которого изучается. При этом обязательным является выполнение двух условий.
1) - копирование должно проводиться, начиная с определенного мономерного звена; 2) - синтез копий следует осуществлять четыре раза, каждый раз
останавливая его поочередно на каком-либо одном из четырех мономерных звеньев (A, G, С или Т), т.е. стремятся получить полный набор "комплементационно отраженных" копий исследуемого полинуклеотида, образование которых прекратилось в каждом из мест расположения одного из четырех мономерных звеньев нуклеиновой кислоты. Определение длины каждой копии позволяет установить положение данного мономерного звена в цепи исследуемого полинуклеотида. Длина копии определяется фракционированием в полиакриламидном геле. Этот метод, таким образом, так же как и метод, основанный на модификации оснований позволяет получать информацию о положении определенного мономерного13
звена в цепи полинуклеотида прямо после фракционирования.

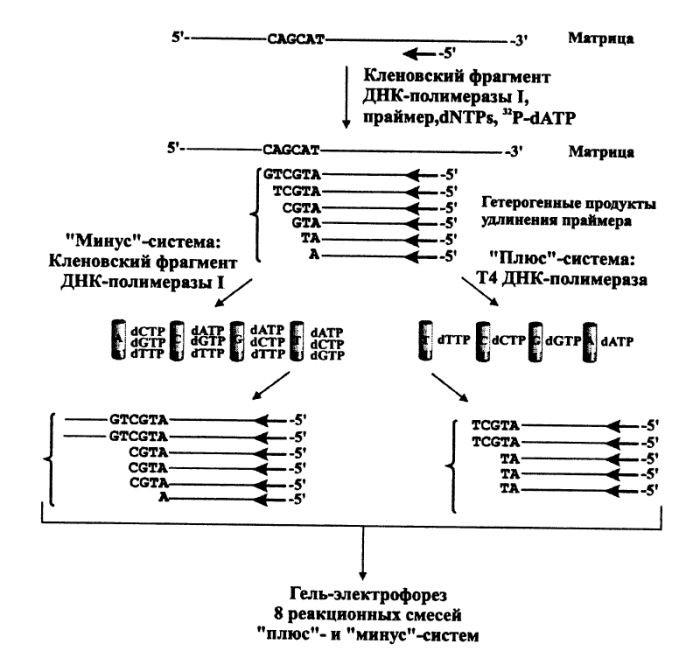
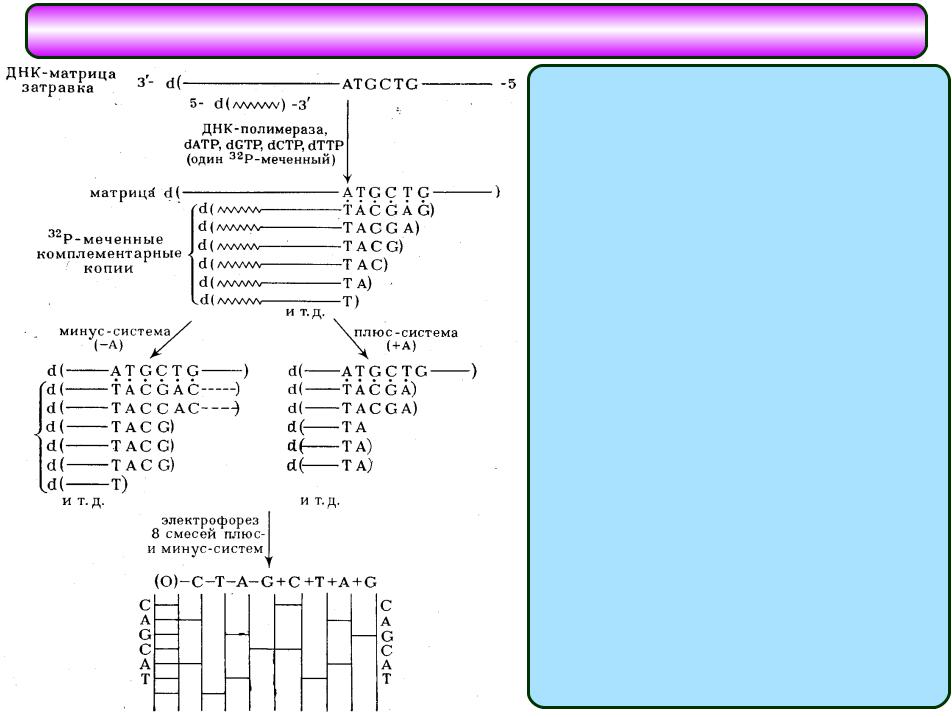
Секвенирование ДНК по Сэнгеру: "плюс-минус" метод
Для получения копии исследуемого полинуклеотида в последнем выбирают точку отсчета, что достигается введением в систему ферментативного синтеза в качестве нуклеозидного компонента олигонуклеотида-затравки. Такой олигонуклеотид во всех копиях, образующихся в результате достраивания его ферментативным путем, остается постоянным 5'-концевым фрагментом, т. е. является точкой отсчета. Копирование с помощью ДНК- полимеразы в присутствии всех четырех дезоксирибонуклеозид-5'- пирофосфатов (один из них берется 32Р-меченным) проводят в течение ограниченного времени. Цель этого этапа - проведение статистически ограниченного синтеза для получения всех возможных копий, начиная с затравки, достроенной на одно, два и т. д. звеньев, и включая полную копию изучаемого полинуклеотида. В идеале смесь должна включать все возможные полинуклеотиды, синтез которых статистически прекращается где-то в середине матричного полинуклеотида в районе ATGCTG матричной последовательности. На практике различные компоненты смеси присутствуют в разных количествах. Если такую смесь далее подвергнуть электрофорезу в полиакриламидном геле в определенных условиях, когда скорость движения пропорциональна длине цепи, на электрофореграмме обнаруживается серия полос, представляющих различные олигонуклеотиды. Такое фракционирование обычно не проводят, хотя оно может использоваться для контроля14 на
завершающем этапе анализа.

Секвенирование ДНК по Сэнгеру: "плюс-минус" метод
Инкубационную смесь 32Р-меченных олигонуклеотидов различной длины в виде комплексов с матричным полинуклеотидом подвергают гель-фильтрации для удаления дезоксирибонуклеозид-5'- трифосфатов и аликвоты реакционной смеси реинкубируют с ДНК- полимеразой в различных условиях. В случае "минус-системы" реинкубацию проводят в присутствии только трех дезоксирибонуклеозид-5'-трифосфатов. Например, в «- А-системе» отсутствует dATP и каждая копия в смеси достраивается с помощью ДНК-полимеразы до места, в котором следующим мономерным звеном должен быть остаток pdA (т.е. Т в матричном полинуклеотиде). Образующуюся смесь фракционируют с помощью электрофореза и обнаруживают (ауторадиографически) ограниченное количество полос (их количество равно количеству Т в матричном полинуклеотиде). Аналогично проводят копирование в отсутствие других субстратов: - dGTP, - dCTP или - dTTP (- G-,- С- и - Т-системы соответственно). Все четыре ионофореза проводят в полиакриламидном геле параллельно. Полученные ауторадиограммы позволяют сразу написать нуклеотидную последовательность, причем чтение цепи снизу вверх соответствует 5' 3'-полярности
цепи копии. Например, положение самого короткого олигонуклеотида (в " - Т-системе") указывает на то, что следующий за ним по длине олигонуклеотид заканчивается на Т, т.е. что против полосы, расположенной выше (это полоса в - А-системе),15
следует записать букву Т.

Секвенирование ДНК по Сэнгеру: "плюс-минус" метод
Таким же образом записывают далее в последовательности А (на |
|
основании положения следующего по длине олигонуклеотида, который |
|
оказался в "- А-системе") и т. д. Соответствующий участок цепи в |
|
матрице читается с учетом принципа комплементарности и |
|
антипараллельности цепей в комплексе матрица - затравка. Для проверки |
|
этих данных используют результаты анализа с помощью "плюс-системы". |
|
В этом случае дополнительное копирование (после первого этапа) проводят |
|
в присутствии ДНК-полимеразы, выделенной из бактериофага Т4, которая |
|
в отсутствие субстратов (нуклеозид-5'-трифосфатов) проявляет 3'- |
|
экзонуклеазную активность, т. е. отщепляет мононуклеотиды один за |
|
другим с 3'-конца. В то же время в присутствии субстратов ее |
|
полимеразная активность во много раз превосходит экзонуклеазную. Так, |
|
если в реакционной смеси присутствует хотя бы один |
|
дезоксирибонуклеозид-5'-трифосфат (dATP в " +А-системе"), деградация |
|
каждой копии, образовавшейся на первой стадии анализа, будет проходить |
|
вплоть до места положения А (Т в матрице). В этом случае pdA |
|
включается много быстрее, чем удаляется, и, таким образом, |
|
накапливаются фрагменты, содержащие на 3'-конце цепи А. Аналогично |
|
проводят копирование в присутствии только dGTP, dCTP или dTTP. Смеси |
|
параллельно подвергают электрофорезу, как и в предыдущем случае, и |
|
получают ауторадиограммы, из которых сразу считывается |
|
последовательность 5' 3'-направление (считывается также снизу вверх). |
|
Из сравнения фореграмм "плюс-" и "минус-систем" делается однозначный |
|
вывод о нуклеотидной последовательности в копиях и, следовательно, в |
|
матричном полинуклеотиде. |
16 |
17
Секвенирование ДНК по Сэнгеру: "плюс-минус" метод
Использование |
ферментативного |
||
синтеза олиго- |
и поли- дезоксирибо- |
||
нуклеотидов |
для |
определения |
|
первичной структуры ДНК |
18 |
||
|
|||

Секвенирование ДНК по Сэнгеру: метод "терминаторов"
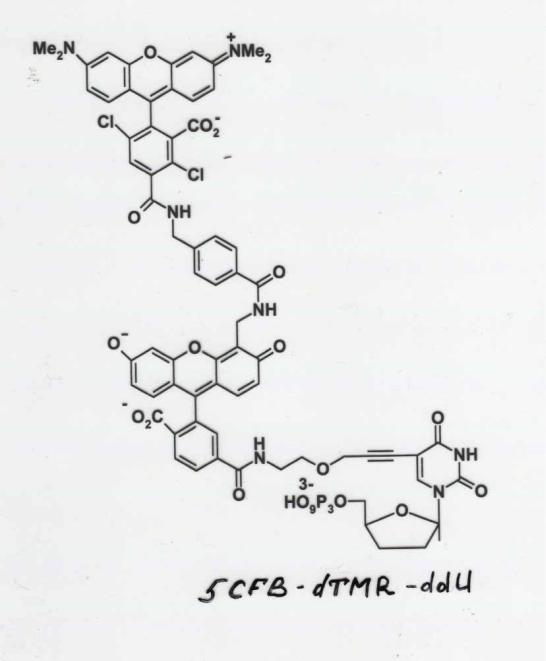
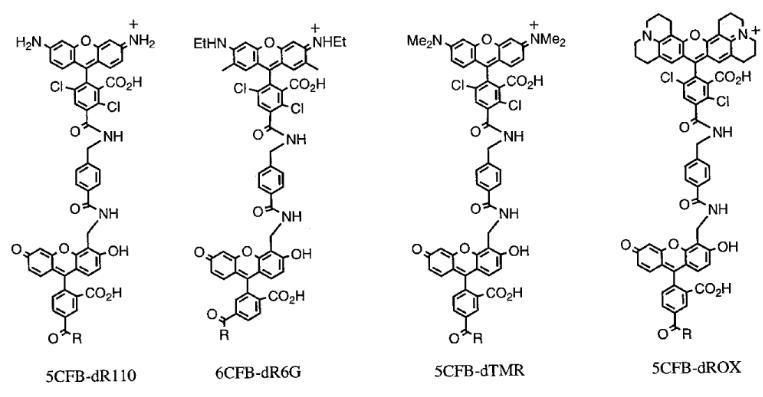
В 1977 г. автор "плюс-минус" метода предложил еще один способ ферментативного секвенирования, получивший название метода терминирующих аналогов трифосфатов. Более мощный и более технологичный, этот способ, несколько модифицированный, применяется до сих пор. В основе метода так же лежало ферментативное копирование с помощью фрагмента Кленова ДНК полимеразы I из E.coli. В качестве праймеров использовали синтетические олигонуклеотиды. Специфическую терминацию синтеза обеспечивали добавлением в реакционную смесь помимо четырех типов dNTP (один из которых был радиоактивно мечен по альфа положению фосфата) еще и одного из 2',3'-дидезокси- нуклеозидтрифосфатов (ddATP, ddTTP, ddCTP или ddGTP), который способен включаться в растущую цепь ДНК, но не способен обеспечивать дальнейшее копирование из-за отсутствия 3'-ОН группы. Отношение концентраций dNTP/ddNTP авторы подбирали экспериментально, так, чтобы в итоге получить набор копий ДНК различной длины. Таким образом, для определения первичной структуры исследуемого фрагмента ДНК требовалось провести четыре реакции копирования: по одному типу терминаторов в каждой из реакций. После этого полученные продукты разгонялись в полиакриламидном геле на соседних дорожках и по расположению полос определялась последовательность нуклеотидов.
Применимость метода Сэнгера зависила от возможности получения одноцепочечных копий анализируемых ДНК. Для этой цели можно было использовать векторы: плазмидные векторы, векторы на основе бактериофага М13. В настоящее время выделение фрагментов ДНК, создание рекомбинантных генов, а так же прямое секвенирование ДНК19 и
кДНК становятся общедоступными методами благодаря внедрению ПЦР.
20
21

22
