
- ••РЕАКЦИИ ПО ГЕТЕРОЦИКЛИЧЕСКИМ ОСНОВАНИЯМ
- •АТОМ
- •РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В АТОМЕ ВОДОРОДА
- •ДВИЖЕНИЕ ЭЛЕКТРОНА В АТОМЕ
- •КВАНТОВЫЕ ЧИСЛА И ОРБИТАЛИ
- •КВАНТОВЫЕ ЧИСЛА
- •КВАНТОВЫЕ ЧИСЛА
- •КВАНТОВЫЕ ЧИСЛА
- •ПРИНЦИПЫ ЗАПОЛНЕНИЯ АТОМНЫХ ОРБИТАЛЕЙ ЭЛЕКТРОНАМИ
- •ПРИНЦИПЫ ЗАПОЛНЕНИЯ АТОМНЫХ ОРБИТАЛЕЙ ЭЛЕКТРОНАМИ
- •Схемы, иллюстрирующие уровни (а), подуровни (б), орбитали (в) атомов элементов
- •ПРИНЦИПЫ ЗАПОЛНЕНИЯ АТОМНЫХ ОРБИТАЛЕЙ эЛЕКТРОНАМИ
- •ПРИНЦИП ЗАПОЛНЕНИЯ АТОМНЫХ ОРБИТАЛЕЙ ЭЛЕКТРОНАМИ
- •ПРИНЦИП ЗАПОЛНЕНИЯ АТОМНЫХ ОРБИТАЛЕЙ ЭЛЕКТРОНАМИ
- •ПРИНЦИП ЗАПОЛНЕНИЯ АТОМНЫХ ОРБИТАЛЕЙ ЭЛЕКТРОНАМИ
- •ПРИНЦИП ЗАПОЛНЕНИЯ АТОМНЫХ ОРБИТАЛЕЙ ЭЛЕКТРОНАМИ
- •ПРИНЦИПЫ ЗАПОЛНЕНИЯ АТОМНЫХ ОРБИТАЛЕЙ ЭЛЕКТРОНАМИ
- •ХИМИЧЕСКАЯ СВЯЗЬ
- •ХИМИЧЕСКАЯ СВЯЗЬ энергия связи
- •При сближении атомов между их внешними электронами с противоположными спинами происходит сильное обменное
- •КОВАЛЕНТНАЯ СВЯЗЬ
- •ОТНОСИТЕЛЬНАЯ
- •ОСНОВНЫЕ ХАРАКТЕРИСТИКИ АТОМОВ ЭЛЕМЕНТОВ
- •ХАРАКТЕРИСТИКА АТОМА энергия ионизации
- •ОСНОВНЫЕ ХАРАКТЕРИСТИКИ АТОМОВ ЭЛЕМЕНТОВ
- •ОСНОВНЫЕ ХАРАКТЕРИСТИКИ АТОМОВ ЭЛЕМЕНТОВ
- •ХИМИЧЕСКАЯ СВЯЗЬ
- •ХИМИЧЕСКАЯ СВЯЗЬ
- •ХИМИЧЕСКАЯ СВЯЗЬ
- •СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИ
- •ПОЛЯРНОСТЬ КОВАЛЕНТНОЙ СВЯЗИ
- •ПОЛЯРНОСТЬ КОВАЛЕНТНОЙ СВЯЗИ
- •ПОЛЯРНОСТЬ и ПОЛЯРИЗУЕМОСТЬ СВЯЗИ
- •ХИМИЧЕСКАЯ СВЯЗЬ
- •ХИМИЧЕСКАЯ СВЯЗЬ
- •СТРУКТУРА ЛЬЮИСА И ФОРМАЛЬНЫЙ ЗАРЯД
- •СТРУКТУРА ЛЬЮИСА И ФОРМАЛЬНЫЙ ЗАРЯД
- •СТРУКТУРА ЛЬЮИСА И ФОРМАЛЬНЫЙ ЗАРЯД
- •СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИ длина связи
- •СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИ кратность связи
- •ОСОБЕННОСТИ КОВАЛЕНТНОЙ СВЯЗИ кратность связи
- •ОСОБЕННОСТИ КОВАЛЕНТНОЙ СВЯЗИ насыщаемость связи
- •ОСОБЕННОСТИ КОВАЛЕНТНОЙ СВЯЗИ насыщаемость связи
- •Начиная с третьего периода, у атомов р-элементов при возбуждении электроны внешних s- и
- •СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИ направленность
- •ГЕОМЕТРИЧЕСКОЕ СТРОЕНИЕ МОЛЕКУЛ
- •ГЕОМЕТРИЧЕСКОЕ СТРОЕНИЕ МОЛЕКУЛ
- •ГЕОМЕТРИЧЕСКОЕ СТРОЕНИЕ МОЛЕКУЛ
- •СОПРЯЖЕНИЕ КОВАЛЕНТНЫХ СВЯЗЕЙ
- •ХИМИЧЕСКИЕ РЕАКЦИИ
- •КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
- •ТИПЫ РЕАКЦИООНОСПОСОБНЫХ ЧАСТИЦ
- ••Нуклеофильной будем называть реакцию, при которой биомолекула атакует электрофильный центр низкомолекулярного участника процесса
- ••Свободно-радикальные реакции сопровождаются взаимодействием свободных радикалов с молекулами с образованием новых свободных радикалов
- •Химическая модификация нуклеиновых кислот. Сайты модификации в гетероциклах
- •РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ
- •РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ
- •РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ. SN1
- ••Характерный пример участия соседней группы мы находим в реакциях горчичного газа [бис-(2-хлорэтил)сульфида или
- •Химическая модификация гетероциклических оснований.
- •Природные алкилирующие реагенты (Повторите биохимию – механизмы переноса одноуглеродных
- •Азотистые аналоги иприта. Механизм SN1
- •Алкилирующие соединения латентной активности
- •Образование активной формы циклофосфана происходит в
- •Действие монозамещенных ( -хлорэтил)-аминов и ( -хлорэтил)-сульфидов
- •Взаимодействие нуклеиновых кислот и их компонентов с диметилсульфатом. Механизм SN1 или
- •Взаимодействие нуклеиновых кислот и их компонентов с диметилсульфатом
- •Метилирование ДНК
- •Разрыв молекулы ДНК (1)
- •Расщепление молекулы ДНК по АП-сайту
- •Взаимодействие с диазометаном. Зависимость от типа растворителя. Где ошибка в структуре?
- •Реакции с N-метил-N-нитрозосоединениями
- •Постсинтетическая модификация нуклеиновых кислот. Минорные основания
- •Природные алкилирующие реагенты (Повторите биохимию – механизмы переноса одноуглеродных
- •Схема синтеза S-аденозилметионина
- •S-аденозилметионин - алкилирующий реагент. SN2 механизм – нуклеофильное бимолекулярное
- •Метилирование ДНК (пострепликационная модификация)
- •Метилирование в последовательности -GC- цитозина
- •Алкилирование (метилирование) пуринов
- •Алкилирование аденозина
- •Алкилирование пиримидинов
- •Изопренилирование НК. Механизм SN1 или SN2?
- •Алкилирование аденозина
- •Минорные основания РНК. Вопрос: кислородсодержащие или серусодержащие гетероциклические основания будут проявлять большую реакционную
- •Реакции замещения у экзоциклических атомов кислорода и серы
- •Реакции замещения у экзоциклических атомов кислорода и серы
- •Реакции замещения у экзоциклического атома серы и азота в составе гетероцикла
- •Введение фотоактивируемых групп в молекулы НК с привлечением алкилирующих реагентов (А)
- •ДЛЯ ЧЕГО НУЖНЫ РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ.
- •БИООРТОГОНАЛЬНЫЕ РЕАКЦИИ
- •БИООРТОГОНАЛЬНЫЕ РЕАКЦИИ
- •БИООРТОГОНАЛЬНЫЕ РЕАКЦИИ. УСЛОВИЯ БИООРТОГОНАЛЬНОСТИ
- •А сколько биоорганику реакций нужно?
- ••Природа собирает все из молекул, как из конструктора «Лего». Мы тоже пытаемся пользоваться
- •Асколько химику реакций нужно?
- •ПЕРСПЕКТИВЫ "CLICK"-ХИМИИ
- •РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ. Пример для чего надо получать производные алкинов (например, для клик-
- •ПРИМЕР ИСПОЛЬЗОВАНИЯ КЛИК-ХИМИИ ДЛЯ ПОЛУЧЕНИЯ НАНОЧАСТИЦ, МОДИФИЦИРОВАННЫХ ПРОИЗВОДНЫМИ НУКЛЕОЗИД-5’-ТРИФОСФАТОВ, НЕСУЩИХ ФЛУОРЕСЦЕНТНУЮ РЕПОРТЕРНУЮ ГРУППУ
- •СХЕМА СИНЕЗА ИСХОДНОГО КОМПОНЕНТА ДЯ КЛИК-ХИМИИ
- •Пример использования наночастиц, полученных через клик-химию, для доставки нуклеотидного материала внутрь клетки
- •БИООРТОГОНАЛЬНЫЕ РЕАКЦИИ
- •БИООРТОГОНАЛЬНЫЕ РЕАКЦИИ
- •Что нужно знать после лекций

•РЕАКЦИИ ПО ГЕТЕРОЦИКЛИЧЕСКИМ ОСНОВАНИЯМ
•Прежде чем обсуждать реакционную способность различных функциональных групп и центров в гетероциклических основаниях, мы должны вспомнить материал из прошлой жизни. А у кого нет проблем с памятью, может сразу начинать работать со слайд №60.
1
АТОМ
•Атом – это сложная система, состоящая из положительно заряженного ядра и отрицательно заряженных электронов, движущихся в электрическом поле ядра. Объединяют всю систему силы электростатического взаимодействия разноименных (ядерно- электронное притяжение) и одноименных (межэлектронное отталкивание) электрических зарядов.
2
РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В АТОМЕ ВОДОРОДА
3
ДВИЖЕНИЕ ЭЛЕКТРОНА В АТОМЕ
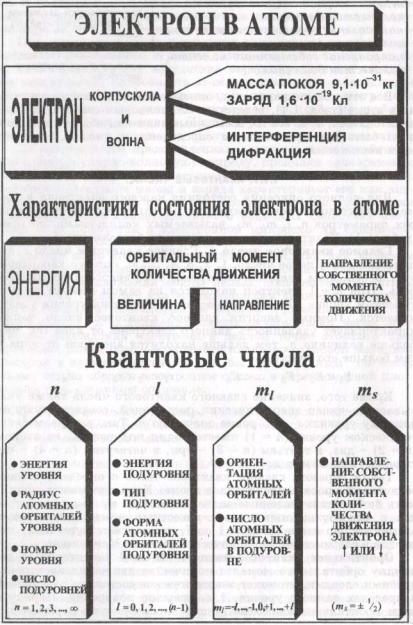
•Параметры для описания состояния электрона в атоме: энергия электрона, величина орбитального момента количества движения, направление орбитального момента количества движения, направление собственного момента количества движения.
•Все эти четыре параметра, описывающие состояние электрона в атоме, вследствие его волновых свойств должны квантоваться, т.е. все их возможные значения обязательно должны быть пропорциональны определенным числам, называемым квантовыми.
4
5
КВАНТОВЫЕ ЧИСЛА И ОРБИТАЛИ
•В квантовомеханической модели вводится три квантовых числа (n, l, ml), позволяющие описать орбитали.
•1. Главное квантовое число (n) связано со средним расстоянием электрона от ядра, т.е. характеризует удаленность данного электрона от ядра (r). В основном характеризует энергию электрона, т.е. энергетический уровень. Может принимать целочисленные значения 1,2,3 и так далее. Чем больше величина n, тем дальше находится электрон от ядра и тем больше его энергия. Значение главного квантового числа указывает также на число энергетических подуровней, соответствующих данному уровню.
6
КВАНТОВЫЕ ЧИСЛА
•2. Орбитальное квантовое число (l) характеризует величину орбитального момента количества движения электрона, т.е. уточняет энергетическое состояние электронов в пределах данного уровня (энергию подуровня). Оно определяет пространственную форму атомных орбиталей электрона. Может принимать целочисленные значения от 0 до n – 1. Различные значения числа l принято обозначать латинскими буквами.
• |
0 |
1 |
2 |
3 |
4 |
• |
s |
p |
d |
f |
g |
7
КВАНТОВЫЕ ЧИСЛА
•3. Магнитное (азимутальное) квантовое число ml
•Определяет ориентацию атомных орбиталей в магнитном поле атома, а также число атомных орбиталей на энергетическом подуровне.
•Принимает целочисленные значения от –l до +l, включая и нуль, т.е. всего 2l + 1 значений, которым отвечает число атомных орбиталей в данном подуровне. Так, любой s-подуровень, где l = 0, ml = 0, содержит одну s-орбиталь;
•p-подуровень, где l = 1, ml = -1, 0, +1 – три орбитали, ориентированные по координатным осям x, y, z;
•d-подуровень, где l =2, ml = -2, -1, 0, +1, +2 – пять d-орбиталей, симметрично ориентированных в
пространстве. |
8 |
КВАНТОВЫЕ ЧИСЛА
•Спиновое квантовое число ms.
•Число ms характеризует собственный момент количества движения электрона, получивший название спин, и принимает два значения +1/2 -1/2. Поскольку спин может иметь два противоположных направления, его часто обозначают или . Электроны, находящиеся на
одной орбитали и обладающие противоположно направленными спинами , называются
спаренными, а одиночный электрон на орбитали называется неспаренным.
9
ПРИНЦИПЫ ЗАПОЛНЕНИЯ АТОМНЫХ ОРБИТАЛЕЙ ЭЛЕКТРОНАМИ
•Число электронов в атоме химического элемента определяется зарядом ядра, который равен порядковому номеру этого элемента в периодической системе Менделеева.
•Конкретное распределение электронов по орбиталям атома называется его электронной конфигурацией.
•Распределение электронов в атомах подчиняется трем основным принципам: принципу минимума энергии (правило В.М. Клечковского), принципу Паули и правилу Гунда.
10
