
Физическая химия, лекции / 8
.pdf
Виды колебаний в нелинейной молекуле H2O.
2 типа валентных колебаний
1 тип деформационных колебаний
У 3-х ат. нелинейной М. всего 9 степеней свободы. Из них: 3 – поступательных; 3 – вращательных; 3 – колебательных.
Лекция 8.Состояния многоатомных частиц. |
1 |

Кривая потенциальной энергии E(R)
Емолекулы
0
R0
D
R1 R2
D
Eп
R0
R1 – минимальное расстояние между ядрами;
R R2 – максимальное расстояние между ядрами.
Т.к. не бывает полностью замороженных колебаний, то полная энергия молекулы Eп всегда больше минимума (D), а расстояние между ядрами колеблется в пределах от R1 до R2.
Равновесное расстояние между ядрами Энергия химической связи
Лекция 8.Состояния многоатомных частиц. |
2 |

Распределение Больцмана. Великая Китайская Стена.
У подножия стены всегда много людей.

 Я
Я
На вершине стены, куда тяжело подняться почти никого нет!
В мире молекул все точно так же.
Лекция 8.Состояния многоатомных частиц. |
3 |

Распределение Больцмана .
ωi = A e−Ei kБT
Wi – вероятность найти частицу в состоянии с энергией Ei.
Барометрическая формула (зависимость давления от высоты) – частный случай РБ.
P= P0 exp −M r g h −h0
RT
Лекция 8.Состояния многоатомных частиц. |
4 |

Молекула дихлорэтана в проекции Ньюмена
 Н
Н
Н
С
Н
Н
ϕCl
Cl
Лекция 8.Состояния многоатомных частиц. |
5 |
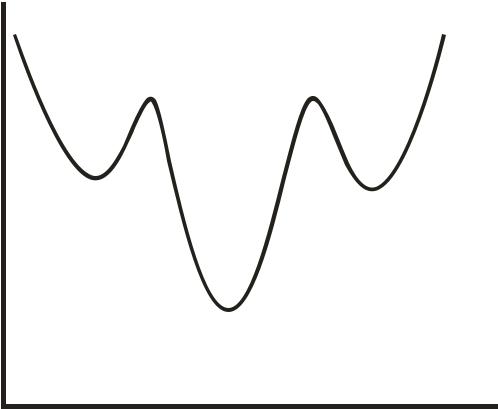
Энергия молекулы дихлорэтана как функция торсионного угла
U
0 |
|
|
|
|
180 |
360 ϕ° |
|||
Лекция 8.Состояния многоатомных частиц. |
6 |
