
Новосибирский государственный университет
Факультет естественных наук
Курсовая работа
по химической кинетике
Изучение автокаталитической реакции окисления щавелевой кислоты перманганатом калия
Выполнили: Прохорова Д.В., Цой Ю.В. гр. 12401
Руководитель: Лузгин М.В.
Новосибирск 2015
СОДЕРЖАНИЕ
|
Пункт |
Страница |
|
Введение …………………………………………………... |
..……… 3 |
|
Литературный обзор …………………………………….. |
..……… 4 |
|
Автокаталитические реакции…………………………... |
...……… 4 |
|
Реакция окисления щавелевой кислоты перманганатом калия………………………. |
……….6 |
|
Экспериментальная часть ……………………………… |
………. 8 |
|
Выводы …………………………………………………… |
………. 11 |
|
Список литературы ……………………………………. |
………. 12 |
Введение
Катализ- изменение скорости химической реакции при воздействии веществ (катализаторов), которые участвуют в реакции, но не входят в состав продуктов. Катализатор не находится в стехиометрических отношениях с продуктами и регенерируется после каждого цикла превращения реагентов в продукты. Он не смещает положения равновесия химической реакции и вблизи от равновесия ускоряет прямую и обратную реакции в равной степени.
Автокатализом называется явление, когда каталитическое действие на реакцию оказывает какой-либо из её продуктов.
Целью нашей работы являлось изучение зависимости константы скорости k автокаталитической реакции окисления щавелевой кислоты перманганатом калия от температуры и определение энергии активации данной реакции.
Литературный обзор Автокаталитические реакции
Автокаталитическая реакция - реакция, в которой один из её продуктов служит катализатором превращения исходных веществ.
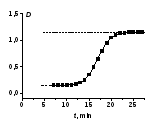
Для автокаталитической реакции характерно, что процесс идёт при возрастающей концентрации катализатора. В начальный период реакции, в период индукции, скорость реакции неизмеримо мала, затем она возрастает и лишь при достижении значительной степени превращения начинает падать в результате убыли концентрации исходных веществ. В результате кинетическая кривая для продукта реакции имеет S-образный вид (рис. 1), подобно кинетической кривой продукта двух последовательных реакций.
D
D0
Рис. 1. Кинетическая кривая изменения оптической плотности продукта автокаталитической реакции
Чтобы процесс мог развиться по автокаталитическому пути, в системе с самого начала должен присутствовать продукт реакции. Он может быть специально внесён экспериментатором (начальная затравка) или образовываться без участия катализатора.
В простейшем случае реакции первого порядка по А и В скорость образования продукта превращения равна
 (1)
(1)
Обозначая через x прирост [B] в результате реакции, т. е. полагая x = [B] – [B]0, и учитывая, что прирост [B] равен убыли [A], получаем следующее выражение:
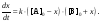 (2)
(2)
Уравнение такого же вида получается в случае, если никакой затравки в систему не вносится, но параллельно с автокаталитическим превращением идёт некаталитическое превращение А в В по реакции первого порядка. В этом случае
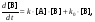 (3)
(3)
откуда
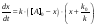 (4)
(4)
Интегрирование уравнения (2) дает
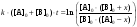 (5)
(5)
или в виде, разрешенном относительно х,
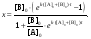 (6)
(6)
Если
ввести безразмерные переменные
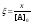 ,
,
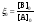 ,
то уравнение (6) примет вид
,
то уравнение (6) примет вид
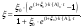 (7)
(7)
Если экспериментально получена кинетическая кривая автокаталитической реакции, следующей уравнению (2), то для вычисления константы скорости k пользуемся уравнениями (6 ,7).
Если [В]0 << [A]0, тогда соотношение (7) записываем в виде
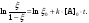 (8)
(8)
Построив
графически зависимость
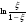 от t,
по наклону полученной прямой линии
можно определить k[A]0
и k.
от t,
по наклону полученной прямой линии
можно определить k[A]0
и k.
