
Ecology_lab_pract
.pdfболических превращений углеводородов нефти под действием бактерий сводятся к следующему:
H3C (CH2 )n CH3 O2 H3C (CH2 )n 1 COOH CO2 H2O .
Таким образом в окружающей среде оказываются значительно менее вредные соединения. Однако эти превращения идут очень медленно и лишь при определенных условиях (достаточной концентрации кислорода и температуре воды не ниже 5 - 10 С).
Бактерии разных видов селективно разрушают определенные компоненты нефтяного загрязнения, поэтому для полного самоочищения воды требуется наличие определенного комплекса микроорганизмов. При этом н-алканы, например, разлагаются значительно быстрее и легче, чем более устойчивые циклопарафины и ароматические углеводороды, однако последние быстрее растворяются. Легколетучие низкомолекулярные компоненты нефтяного загрязнения испаряются с поверхности нефтяной пленки и могут вызвать локальное загрязнение тропосферы. Предельно допустимая концентрация паров нефти составляет 10 мг/л. Содержание паров нефти в воздухе выше этого значения может вызвать болезни органов дыхания и нервной системы человека.
В пресноводных водоемах летальной концентрацией нефтепродуктов для взрослых особей рыб считается около 10 - 15 мг/л; при значительно более низких концентрациях (0,05 - 1,0 мг/л) гибнут икра и мальки, а также планктон - кормовая база рыб.
Определение содержания нефти и нефтепродуктов в воде базируется на измерении светопоглощения на длинах волн 400 и 280 нм, а также в ИК-диапазоне. При таком определении удобно использовать метод калибровочного графика.
Оборудование и реактивы
Спектрофотометр.
Кварцевые кюветы на 1 см, 3 - 4 шт. Пипетки на 10 мл, 2 шт.
Колбы мерные на 25 мл, 10 шт. Бензин.
55
Описание определения
Построение калибровочного графика. Готовят две серии стан-
дартных растворов: первая серия - растворы, содержащие от 4 до 15% бензина в воде; вторая серия - растворы, содержащие от 50 до 70% бензина в воде. Для этого в мерные колбы на 25 мл помещают соответст-
венно 1,0; 2,0; 3,0 и 4,0 мл (первая серия) и 12,0; 15,0; 17,0 и 19,0 мл
(вторая серия) бензина. Добавляют дистиллированную воду до метки и измеряют оптическую плотность первой серии стандартных растворов на длине волны 280 нм, а второй серии - на длине волны 400 нм в кюветах с толщиной слоя 1 см по отношению к чистой дистиллированной воде. По полученным данным строят калибровочные графики зависимости оптической плотности от концентрации бензина в воде.
Анализ проб воды. Исследуемую воду, содержащую бензин, помещают в кювету с толщиной слоя 1 см и измеряют оптическую плотность раствора на длинах волн 280 и 400 нм аналогично тому, как это делалось при построении калибровочного графика. По величине оптической плотности выбирают необходимый калибровочный график, по которому и определяют содержание бензина в воде.
56
Электрохимические методы анализа объектов окружающей среды
Каждый электрохимический параметр (потенциал, сила тока, сопротивление и др.) связан с концентрацией анализируемого раствора.
В основе электрохимических методов лежит процесс электролиза - химические реакции, протекающие под действием электрического тока на электродах, помещенных в раствор электролита.
Различают прямые и косвенные электрохимические методы. В прямых методах используют зависимость потенциала (силы тока и т.д.) от концентрации определяемого компонента, в косвенных методах потенциал (силу тока и т.д.) измеряют с целью нахождения конечной точки титрования, т.е. используют зависимость измеряемого параметра от объема титранта.
Для любого рода электрохимических измерений необходима электрохимическая ячейка, составной частью которой является анализируемый раствор.
Если электрохимическая ячейка работает в режиме гальванического элемента (ГЭ) (ток возникает в результате самопроизвольной химической реакции), необходимо наличие двух электродов: индикаторного и электрода сравнения.
Индикаторными электродами могут служить: стеклянный, хингид-
ронный, сурьмяный, водородный, серебряный, платиновый.
Индикаторный электрод обратим по катиону:
|
|
|
Me – nē Men+. |
|
|
|
Уравнение Нернста для него имеет вид: |
|
ln Men , |
||||
|
RT |
ln a |
|
или |
0,059 |
|
|
Men |
|
||||
|
nF |
|
n |
|||
a = [Men+] f,
где а - активность ионов; f - коэффициент активности; φ - стандартный электродный потенциал; [Men+] - концентрация ионов металлов, моль/л.
Электродами сравнения могут быть: хлоридсеребряный, каломель-
ный, водородный.
Для измерения pH раствора необходим электрод, который реагирует на изменение [H+]. Такими электродами могут быть водородный, хингидронный, стеклянный, сурьмяный.
57
Наиболее удобен в работе стеклянный электрод, состоящий из тонкой pH-чувствительной мембраны, изготовленной из стекла, содержащего 22% оксида натрия, 6% оксида кальция и 72% оксида кремния. Внутри стеклянной мембраны находится хлоридсеребряный электрод, погруженный в 0,1 н раствор HCl.
В качестве электрода сравнения наиболее часто применяют хлоридсеребряный электрод, состоящий из серебряной проволочки, электролитически покрытой слоем хлорида серебра, и погруженный в раствор хлорида калия. Потенциал такого электрода определяется уравнением AgCl + ē = Ag + Cl− , φ = φ AgCl/Ag,Cl− − 0,059lg[Cl−] и при
25 С равен 0,222 В. Схема ГЭ имеет вид:
Ag|AgCl|0,1 н HCl|стекло[H+]|HClнасыщ.|AgCl|Ag.
Потенциал стеклянного электрода описывается уравнением
φ = K +0,059lg aH+,
где K - константа, зависящая от сорта стекла и устройства электрода; aH+ - активность ионов водорода.
Для определения K стеклянный электрод калибруют по нескольким буферным растворам. Электрод позволяет измерять pH от 0 до 13. На рис.3 показаны стеклянный и хлоридсеребряный электроды.
Вкачестве электрода сравнения вместо хлоридсеребряного электрода можно применять каломельный электрод. Он состоит из ртути,
покрытой пастой Hg2Cl2, и погружен в насыщенный раствор KCl. Проволочка из пластины, опущенная в эту пасту, осуществляет контакт.
Воснове работы каломельного электрода лежит окислительновосстановительная полуреакция:
Hg2Cl2 (тв.) + 2ē 2Hg + 2 Cl–.
Схема ГЭ с использованием каломельного электрода в качестве электрода сравнения имеет вид:
Ag|AgCl|0,1 н HCl|стекло|[H+]|KClнасыщ.|Hg2Cl2|Hg.
Потенциал насыщенного каломельного электрода при 25 C равен
0,24 B.
Электроды сравнения содержат два раствора хлорида калия, один из которых (внешний) служит солевым мостиком и одновременно предотвращает загрязнение другого (внутреннего) раствора, исключая его
58
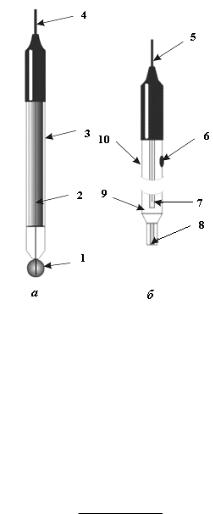
Рис.3. Стеклянный (а) и хлоридсеребряный (б) электроды: 1 - рН-чувствительная мембрана; 2 - 0,1 М раствор HCl, насыщенный AgCl; 3, 7 - серебряная проволочка, покрытая осадком AgCl и погруженная в KCl насыщ. (внутренний раствор); 4, 5 - контакты; 6 - отверстие для ввода раствора KCl; 8 - асбестовое волокно, обеспечивающее контакт с анализируемым раствором; 9 - внешний
раствор KCl насыщ.; 10 - стеклянный корпус
контакт с анализируемым раствором. Такие электроды называют электродами с двойным солевым мостиком. ЭДС ГЭ Е рассчитывается по разнице потенциалов электродов сравнения и индикаторного:
E = φAgCl/Ag, Cl− − φстекл, так как φстекл = 0,059[H+], E = φAgCl/Ag, Cl− − 0,059[H+] (pH = − lg[H+]),
pH = E AgCl/Ag,Cl .
0,059
Этот расчет автоматически выполняет иономер, и на панели прибора сразу выдается значение pH.
59
Работа № 7
Определение рН воды и почвы
При определении рН по методу нейтрализации наиболее применимы индикаторы: метиловый оранжевый, метиловый красный, лакмус и фенолфталеин. Поведение их упрощенно объясняет ионная теория индикаторов.
Согласно этой теории, индикаторы - слабые органические кислоты (или слабые основания), у которых недиссоциированные молекулы и образуемые ими ионы имеют различную окраску. Поэтому они носят общее название кислотно-основных индикаторов.
Если обозначить молекулы фенолфталеина через HInd, а его анионы - через Ind–, то уравнение диссоциации имеет вид:
HInd H+ + Ind ‾.
бесцветный малиновый
Если к этому раствору прибавить какую-нибудь сильную кислоту (или внести фенолфталеин в раствор кислоты), равновесие диссоциации его сместится влево, Н+-ионы сильной кислоты почти полностью свяжут окрашенные ионы Ind – в бесцветные молекулы HInd, и раствор обесцветится. Если же к раствору фенолфталеина прибавить щелочь (или внести фенолфталеин в раствор щелочи), то ее ОН–-ионы будут связывать Н+-ионы фенолфталеина, равновесие сместится вправо, в сторону увеличения ионов Ind –, и раствор окрасится в малиновый цвет.
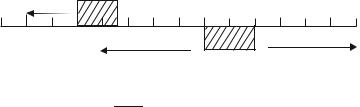
Каждый индикатор меняет окраску раствора в определенном, характерном для него интервале значений рН, который называется областью перехода индикатора. Так, в присутствии фенолфталеина раствор бесцветен при рН ≤ 8, а при рН ≥ 10 имеет интенсивно-малиновую окраску. Область перехода фенолфталеина лежит в интервале рН, равном 8 - 10, т.е. в щелочной среде.
На рис.4 показано изменение окраски метилового оранжевого и фенолфталеина при различных значениях рН.
60
Метиловый |
|
|
|
|
|
|
|
|
|
|
|
|
|
оранжевый |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Розовая |
|
|
|
|
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
|
|
|
|
|
|
|
|||||||
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
|
|
|
pH |
|
|
Малиновая |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
Фенолфталеин |
|
|
|
Бесцветная |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
Рис.4. Окраска метилового оранжевого и фенолфталеина при различных значениях рН.  - область перехода индикатора
- область перехода индикатора
Для приблизительного определения pH удобно пользоваться так называемым универсальным индикатором, представляющим собой смесь нескольких индикаторов, изменяющих окраску раствора в широком интервале рН. Бумага, пропитанная универсальным индикатором, называется универсальной индикаторной бумагой. К пачке такой бумаги прилагается цветная шкала, показывающая, какие окраски принимает индикаторная бумага при различных величинах рН нанесенного на нее раствора.
Оборудование и реактивы
Индикаторы: лакмус, фенолфталеин, метиловый оранжевый, метиловый красный, универсальная индикаторная бумага.
Растворы: соляной кислоты (0,1 н, 1 н); гидроксида натрия (0,1 н, 1 н). Иономер.
Буферные растворы с номинальными значениями рН = 1,65;
4,01; 9,18.
Электрод ионоселективный стеклянный. Электрод сравнения хлоридсеребряный. Стаканы стеклянные на 100, 250 мл.
Пробирки 10 шт. Фильтровальная бумага.
61
А. Определение рН воды с применением индикаторов
Для определения рН в кислой и щелочной средах наиболее часто применяют четыре индикатора: метиловый оранжевый, метиловый красный, лакмус и фенолфталеин. Наблюдения проведите в сильнокислой и сильнощелочной средах, чтобы в первом случае рН был заведомо ниже, а во втором - заведомо выше рН области перехода указанных индикаторов. Для этого в четыре пронумерованные пробирки внесите по 10 капель 0,1 н раствора соляной кислоты; в другие четыре пробирки, пронумерованные теми же номерами, - такой же объем 0,01 н раствора гидроксида калия. После этого в пробирки с кислотой и щелочью добавьте по 1 капле индикатора метилового оранжевого, метилового красного, лакмуса (5 капель) и фенолфталеина.
Наблюдения по изменению окраски индикаторов в кислой и щелочной средах запишите в форму табл.7, где уже указаны интервалы рН области перехода каждого индикатора и его окраска в этой области.
Форма таблицы 7
Изменение окраски индикаторов
|
рН облас- |
|
Окраска индикатора |
|
Индикатор |
ти пере- |
в кислой |
в области |
в щелоч- |
|
хода |
среде |
перехода |
ной среде |
Метиловый |
3,1 - 4,4 |
|
Оранжевая |
|
оранжевый |
|
|
||
|
|
|
|
|
Метиловый |
4,4 - 6,2 |
|
Оранжевая |
|
красный |
|
|
||
|
|
|
|
|
Лакмус |
5,0 - 8,0 |
|
Фиолетовая |
|
Фенолфталеин |
8,0 - 10,0 |
|
Бледно- |
|
|
малиновая |
|
||
|
|
|
|
|
Получите у преподавателя раствор, рН которого надо определить. При помощи пипетки перенесите 2 - 3 капли этого раствора на индикаторную бумагу с универсальным индикатором. Сравните окраску с цветной шкалой и выберите на ней оттенок, наиболее близкий к цвету полученного пятна. Сделайте вывод о рН исследуемого раствора и укажите реакцию среды. Проверьте правильность своего вывода у преподавателя.
62
Б. Определение рН воды на иономере методом прямой потенциометрии
На иономере рН раствора определяют с точностью до ±0,02 единицы рН. Датчиком, регистрирующим величину рН раствора, является стеклянный электрод, электродом сравнения - хлоридсеребряный.
Проверку электродов и настройку иономера проводят по буферным растворам.
Перед началом измерений стеклянный электрод должен быть выдержан не менее суток в 0,1 М растворе HCl или в дистиллированной воде.
Описание определения
Иономер после включения в сеть и прогревания в течение 30 минут настраивают по двум буферным растворам - в кислой и щелочной областях рН. Для этого в стакан наливают соответствующий буферный раствор, опускают электрод, фиксируют значение рН и, если необходимо, корректируют его с помощью специальной настройки. Перед каждым погружением в буферный или исследуемый раствор электрод тщательно промывают дистиллированной водой и оставляют погруженным в воду.
Результаты измерений записывают в тетрадь. По значению рН вычисляют концентрацию ионов [H+] и [OH−] в растворе. Полученные результаты cообщают преподавателю.
В. Определение рН почвы
Повышенная кислотность почвы вредна для большинства сельскохозяйственных растений. Под ее действием в почве гибнут полезные микроорганизмы (клубеньковые бактерии, азотобактерии и др.). Проверяя кислотность почвы, выясняют необходимость ее известкования.
Различают две формы почвенной кислотности: активную и скрытую.
Активная кислотность вызывается присутствием в почвенном растворе свободных ионов H+. Определяют ее по величине pH водной вытяжки из почвы.
63
Скрытая (потенциальная) кислотность обусловлена ионами H+ и Al3+, поглощенными почвой. В свою очередь она подразделяется на обменную и гидролитическую.
Обменная кислотность проявляется, когда поглощенные почвой ионы H+ и Al3+ обмениваются на катионы негидролизующихся солей и переходят в почвенный раствор. Гидролиз солей Al3+ еще более повышает кислотность этого раствора. Определяют обменную кислотность, измеряя величину pH вытяжки из почвы, приготовленной на водном растворе хлорида калия.
Гидролитическая кислотность обуславливается ионами H+ и Al3+, поглощенными почвой, но переходящими в раствор под действием гидролизующихся солей, образованных щелочными металлами. Определяют ее, измеряя pH вытяжки из почвы, приготовленной на растворе ацетата натрия CH3COONa.
Вопросы известкования почвы решают главным образом исходя из ее обменной кислотности. При этом определяют pH солевой вытяжки.
При pH от 3 до 5 почвы считаются кислыми, от 5 до 7 - слабокислыми, при pH, равном 7, - нейтральными и выше 7 - щелочными.
Зная pH почвы, можно приступить к известкованию. В табл.8 приведены нормы внесения молотого известняка при разных значениях pH почвы.
|
|
|
|
|
Таблица 8 |
|
Нормы внесения молотого известняка (кг/10 м2) |
|
|||||
при различных значениях pH почвы |
|
|||||
|
|
|
|
|
|
|
Состав почвы |
|
|
pH почвы |
|
||
4,5 и меньше |
4,8 |
5,2 |
5,4 - 5,8 |
6,1 - 6,3 |
||
|
||||||
Супесчаная и лег- |
4 |
3 |
2 |
2 |
- |
|
косуглинистая |
||||||
|
|
|
|
|
||
Средне- и тяжело- |
6 |
5 |
4 |
3,5 |
3 |
|
суглинистая |
||||||
|
|
|
|
|
||
Вместо известняка можно использовать мел, гашеную известь, древесную золу, доломитовую муку. Гашеную известь вносят в норме, уменьшенной в 1,35 раза по сравнению с известняком, а золу из расчета в 2 - 10 раз больше. Мел, доломитовую муку приравнивают к известняку.
64
