
- •«Национальный исследовательский ядерный университет «мифи» Озерский технологический институт – филиал нияу мифи
- •Оглавление
- •Введение
- •1 Литературный обзор
- •2 Экспериментальная часть
- •2.1.1 Определение общей кислотности воды
- •2.1.2 Определение общей щелочности воды
- •2.1.3 Определение общей жесткости воды
- •2.1.4 Определение рН воды с помощью стеклянного электрода
- •2.2 Оборудование, посуда, химические реактивы:
- •2.3 Приготовление растворов
- •3 Ход работы
- •3.1 Определение показателей качества водопроводной воды (озеро Иртяш)
- •3.1.1 Определение общей кислотности воды
- •3.1.2 Определение общей щелочности воды
- •3.1.3 Определение общей жесткости воды
- •3.1.4 Определение рН воды с помощью стеклянного электрода
- •3.2 Определение показателей качества воды из Метлино
- •3.2.1Определение общей кислотности воды
- •3.2.2Определение общей щелочности воды
- •3.2.3Определение общей жесткости воды
- •3.2.4 Определение рН воды с помощью стеклянного электрода
- •3.3 Моделирование воды
- •3.3.1 Определение общей кислотности воды
- •3.3.2 Определение общей щелочности воды
- •3.3.3 Определение общей жесткости воды
- •3.3.4 Определение рН воды с помощью стеклянного электрода
- •3.4 Определение показателей качества водопроводной воды с 50мг натрием углекислым
- •3.4.1 Определение общей кислотности воды
- •3.4.2 Определение общей щелочности воды
- •3.4.3 Определение общей жесткости воды
- •3.4.4 Определение рН воды с помощью стеклянного электрода
- •3.5 Определение показателей качества с добавлением в дистиллированную воду натрий двууглекислый
- •3.5.1 Определение общей кислотности воды
- •3.5.2 Определение общей щелочности воды
- •3.5.3 Определение общей жесткости воды
- •3.5.4 Определение рН воды с помощью стеклянного электрода
- •3.6 Определение показателей качества с добавляем в дистиллированную воду натрий углекислый
- •3.6.1 Определение общей кислотности воды
- •3.6.2Определение общей щелочности воды
- •3.6.3 Определение общей жесткости воды
- •3.6.4 Определение рН воды с помощью стеклянного электрода
- •3.7 Определение показателей качества воды из скважины №2 (поселок Татыш)
- •3.7.1 Определение общей кислотности воды
- •3.7.2 Определение общей щелочности воды
- •3.7.3 Определение общей жесткости воды
- •3.7.4 Определение рН воды с помощью стеклянного электрода
- •3.8 Определение показателей качества водопроводной воды с хлорид аммонием
- •3.8.1 Определение общей кислотности воды
- •3.8.2 Определение общей щелочности воды
- •3.8.3 Определение общей жесткости воды
- •3.8.4 Определение рН воды с помощью стеклянного электрода
- •3.9 Определение показателей качества водопроводной воды с аммоний углекислым кислым
- •3.9.1 Определение общей кислотности воды
- •3.9.2 Определение общей щелочности воды
- •3.9.3 Определение общей жесткости воды
- •3.9.4 Определение рН воды с помощью стеклянного электрода
- •3.10 Определение показателей водопроводной воды с аммонием углекислым кислым
- •3.10.1 Определение общей кислотности воды
- •3.10.2 Определение общей щелочности воды
- •3.10.3 Определение общей жесткости воды
- •3.10.4 Определение рН воды с помощью стеклянного электрода
- •3.11 Определение показателей качества водопроводной воды с аммонием углекислым кислым 60
- •3.11.1 Определение общей кислотности воды
- •3.11.2 Определение общей щелочности воды
- •3.11.3 Определение общей жесткости воды
- •3.11.4 Определение рН воды с помощью стеклянного электрода
- •3.12 Определение показателей качества воды из скважины №1 (сад №12).
- •3.12.1 Определение общей кислотности воды
- •3.12.2 Определение общей щелочности воды
- •3.12.3 Определение общей жесткости воды
- •3.12.4 Определение рН воды с помощью стеклянного электрода
- •3.13 Определение показателей качества водопроводной воды с калием сернокислым кислым khso4
- •3.13.1 Определение общей кислотности воды
- •3.13.2 Определение общей щелочности воды
- •3.13.3 Определение общей жесткости воды
- •3.13.4 Определение рН воды с помощью стеклянного электрода
- •3.14 Определение показателей качества водопроводной воды с калием сернокислым кислым khso4
- •3.14.1 Определение общей кислотности воды
- •3.14.2 Определение общей щелочности воды
- •3.14.3 Определение общей жесткости воды
- •3.14.4 Определение рН воды с помощью стеклянного электрода
- •3.15 Определение показателей качества водопроводной воды с калием-натрием углекислым k2co3·Na2co3
- •3.15.1 Определение общей кислотности воды
- •3.15.2 Определение общей щелочности воды
- •3.15.3 Определение общей жесткости воды
- •3.15.4 Определение рН воды с помощью стеклянного электрода
- •3.16 Определение показателей качества водопроводной воды с калием-натрием углекислым k2co3·Na2co3
- •3.16.1 Определение общей кислотности воды
- •3.16.2 Определение общей щелочности воды
- •3.16.3 Определение общей жесткости воды
- •3.16.4 Определение рН воды с помощью стеклянного электрода
- •3.17 Определение показателей качества водопроводной воды с MgCi2 и 0,1н hci
- •3.17.1 Определение общей кислотности воды
- •3.17.2 Определение общей щелочности воды
- •3.17.3 Определение общей жесткости воды
- •3.17.4 Определение рН воды с помощью стеклянного электрода
- •3.18 Определение показателей качества водопроводной воды с 0,1н kci и NaOh
- •3.18.1 Определение общей кислотности воды
- •3.18.2 Определение общей щелочности воды
- •3.18.3 Определение общей жесткости воды
- •3.18.4 Определение рН воды с помощью стеклянного электрода
- •4. Заключение
3.1.4 Определение рН воды с помощью стеклянного электрода
Промыть электроды и стакан для пробы дистиллированной водой. Налить в стакан для пробы исследуемый раствор. Включить прибор рН-метр. На потенциометре установить температуру раствора. Переключить mV/pH, установить в положение «рН». При помощи держателя погрузить электроды в стакан с исследуемым раствором. Запишем установившееся значение рН.
t = 21,60C
pH = 8,3
3.2 Определение показателей качества воды из Метлино
3.2.1Определение общей кислотности воды
В коническую колбу емкостью 250 мл отмеряем пипеткой 100 мл исследуемой воды, прибавляем 3 капли фенолфталеина. Пробу титруем раствором щелочи до появления слабо-розовой окраски, не исчезающей в течение 1-2 минут. Проводим два параллельных титрования.
 = 2,8 мл(объем щелочи,
израсходованной на титрование)
= 2,8 мл(объем щелочи,
израсходованной на титрование)
 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора щелочи)
 =
=
 =
= = 2,8 мг-экв/л (1)
= 2,8 мг-экв/л (1)
 = 3,0 мл(объем щелочи,
израсходованной на титрование)
= 3,0 мл(объем щелочи,
израсходованной на титрование)
 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора щелочи)
 =
=
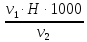 =
= = 3,0 мг-экв/л (1)
= 3,0 мг-экв/л (1)
Рассчитываем среднюю общую кислотность
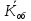 =
=
 = 2,9 мг-экв/л
= 2,9 мг-экв/л
3.2.2Определение общей щелочности воды
В коническую колбу емкостью 250 мл отмеряем пипеткой 100 мл исследуемой воды. Прибавляем 3 капли метилоранжа и титруем раствором кислоты до перехода желтой окраски в оранжевую. Проводим два параллельных титрования.
 = 4,4 мл(объем кислоты,
израсходованной на титрование)
= 4,4 мл(объем кислоты,
израсходованной на титрование)
 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
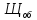 =
=
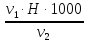 =
= = 4,4 мг-экв/л (2)
= 4,4 мг-экв/л (2)
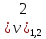 = 4,2 мл(объем кислоты,
израсходованной на титрование)
= 4,2 мл(объем кислоты,
израсходованной на титрование)
 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
 =
=
 =
= = 4,2 мг-экв/л (2)
= 4,2 мг-экв/л (2)
Рассчитываем среднюю общую щелочность
 =
=
 = 4,3 мг-экв/л
= 4,3 мг-экв/л
3.2.3Определение общей жесткости воды
В коническую колбу наливаем 80 мл испытуемой воды, разбавленный до 100 мл дистиллированной водой. При этом суммарное содержание ионов кальция и магния во взятом объеме воды не должно превышать 0,5 ммоль. Затем прибавляем 5 мл буферного раствора, 0,1 г сухой смеси индикатора хромогена черного с сухим хлористым натрием и сразу же титруем при сильном взбалтывании 0,05 н. раствором трилона Б до изменения окраски в эквивалентной точке. Проводим два параллельных титрования.
Окраску получили
синею. Появление этого окрашивания
свидетельствует об отсутствии ионов
 и
и в растворе, т.е. о полном связывании их
с трилоном Б.
в растворе, т.е. о полном связывании их
с трилоном Б.
 = 14,8 мл
= 14,8 мл
Так как на титрование было израсходовано больше 10 мл 0,05 н. раствора трилона Б, то это указывает, что в отмеренном объеме воды суммарное содержание ионов кальция и магния превышает 0,5 ммоль. В таком случае определение повторяем, взяв меньший объем воды 50 мл и разбавив его до 100 мл дистиллированной водой.
 = 9,2 мл;
= 9,2 мл;
Общую жесткость воды вычисляют по уравнению (3)
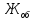 =
=
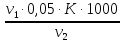
К – поправочный коэффициент к нормальной концентрации раствора трилона Б
 –количество
трилона Б, израсходованное на титрование
пробы
–количество
трилона Б, израсходованное на титрование
пробы
 –объем воды,
взятой для определения общей жесткости
–объем воды,
взятой для определения общей жесткости
Для раствора трилона Б с концентрацией 0,05 н. поправочный коэффициент равен К=0,9600.
 =
=
 = 8,880 мг-экв/л
= 8,880 мг-экв/л
 =
=
 = 8,832 мг-экв/л
= 8,832 мг-экв/л
Рассчитываем среднюю жесткость и относительную погрешность
 =
=
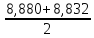 = 8,856
= 8,856
ᵟ =
 · 100%= 0,54%
· 100%= 0,54%
