
- •«Национальный исследовательский ядерный университет «мифи» Озерский технологический институт – филиал нияу мифи
- •Оглавление
- •Введение
- •1 Литературный обзор
- •2 Экспериментальная часть
- •2.1.1 Определение общей кислотности воды
- •2.1.2 Определение общей щелочности воды
- •2.1.3 Определение общей жесткости воды
- •2.1.4 Определение рН воды с помощью стеклянного электрода
- •2.2 Оборудование, посуда, химические реактивы:
- •2.3 Приготовление растворов
- •3 Ход работы
- •3.1 Определение показателей качества водопроводной воды (озеро Иртяш)
- •3.1.1 Определение общей кислотности воды
- •3.1.2 Определение общей щелочности воды
- •3.1.3 Определение общей жесткости воды
- •3.1.4 Определение рН воды с помощью стеклянного электрода
- •3.2 Определение показателей качества воды из Метлино
- •3.2.1Определение общей кислотности воды
- •3.2.2Определение общей щелочности воды
- •3.2.3Определение общей жесткости воды
- •3.2.4 Определение рН воды с помощью стеклянного электрода
- •3.3 Моделирование воды
- •3.3.1 Определение общей кислотности воды
- •3.3.2 Определение общей щелочности воды
- •3.3.3 Определение общей жесткости воды
- •3.3.4 Определение рН воды с помощью стеклянного электрода
- •3.4 Определение показателей качества водопроводной воды с 50мг натрием углекислым
- •3.4.1 Определение общей кислотности воды
- •3.4.2 Определение общей щелочности воды
- •3.4.3 Определение общей жесткости воды
- •3.4.4 Определение рН воды с помощью стеклянного электрода
- •3.5 Определение показателей качества с добавлением в дистиллированную воду натрий двууглекислый
- •3.5.1 Определение общей кислотности воды
- •3.5.2 Определение общей щелочности воды
- •3.5.3 Определение общей жесткости воды
- •3.5.4 Определение рН воды с помощью стеклянного электрода
- •3.6 Определение показателей качества с добавляем в дистиллированную воду натрий углекислый
- •3.6.1 Определение общей кислотности воды
- •3.6.2Определение общей щелочности воды
- •3.6.3 Определение общей жесткости воды
- •3.6.4 Определение рН воды с помощью стеклянного электрода
- •3.7 Определение показателей качества воды из скважины №2 (поселок Татыш)
- •3.7.1 Определение общей кислотности воды
- •3.7.2 Определение общей щелочности воды
- •3.7.3 Определение общей жесткости воды
- •3.7.4 Определение рН воды с помощью стеклянного электрода
- •3.8 Определение показателей качества водопроводной воды с хлорид аммонием
- •3.8.1 Определение общей кислотности воды
- •3.8.2 Определение общей щелочности воды
- •3.8.3 Определение общей жесткости воды
- •3.8.4 Определение рН воды с помощью стеклянного электрода
- •3.9 Определение показателей качества водопроводной воды с аммоний углекислым кислым
- •3.9.1 Определение общей кислотности воды
- •3.9.2 Определение общей щелочности воды
- •3.9.3 Определение общей жесткости воды
- •3.9.4 Определение рН воды с помощью стеклянного электрода
- •3.10 Определение показателей водопроводной воды с аммонием углекислым кислым
- •3.10.1 Определение общей кислотности воды
- •3.10.2 Определение общей щелочности воды
- •3.10.3 Определение общей жесткости воды
- •3.10.4 Определение рН воды с помощью стеклянного электрода
- •3.11 Определение показателей качества водопроводной воды с аммонием углекислым кислым 60
- •3.11.1 Определение общей кислотности воды
- •3.11.2 Определение общей щелочности воды
- •3.11.3 Определение общей жесткости воды
- •3.11.4 Определение рН воды с помощью стеклянного электрода
- •3.12 Определение показателей качества воды из скважины №1 (сад №12).
- •3.12.1 Определение общей кислотности воды
- •3.12.2 Определение общей щелочности воды
- •3.12.3 Определение общей жесткости воды
- •3.12.4 Определение рН воды с помощью стеклянного электрода
- •3.13 Определение показателей качества водопроводной воды с калием сернокислым кислым khso4
- •3.13.1 Определение общей кислотности воды
- •3.13.2 Определение общей щелочности воды
- •3.13.3 Определение общей жесткости воды
- •3.13.4 Определение рН воды с помощью стеклянного электрода
- •3.14 Определение показателей качества водопроводной воды с калием сернокислым кислым khso4
- •3.14.1 Определение общей кислотности воды
- •3.14.2 Определение общей щелочности воды
- •3.14.3 Определение общей жесткости воды
- •3.14.4 Определение рН воды с помощью стеклянного электрода
- •3.15 Определение показателей качества водопроводной воды с калием-натрием углекислым k2co3·Na2co3
- •3.15.1 Определение общей кислотности воды
- •3.15.2 Определение общей щелочности воды
- •3.15.3 Определение общей жесткости воды
- •3.15.4 Определение рН воды с помощью стеклянного электрода
- •3.16 Определение показателей качества водопроводной воды с калием-натрием углекислым k2co3·Na2co3
- •3.16.1 Определение общей кислотности воды
- •3.16.2 Определение общей щелочности воды
- •3.16.3 Определение общей жесткости воды
- •3.16.4 Определение рН воды с помощью стеклянного электрода
- •3.17 Определение показателей качества водопроводной воды с MgCi2 и 0,1н hci
- •3.17.1 Определение общей кислотности воды
- •3.17.2 Определение общей щелочности воды
- •3.17.3 Определение общей жесткости воды
- •3.17.4 Определение рН воды с помощью стеклянного электрода
- •3.18 Определение показателей качества водопроводной воды с 0,1н kci и NaOh
- •3.18.1 Определение общей кислотности воды
- •3.18.2 Определение общей щелочности воды
- •3.18.3 Определение общей жесткости воды
- •3.18.4 Определение рН воды с помощью стеклянного электрода
- •4. Заключение
2 Экспериментальная часть
2.1.1 Определение общей кислотности воды
В коническую колбу емкостью 250 мл отмеряют пипеткой 100 мл исследуемой воды, прибавляют 2-3 капли фенолфталеина. Пробу титруют раствором щелочи до появления слабо-розовой окраски, не исчезающей в течение 1-2 минут.
Общая кислотность рассчитывается по уравнению (1):
 =
=
 [мг-экв/л]
[мг-экв/л]
 - объем щелочи,
израсходованной на титрование [мл]
- объем щелочи,
израсходованной на титрование [мл]
 - объем воды, взятой
для исследования [мл]
- объем воды, взятой
для исследования [мл]
Н - нормальная концентрация рабочего раствора щелочи
2.1.2 Определение общей щелочности воды
В коническую колбу емкостью 250 мл отмеряют пипеткой 100 мл исследуемой воды. Прибавляют 2-3 капли метилоранжа и титруют раствором кислоты до перехода желтой окраски в оранжевую.
Общая щелочность рассчитывается по уравнению (2):
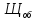 =
=
 [г-экв/л]
[г-экв/л]
 - объем кислоты,
израсходованной на титрование [мл]
- объем кислоты,
израсходованной на титрование [мл]
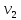 - объем воды, взятой
для исследования [мл]
- объем воды, взятой
для исследования [мл]
Н – нормальная концентрация рабочего раствора кислоты
2.1.3 Определение общей жесткости воды
В коническую колбу наливают 100 мл испытуемой воды или меньший объем, разбавленный до 100 мл дистиллированной водой. При этом суммарное содержание ионов кальция и магния во взятом объеме воды не должно превышать 0,5 ммоль. Затем прибавляют 5 мл буферного раствора, 5-7 капель индикатора или приблизительно 0,1 г сухой смеси индикатора хромогена черного с сухим хлористым натрием и сразу же титруют при сильном взбалтывании 0,05 н. раствором трилона Б до изменения окраски в эквивалентной точке (окраска должна быть синей с зеленоватым оттенком).
Общая жесткость рассчитывается по уравнению (3):
 =
=
 [мг-экв/л]
[мг-экв/л]
К – поправочный коэффициент к нормальной концентрации раствора трилона Б
 –количество
трилона Б, израсходованное на титрование
пробы
–количество
трилона Б, израсходованное на титрование
пробы
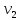 –объем воды,
взятой для определения общей жесткости
–объем воды,
взятой для определения общей жесткости
2.1.4 Определение рН воды с помощью стеклянного электрода
1. Промыть электроды и стакан для пробы дистиллированной водой.
2. Налить в стакан для пробы исследуемый раствор.
3. Включить прибор рН-метр.
4. На потенциометре установить температуру раствора.
5. Переключить mV/pH, установить в положение «рН».
6. При помощи держателя погрузить электроды в стакан с исследуемым раствором.
7. Записать установившееся значение рН.
8. По окончанию измерений промыть электроды дистиллированной водой.
2.2 Оборудование, посуда, химические реактивы:
Аналитические весы GX‒200
рН-метр/иономер ИПЛ‒102
штатив, держатели (титровальная установка)
Конические колбы – 250 мл
Пипетки Мора – 5 мл, 50 мл
Бюретка – 25 мл
Спринцовка
Мерная колба – 1000 мл, 500 мл
NaOH – 0,1 н
Фенолфталеин – 1%-й раствор в 60%-м водном спиртовом растворе
HCI ‒ 0,1 н
Метиловый оранжевый ‒ 0,03%-й раствор
Раствор трилона Б ‒ 0,05 н
Буферный раствор
Хромоген черный с хлористым натрием
2.3 Приготовление растворов
ЭДТА 0,05 н – получаем из раствора ЭДТА 0,05 моль/л. Для этого в 250 мл ЭДТА 0,05 моль/л добавляем 250 мл дистиллированной воды.
Готовим раствор фенолфталеина (1%-й раствор в 60%-м водном спиртовом растворе). Для этого беру 0,5 г фенолфталеина на 50 мл спирта.
Для приготовления 0,1 н раствора едкого натрия NaOH растворяют 5,5 г химически чистого NaOH в 1 л дистиллированной воды, предварительно прокипяченной для удаления диоксида углерода СО2. Такое количество NaOH берут, исходя из следующего. Молекула едкого натрия содержит только одну гидроксильную группу, поэтому нормальный раствор его должен содержать в 1 л примерно 40 г едкого натрия (молекулярная масса NaOH 40,01), а 0,1 н раствор - 4 г.
Для приготовления нормального раствора соляной кислоты надо взять 100 мл чистой соляной кислоты (удельный вес 1,19), содержащей обычно около 40% безводной НС1, и развести до одного литра дистиллированной водой (нормальный раствор соляной кислоты содержит в 1 л 36,46 г НС1).
