
- •«Национальный исследовательский ядерный университет «мифи» Озерский технологический институт – филиал нияу мифи
- •Оглавление
- •Введение
- •1 Литературный обзор
- •2 Экспериментальная часть
- •2.1.1 Определение общей кислотности воды
- •2.1.2 Определение общей щелочности воды
- •2.1.3 Определение общей жесткости воды
- •2.1.4 Определение рН воды с помощью стеклянного электрода
- •2.2 Оборудование, посуда, химические реактивы:
- •2.3 Приготовление растворов
- •3 Ход работы
- •3.1 Определение показателей качества водопроводной воды (озеро Иртяш)
- •3.1.1 Определение общей кислотности воды
- •3.1.2 Определение общей щелочности воды
- •3.1.3 Определение общей жесткости воды
- •3.1.4 Определение рН воды с помощью стеклянного электрода
- •3.2 Определение показателей качества воды из Метлино
- •3.2.1Определение общей кислотности воды
- •3.2.2Определение общей щелочности воды
- •3.2.3Определение общей жесткости воды
- •3.2.4 Определение рН воды с помощью стеклянного электрода
- •3.3 Моделирование воды
- •3.3.1 Определение общей кислотности воды
- •3.3.2 Определение общей щелочности воды
- •3.3.3 Определение общей жесткости воды
- •3.3.4 Определение рН воды с помощью стеклянного электрода
- •3.4 Определение показателей качества водопроводной воды с 50мг натрием углекислым
- •3.4.1 Определение общей кислотности воды
- •3.4.2 Определение общей щелочности воды
- •3.4.3 Определение общей жесткости воды
- •3.4.4 Определение рН воды с помощью стеклянного электрода
- •3.5 Определение показателей качества с добавлением в дистиллированную воду натрий двууглекислый
- •3.5.1 Определение общей кислотности воды
- •3.5.2 Определение общей щелочности воды
- •3.5.3 Определение общей жесткости воды
- •3.5.4 Определение рН воды с помощью стеклянного электрода
- •3.6 Определение показателей качества с добавляем в дистиллированную воду натрий углекислый
- •3.6.1 Определение общей кислотности воды
- •3.6.2Определение общей щелочности воды
- •3.6.3 Определение общей жесткости воды
- •3.6.4 Определение рН воды с помощью стеклянного электрода
- •3.7 Определение показателей качества воды из скважины №2 (поселок Татыш)
- •3.7.1 Определение общей кислотности воды
- •3.7.2 Определение общей щелочности воды
- •3.7.3 Определение общей жесткости воды
- •3.7.4 Определение рН воды с помощью стеклянного электрода
- •3.8 Определение показателей качества водопроводной воды с хлорид аммонием
- •3.8.1 Определение общей кислотности воды
- •3.8.2 Определение общей щелочности воды
- •3.8.3 Определение общей жесткости воды
- •3.8.4 Определение рН воды с помощью стеклянного электрода
- •3.9 Определение показателей качества водопроводной воды с аммоний углекислым кислым
- •3.9.1 Определение общей кислотности воды
- •3.9.2 Определение общей щелочности воды
- •3.9.3 Определение общей жесткости воды
- •3.9.4 Определение рН воды с помощью стеклянного электрода
- •3.10 Определение показателей водопроводной воды с аммонием углекислым кислым
- •3.10.1 Определение общей кислотности воды
- •3.10.2 Определение общей щелочности воды
- •3.10.3 Определение общей жесткости воды
- •3.10.4 Определение рН воды с помощью стеклянного электрода
- •3.11 Определение показателей качества водопроводной воды с аммонием углекислым кислым 60
- •3.11.1 Определение общей кислотности воды
- •3.11.2 Определение общей щелочности воды
- •3.11.3 Определение общей жесткости воды
- •3.11.4 Определение рН воды с помощью стеклянного электрода
- •3.12 Определение показателей качества воды из скважины №1 (сад №12).
- •3.12.1 Определение общей кислотности воды
- •3.12.2 Определение общей щелочности воды
- •3.12.3 Определение общей жесткости воды
- •3.12.4 Определение рН воды с помощью стеклянного электрода
- •3.13 Определение показателей качества водопроводной воды с калием сернокислым кислым khso4
- •3.13.1 Определение общей кислотности воды
- •3.13.2 Определение общей щелочности воды
- •3.13.3 Определение общей жесткости воды
- •3.13.4 Определение рН воды с помощью стеклянного электрода
- •3.14 Определение показателей качества водопроводной воды с калием сернокислым кислым khso4
- •3.14.1 Определение общей кислотности воды
- •3.14.2 Определение общей щелочности воды
- •3.14.3 Определение общей жесткости воды
- •3.14.4 Определение рН воды с помощью стеклянного электрода
- •3.15 Определение показателей качества водопроводной воды с калием-натрием углекислым k2co3·Na2co3
- •3.15.1 Определение общей кислотности воды
- •3.15.2 Определение общей щелочности воды
- •3.15.3 Определение общей жесткости воды
- •3.15.4 Определение рН воды с помощью стеклянного электрода
- •3.16 Определение показателей качества водопроводной воды с калием-натрием углекислым k2co3·Na2co3
- •3.16.1 Определение общей кислотности воды
- •3.16.2 Определение общей щелочности воды
- •3.16.3 Определение общей жесткости воды
- •3.16.4 Определение рН воды с помощью стеклянного электрода
- •3.17 Определение показателей качества водопроводной воды с MgCi2 и 0,1н hci
- •3.17.1 Определение общей кислотности воды
- •3.17.2 Определение общей щелочности воды
- •3.17.3 Определение общей жесткости воды
- •3.17.4 Определение рН воды с помощью стеклянного электрода
- •3.18 Определение показателей качества водопроводной воды с 0,1н kci и NaOh
- •3.18.1 Определение общей кислотности воды
- •3.18.2 Определение общей щелочности воды
- •3.18.3 Определение общей жесткости воды
- •3.18.4 Определение рН воды с помощью стеклянного электрода
- •4. Заключение
3.13.2 Определение общей щелочности воды
В коническую колбу емкостью 250 мл отмеряем пипеткой 100 мл исследуемой воды. Прибавляем 3 капли метилоранжа и титруем раствором кислоты до перехода желтой окраски в оранжевую. Проводим три параллельных титрования.
 = 2,0 мл(объем кислоты,
израсходованной на титрование)
= 2,0 мл(объем кислоты,
израсходованной на титрование)
 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
 =
=
 =
= = 2,0 мг-экв/л (2)
= 2,0 мг-экв/л (2)
2)
 = 2,0 мл(объем кислоты, израсходованной
на титрование)
= 2,0 мл(объем кислоты, израсходованной
на титрование)
 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
 =
=
 =
= = 2,0 мг-экв/л (2)
= 2,0 мг-экв/л (2)
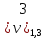 = 2,0 мл(объем кислоты,
израсходованной на титрование)
= 2,0 мл(объем кислоты,
израсходованной на титрование)
 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора кислоты)
 =
=
 =
= = 2,0 мг-экв/л (2)
= 2,0 мг-экв/л (2)
Рассчитываем среднюю общую щелочность
 =
=
 = 2,0 мг-экв/л
= 2,0 мг-экв/л
3.13.3 Определение общей жесткости воды
В коническую колбу наливаем 100 мл испытуемой воды. При этом суммарное содержание ионов кальция и магния во взятом объеме воды не должно превышать 0,5 ммоль. Затем прибавляем 5 мл буферного раствора, 0,1 г сухой смеси индикатора хромогена черного с сухим хлористым натрием и сразу же титруем при сильном взбалтывании 0,05 н. раствором трилона Б до изменения окраски в эквивалентной точке.
Окраску получили
синею. Появление этого окрашивания
свидетельствует об отсутствии ионов
 и
и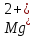 в растворе, т.е. о полном связывании их
с трилоном Б.
в растворе, т.е. о полном связывании их
с трилоном Б.
 = 10,7 мл
= 10,7 мл
Так как на титрование ушло более 10 мл, то берем воду меньшего объема 50 мл и повторяем опыт заново.
 = 5,6 мл;
= 5,6 мл;
 = 5,6 мл
= 5,6 мл
Общую жесткость воды вычисляют по уравнению (3)
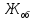 =
=

К – поправочный коэффициент к нормальной концентрации раствора трилона Б
 –количество
трилона Б, израсходованное на титрование
пробы
–количество
трилона Б, израсходованное на титрование
пробы
 –объем воды,
взятой для определения общей жесткости
–объем воды,
взятой для определения общей жесткости
 =
=
 = 5,136 мг-экв/л
= 5,136 мг-экв/л
 =
=
 = 5,376 мг-экв/л
= 5,376 мг-экв/л
 =
=
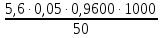 = 5,376 мг-экв/л
= 5,376 мг-экв/л
Рассчитываем относительную погрешность
 =
=
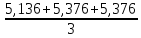 = 5,296
= 5,296
ᵟ
=
 · 100%= 6,04%
· 100%= 6,04%
3.13.4 Определение рН воды с помощью стеклянного электрода
Промыть электроды и стакан для пробы дистиллированной водой. Налить в стакан для пробы исследуемый раствор. Включить прибор рН-метр. На потенциометре установить температуру раствора. Переключить mV/pH, установить в положение «рН». При помощи держателя погрузить электроды в стакан с исследуемым раствором. Запишем установившееся значение рН.
t = 24,20C
pH = 6,75
3.14 Определение показателей качества водопроводной воды с калием сернокислым кислым khso4
3.14.1 Определение общей кислотности воды
Растворяем в одном литре водопроводной воды 60 мг калий сернокислый кислый KHSO4. Растворяем в одном литре водопроводной воды 60 мг калия сернокислого кислого KHSO4 . В коническую колбу емкостью 250 мл отмеряем пипеткой 100 мл исследуемой воды, прибавляем 3 капли фенолфталеина. Пробу титруем раствором щелочи до появления слабо-розовой окраски, не исчезающей в течение 1-2 минут. Проводим три параллельных титрования.
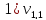 = 0,9 мл(объем щелочи,
израсходованной на титрование)
= 0,9 мл(объем щелочи,
израсходованной на титрование)
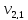 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора щелочи)
 =
=
 =
= = 0,9 мг-экв/л (1)
= 0,9 мг-экв/л (1)
 = 0,8 мл(объем щелочи,
израсходованной на титрование)
= 0,8 мл(объем щелочи,
израсходованной на титрование)
 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора щелочи)
 =
=
 =
= = 0,8 мг-экв/л (1)
= 0,8 мг-экв/л (1)
 = 0,9 мл(объем щелочи,
израсходованной на титрование)
= 0,9 мл(объем щелочи,
израсходованной на титрование)
 = 100 мл (объем воды,
взятой для исследования)
= 100 мл (объем воды,
взятой для исследования)
Н = 0,1 (нормальная концентрация рабочего раствора щелочи)
 =
=
 =
= = 0,9 мг-экв/л (1)
= 0,9 мг-экв/л (1)
Рассчитываем среднюю общую кислотность
 =
=
 = 0,87 мг-экв/л
= 0,87 мг-экв/л
