
Теплообмен двух тел
.docxНациональный исследовательский ядерный университет
«МИФИ»
Курсовая работа по неравновесной термодинамике
тема: теплообмен двух тел
Студента группы Ф5-13Б
Литвинова Дмитрия
Москва 2013
Цель работы: имеется изолированная термодинамическая система, состоящая из двух твёрдых тел с различными температурами, между которыми происходит теплообмен. Используя закономерности и свойства термодинамики решить поставленные задачи.
Выполненные задания
Задание №1. Определить изменения внутренней энергии каждого из тел dUА и dUБ в процессе теплообмена.
Согласно первому началу термодинамики dU = δQ - δL . В случае теплообмена между двумя твёрдыми телами работы не совершается, поэтому δL=0.
dUА = - kF(TА - TБ)dt,
dUБ = kF(TА - TБ)dt.
Задание №2. Используя определение интегральной теплоёмкости каждого из тел СА и СБ, сформулировать систему уравнений, описывающих изменение температуры тел во времени.
По определению:
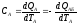
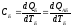
по
закону теплообмена
dQАБ
= kF(TА
- TБ)dt
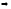
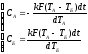
Задание №3. Решить систему уравнений и построить графики изменения температуры тел во времени для случаев СА = СБ и СБ >> СА.
в
пункте 2 была получена система:
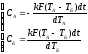
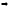

Теперь найдем
решение системы из двух дифференциальных
неоднородных уравнений.
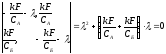
возможны собственных значения:
-
λ1 =0;
-
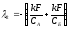 ,
,
Тогда:
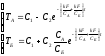
при
t=0:
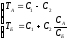
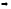
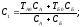
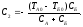
Общее
решение системы:
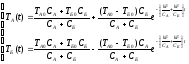
ниже приведены схематические графики зависимости температур тел А и Б от времени:
 ,
если СА =
СБ,
то
,
если СА =
СБ,
то
если СБ >> СА ,то равновесная температура будет ближе к начальной температуре тела Б, чем к температуре тела А.
Задание №4. Определить характерный интервал времени (период релаксации) уменьшения разности температур тел.
За
время, равное периоду релаксации,
разность температур двух тел уменьшится
в e
раз
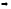
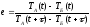
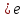

Задание №6. Получите выражение для изменения энтропии (производства энтропии) системы двух тел в процессе теплообмена.
Поскольку система изолированная, то U=U₁+U₂=const. Так как работа не производится, то -
-dU₁=-T₁dS₁= T₂dS₂
dS=
dS₁+dS₂
=
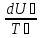 -
-
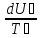 = dQ₁₂(
= dQ₁₂(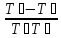 )
)
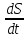 =
=
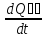 (
(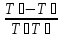 )
=
)
=
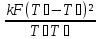
Задание №7. Определить выражение для измения энтропии системы двух тел с сильно различающейся теплоемкостью.
 ;
;
 изменяется по закону
изменяется по закону
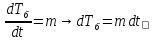
dS=
dS₁+dS₂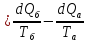 ;
где
;
где
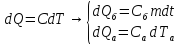
dS=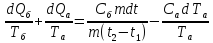
S=
Задание №10. Сформулируйте второе начало термодинамики и поясните физический смысл энтропии.
Второе
начало термодинамики:
существует такая функция состояния,
называемая энтропией, полный дифференциал
которой есть отношение количества
теплоты, получаемой системой, к ее
абсолютной температуре:
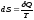
Энтропия связана с числом микросостояний системы, соответствующих макросостоянию, энтропия которого равна S.
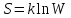
k- постоянная Больцмана,W- число микросостояний.
Задание №12. Обсудите взаимосвязь энтропии системы из двух тел и времени. В чем причина роста энтропии системы?
Изучение времени как объекта науки требует особого внимания к понятиям, несущим в себе факторы необратимости. На само явление необратимости хода времени существует много точек зрения. Прежде всего, это проблема логического определения эффекта необратимости. В этой связи очень важно изучать те свойства физического мира, которые имеют асимметрию относительно знака приращения времени. Одним из таких свойств природных процессов является энтропия.
Энтропия — это мера структурированности системы, и она же играет роль параметризации времени для природных процессов.
В изолированной неравновесной системе энтропия возрастает с течением времени, достигая максимального значения в состоянии термодинамического равновесия. Следовательно, процесс установления термодинамического равновесия можно считать необратимым, а энтропию мерой этого процесса.
Задание №15.
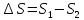 =
=
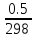 –
–
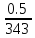 =
2.2*
=
2.2*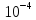
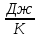
Ответ:
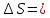 2.2*
2.2*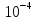
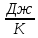
Заключение
В данной работе был решен ряд поставленных задач по неравновесной термодинамике. При решении были учтены свойства энтропии и теплообмена (закон Ньютона – Рихмана: dQАБ = kF(TА - TБ)dt, где F - поверхность теплообмена (м2), k - коэффициент теплопередачи (Вт/м2K)) системы двух тел. Считалось также, что теплообменом с окружающей средой можно пренебречь . Выражения и зависимости, полученные в ходе решения, помогают понять процессы, происходящие при теплообмене между двумя твёрдыми телами.
Что же касается вопроса о взаимосвязи энтропии и времени, то в ходе ответа использовался реферат доклада А. П. Левича "Энтропия как мера структурированности систем и энтропийная параметризация времени" , а также реферат доклада В. В. Аристова "Понятие энтропии в реляционной статистической модели времени".Тезисы этих докладов легли в основу ответа на вопрос в задании №12.
