
ХИМИЧЕСКАЯ КИНЕТИКА
Скорость химической реакции
Химическая кинетика — раздел химии, изучающий скорость химических реакций, механизмы их протекания и факторы, влияющие на скорость.
Химическая кинетика подробно изучается в курсе физической химии. Мы рассматриваем только те представления и понятия, без которых нельзя правильно понять такие вещи как «Химическое равновесие», «Энергетика химических реакций», а также многие свойства химических элементов и их соединений.
Все химические реакции, подобно физическим, биологическим, геологическим и любым другим природным процессам, протекают во времени. Химическая кинетика изучает и очень быстрые, такие, как взрывы, и очень медленные реакции, такие, как геохимическое формирование земных пород. Это возможно потому, что все химические реакции подчиняются общим законам.
Реакции делятся на гомогенные и гетерогенные. Гомогенные реакции протекают равномерно во всем объеме жидкого раствора или газовой смеси. Гетерогенные реакции осуществляются на поверхности твердого вещества, взаимодействующего с жидкостью или газом, или на поверхности жидкости, реагирующей с газом.
Чтобы понять, что такое скорость химической реакции, рассмотрим, например, газовую смесь, состоящую из равных объемов водорода и паров иода, помещенную при температуре 723,15 К (450 °С) и давлении 101,3 кПа в герметично закрытый сосуд. Пары иода окрашивают смесь в фиолетовый цвет. Наблюдая за этой смесью, можно заметить ослабление фиолетовой окраски, что свидетельствует о протекании гомогенной реакции:
Н2 + I2 → 2НI
бесцветный фиолетовый бесцветный
Интенсивность окраски смеси тем меньше, чем меньше содержащееся в ней количество иода. Следовательно, о скорости реакции можно судить по изменению количества вещества реагента или продукта реакции.
Скорость химической реакции — это количество вещества реагента, вступившего в реакиию за единицу времени, или количество вещества продукта, образовавшегося за единицу времени, в единице объема при гомогенной реакции или на единице поверхности при гетерогенной реакции.
Отношение количества
вещества (моль) к единице объема (л) —
это не что иное,
как молярная концентрация вещества,
поэтому скорость гомогенной реакции
обычно характеризуют изменением
концентрации вещества-реагента или
вещества-продукта за единицу времени
при постоянном объеме системы. Установив
зависимость
интенсивности окраски от концентрации
иода, можно .проследить за изменением
его концентрации во времени (рис.
3.1). Зная концентрации иода с1(I2)
в момент
времени t1
и с2(I2)
в момент времени t2,
можно найти
среднее значение скорости
реакции ![]() по одному
из реагентов, иоду, за отрезок времени
Δt=t2-t1:
по одному
из реагентов, иоду, за отрезок времени
Δt=t2-t1:
![]() (I2)
= [c2(I2)-c1(I2)]
/ [t2-t1]
= Δc(I2)/Δt
(I2)
= [c2(I2)-c1(I2)]
/ [t2-t1]
= Δc(I2)/Δt
-

Рмс. 3.1. Изменение концентра- Рис. 3.2. Изменение концентра ций реагента с(I2) в зависимости ции продукта реакции с(HI) в за- от времени t реакции висимости от времени реакции t
Так как по мере протекания реакции концентрации реагентов убывают, т. е. с2(I2) меньше, чем с1(I2) (см. рис. 3.1), то их разность Δс(I2) — отрицательная величина. Поэтому отношение Δс(I2)/Δt также оказывается отрицательной величиной (Δt — величина всегда положительная). Чтобы средняя скорость реакции по реагенту имела положительное значение, это отношение в уравнении (3.1) взято со знаком минус,
Если существует возможность следить за изменением концентрации продукта реакции — иодоводорода (рис. 3.2), то среднюю скорость можно вычислить следующим образом:
![]() (HI)
= [c2(HI)-c1(HI)]/[t2-t1]
= Δc(HI)/Δt
(HI)
= [c2(HI)-c1(HI)]/[t2-t1]
= Δc(HI)/Δt
где c1(HI) и c2(HI)— концентрации продукта реакции в моменты времени t1 и t2 соответственно.
Из рис. 3.1 и 3.2 видно,
что в начале реакции концентрации
веществ изменяются
быстро, затем эти изменения замедляются
и, наконец,
прекращаются совсем. (Неполное превращение
иода и водорода
в иодоводород и установление постоянных
концентраций
всех компонентов реакционной смеси
объясняются достижением
химического равновесия, которое будет
рассмотрено далее.
Следовательно, среднее значение скорости
зависит от того, в какой части кривой
выбран промежуток времени Δt
= t2
- t1
и насколько
он велик. Чем меньше Δt,
тем меньше различие между
средней скоростью и истинным (мгновенным)
значением скорости в данный момент
времени. Мгновенное значение скорости
![]() может быть
вычислено как предел, к которому
стремится
средняя скорость при Δt
→ 0, т. е. как первая производная от
концентрации
по времени. Истинная скорость по реагенту
(иоду):
может быть
вычислено как предел, к которому
стремится
средняя скорость при Δt
→ 0, т. е. как первая производная от
концентрации
по времени. Истинная скорость по реагенту
(иоду):

Графически истинную скорость можно определить как тангенс угла наклона α касательной к кривой, изображающей зависимость концентрации от времени, при данном времени ti.
Главные факторы, определяющие скорость реакций, — это природа реагентов, наличие катализаторов, концентрации реагентов, температура.
Очень важным фактором является химическая природа реагентов. Именно из-за химического разнообразия веществ одни реакции идут медленно, а другие — очень быстро. Зависимости скоростей от природы реагентов — это специальная, очень обширная область физической химии и химической физики. Зависимость скорости химической реакции от концентраций реагентов, температуры и наличия катализатора рассматривается далее.

Закон действующих масс для элементарной стадии химической реакции
В большинстве химических реакций превращение реагентов в продукты происходит не непосредственно, а через ряд промежуточных стадий, которые называют элементарными стадиями.
Механизмом химической реакции называют полную последовательность всех ее элементарных стадий.
Например, уравнение реакции синтеза иодоводорода
Н2 + I2→2НI
отражает лишь стехиометрию реакции, но не ее механизм. Экспериментальными исследованиями доказано, что она протекает в четыре стадии. Из них первая — это быстрая стадия диссоциации молекулы иода на свободные атомы:
I2 быстро → 2I
Вторая стадия — взаимодействие молекулы водорода с атомом иода — также является быстрой. На этой стадии образуется промежуточное соединение Н2I:
H2+I быстро → I H
H
Третья, медленная стадия проходит с образованием активированного комплекса
I H + I медленно → I H
H H I
Активированный комплекс — неустойчивое соединение нескольких частиц (молекул, атомов), которое возникает в какой-либо элементарной стадии в результате столкновения и взаимодействия этих частиц. (Менее прочные, чем в обычных стабильных молекулах, химические связи в активированном комплексе обозначены не сплошной чертой, а штрихами.) Четвертая стадия — распад неустойчивого активированного комплекса приводит к образованию продуктов данной элементарной стадии:
I H очень медленно→ 2HI
H I
Чаще всего в элементарной стадии принимают участие две частицы (молекулы, атомы, ионы, радикалы), возможны стадии, состоящие в превращении одной частицы (например, распад или переход из одной изомерной формы в другую). Вероятность одновременного столкновения трех частиц мала, поэтому элементарные стадии с участием трех частиц редки, а с участием четырех и более частиц не известны.
Для любой элементарной стадии справедлив закон действующих масс, установленный в 1864—1867 гг. К. Гульдбергом и П. Вааге.
Скорость элементарной стадии химической реакции прямо пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции для этой элементарной стадии.
Для элементарной стадии, где реагентами являются произвольные вещества А и В и которая описывается химическим уравнением со стехиометрическими коэффициентами а и Ь
аА + ЬВ → Продукты реакции
закон действующих масс можно описать следующим образом:
![]() =
kca(A)cb(B)
=
kca(A)cb(B)
Коэффициент пропорциональности k называют константой скорости химической реакции. Константа скорости численно равна скорости реакции, если концентрации всех реагирующих веществ равны 1 моль/л, и зависит от природы реагирующих веществ, температуры и присутствия катализатора.
Очень редки простые одностадийные реакции, механизм которых описывается их стехиометрическим уравнением. Для расчета скорости таких реакций можно использовать уравнение закона действующих масс, в которое входят стехиометрические коэффициенты реакции. Например, скорость одностадийной реакции
2NO2 → N2O4
может быть рассчитана по уравнению
![]() =
kc2(NO2)
=
kc2(NO2)
Большинство химических реакций протекает в несколько элементарных стадий. Если одна из стадий протекает намного медленнее, чем другие, то она будет лимитирующей, определяющей скорость всей реакции в целом. В этом случае скорость суммарной реакции будет описываться уравнением закона действующих масс для лимитирующей стадии. Для реакции образования иодоводорода лимитирующей является медленная третья стадия
Н2I + I → IH2I
Для нее закон действующих масс записывается так:
![]() =
kc
(Н2I)c
(I)
=
kc
(Н2I)c
(I)
Зависимость скорости реакции от температуры
Скорость химической реакции с ростом температуры всегда увеличивается. При небольшом изменении температуры достаточно точным является правило Вант-Гоффа.
Повышение температуры на каждые 10° увеличивает скорость реакции в 2 — 4 раза:
ʋT+ΔT/ ʋT = kT+ΔT/kT = γΔT/10
где ʋT — скорость реакции при исходной температуре T; kT -константа скорости реакции при исходной температуре T; ʋT+ΔT - скорость реакции при повышенной температуре T+ΔT; kT+ΔT — константа скорости реакции при повышенной температуре T+ΔT; γ — температурный коэффициент скорости реакции, принимающий значения от 2 до 4.
В широком интервале температур применимо уравнение Аррениуса:
k=Ae--E/RT
где k — константа скорости реакции; А и Е — постоянные, е — основание натурального логарифма; R — универсальная газовая постоянная; Т — абсолютная температура.
Уравнение Аррениуса позволяет вычислить константу скорости реальных газовых реакций. Чтобы произошло взаимодействие частиц (молекул, атомов, радикалов), они должны столкнуться. За 1 секунду каждая молекула газа испытывает при нормальных условиях десятки миллионов столкновений. Казалось бы, все реакции в газах должны происходить мгновенно. На самом деле это не так, скорость реальных реакций в 1010 — 1029 раз меньше той, которую они должны были бы иметь, если бы все столкновения частиц приводили к их химическому взаимодействию.
Для химического взаимодействия необходимо не любое столкновение, а только геометрически удачное. Множитель А в уравнении Аррениуса характеризует число столкновений, в которых молекулы имеют нужную для взаимодействия взаимную ориентацию. Что такое геометрически удачное столкновение, можно представить себе, если рассмотреть еще раз третью стадию реакции синтеза иодоводорода. Удар свободного атома иода по тому атому водорода частицы Н2I, который не связан с атомом иода, геометрически удачен. В результате него образуется активированный комплекс:
I H → I H
H ← I H I
Удары атома иода по другим атомам частицы Н21 не приводят к образованию активированного комплекса. Если происходит столкновение свободного атома иода и атома иода, входящего в состав частицы Н2I, то последняя разрушается:
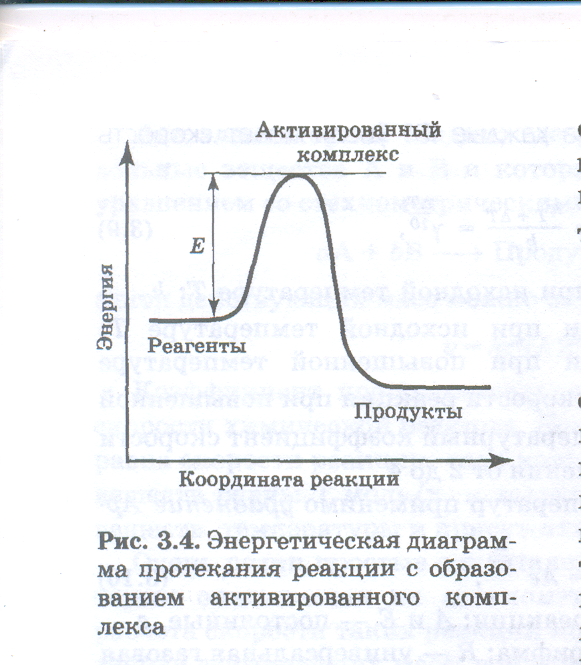
Однако не все геометрически удачные столкновения приводят к химическому взаимодействию столкнувшихся частиц. Даже при благоприятной взаимной ориентации они испытывают химическое превращение только в том случае, если кинетическая энергия столкновения достаточно велика. Чтобы столкнувшиеся молекулы могли образовывать активированный комплекс, кинетическая энергия столкновения должна равняться энергии активации или превышать ее.
Энергия активации — минимальная энергия реагентов, достаточная для того, чтобы они вступили в химическую реакцию.
Активированный комплекс представляет собой неустойчивое образование с максимальной потенциальной энергией, в котором ослаблены и удлинены химические связи, разрываемые в ходе данной реакции. Ослабление и удлинение связей требует затраты энергии. Эти затраты покрываются за счет кинетической энергии столкновения молекул реагентов, которая превращается в потенциальную энергию растяжения связей в активированном комплексе. Ход реакции можно иллюстрировать энергетической схемой, которую часто называют диаграммой преодоления энергетического барьера (рис. 3.4). Высота этого барьера Е — энергия активации. Множитель e--E/RT в уравнении Аррениуса равен доле столкновений, энергия которых при данной температуре превышает энергию активации. Итак, для осуществления химического превращения молекулы должны столкнуться, имея нужную ориентацию и обладая достаточной кинетической энергией.
Катализ
Катализ играет огромную роль в биохимии и химическом производстве.
Катализ - - это изменение скорости химических реакций под воздействием вешеств, количество и природа которых после завершения реакции остаются такими же, как и до реакции.
Катализатор — нерасходуемый реагент, увеличивающий скорость реакции. В отличие от катализаторов ингибиторы -вещества, препятствующие протеканию реакции, они расходуются в ходе реакции. Катализ бывает гомогенным и гетерогенным. При гомогенном катализе катализатор вместе с реагентами образует раствор. Гетерогенный катализ происходит на поверхности твердого катализатора, а реагирующие вещества входят в состав газовой смеси или жидкого раствора.
Любые каталитические реакции обладают общими для них особенностями.
Катализатор не оказывает влияния на глубину протекания реакции, т. е. на ее равновесие и константу равновесия (см. гл. 4). Он лишь ускоряет реакцию.
Катализаторы по своему действию селективны, т. е. избирательны. Они ускоряют только одну или две-три из большого числа возможных реакций. Например, из этилового спирта можно получить следующие продукты: уксусный альдегид, этилуксусный эфир, бутадиен, ацетон, ацетилен, но каждая из реакций превращения этилового спирта проходит только в присутствии «своего» специфического катализатора.
Ускоряющая роль катализатора объясняется тем, что ктивированный комплекс, образованный с участием катализатора, имеет более низкую энергию активации, чем активированный комплекс, возникающий в отсутствие катализатора (рис. 3.5). Скорость реакции в присутствии катализатора пропорциональна концентрации (гомогенный катализ) или поверхности (гетерогенный катализ) катализатора.
Почти все биохимические реакции в клетках животных и растений проходят с участием ферментов.
Ферменты — белки, которые катализируют химические реакции в биологических системах.

Другое название ферментов — энзимы. В природе известны десятки тысяч ферментов. Строение многих из них сходно для растительных и животных клеток, для высших и простейших организмов. От прочих катализаторов они отличаются весьма сложным молекулярным строением, эффективностью, специфичностью и чувствительностью к внешним условиям.
Молекула фермента обычно представляет собой клубок из больших белковых цепей — глобулу. На поверхности глобулы или в особом углублении располагается сравнительно небольшой по размерам участок — активный центр, который выполняет две функции: распознавание и катализ. Распознавание субстрата — вещества, на которое способен воздействовать данный фермент, — осуществляется за счет точного соответствия между формами и размерами молекулы субстрата и активного центра, как у ключа в замке. Благодаря такому соответствию многие ферменты проявляют высокую специфичность — способность катализировать превращение только одного вещества. Подошедшая из раствора к глобуле фермента молекула субстрата связывается и ориентируется ферментом таким образом, чтобы активный центр мог осуществлять превращение субстрата. Эффективность* т. е. большая ускоряющая способность фермента объясняется тем, что фермент и субстрат образуют активированный комплекс с небольшой энергией активации. Благодаря этому скорости ферментативных реакций в 109—1012 раз выше, чем у обычных, неферментативных превращений. Часто для осуществления каталитического действия активного центра бывают необходимы коферменты — небольшие небелковые молекулы или катионы металлов калия, магния, марганца, меди, железа и никеля Коферменты входят в состав образующегося в активном центре активированного комплекса с субстратом.
Действие ферментов в существенной степени зависит от состава раствора, в том числе от кислотности среды. Для каждого фермента существует оптимальная температура, при которой он в наибольшей степени проявляет свою каталитическую активность (рис. 3.6). Вплоть до

достижения этой температуры скорости ферментативных реакций возрастают в соответствии с уравнением Аррениуса. Причем числовое значение температурного коэффициента γ для таких реакций может быть значительно большим, чем предсказываемое правилом Вант-Гоффа. Для большинства ферментов оптимальная температура находится в пределах от 40 до 50 °С. При более высоких температурах ферменты теряют свою активность, вследствие тепловой денатурации их белковая часть свертывается подобно тому, как свертывается при варке белок куриного яйца.
