
- •1.Гидросульфиты.
- •Расчет по изобарно-изотермическому потенциалу.
- •Для описания ковалентной связи существуют два основных метода: метод валентных связей (мвс) и метод молекулярных орбиталей (ммо).
- •1.Азот.
- •Оксид азота(III) n2o3.
- •Оксид азота(V) n2o5.
- •Азотистая кислота hno2.
- •Фосфорноватистая (гипофосфористая) кислота н3po2.
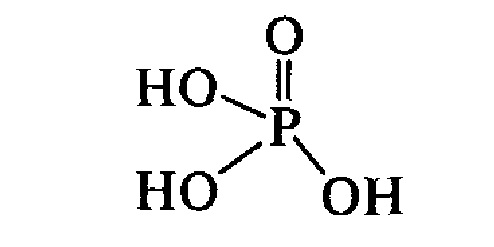
- •Ортофосфорная н3рo4 и ее соли.
- •3. . Координационные соединения. Основные понятия, строение.
Фосфорноватистая (гипофосфористая) кислота н3po2.
Фосфорноватистая
кислота является одноосновной кислотой
средней силы. Фосфорноватистая кислота
и ее соли являются очень сильными
восстановителями. Все гипофосфиты
хорошо растворимы в воде, однако соли
переходных металлов практически
мгновенно разлагаются. 
Фосфористая
кислота Н3PO3
и ее соли. В
свободном виде фосфористая кислота
представляет собой бесцветные кристаллы,
хорошо растворимые в воде и спирте. В
водных растворах она диссоциирует по
двум ступеням, что соответствует
образованию двух рядов солей: средних
(фосфитов) Na2HPO3
и кислых (гидрофосфитов) NaH2PO3.
Фосфористая кислота является хорошим
восстановителем, хотя и менее сильным,
чем фосфорноватистая кислота. Подобно
фосфорноватистой кислоте, Н3РO3
легко обесцвечивает раствор перманганата
калия: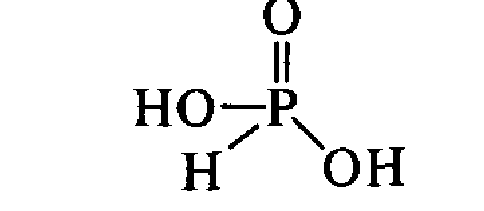
5Н3РO3 + 2KMnO4 + 3H2SO4 = 5Н33РO4 + 2MnSO4 + K2SO4 + 3H2O
Ортофосфорная н3рo4 и ее соли.
В
водных растворах ортофосфорная кислота
диссоциирует по трем ступеням, образуя
три ряда солей: средние Na3PO4
и кислые — гидрофосфаты Na2HPO4
и дигидрофосфаты NaH2PO4.
Фосфорную кислоту получают из фосфата:
![]()
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
![]()
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. В ряду Н3РO4— Н3РO3— Н3РO2 сила кислот возрастает
Общая формула линейных полифосфорных кислот Нn+2PnO3n+1, где 1 < n < ∞.
Первый простейший представитель — пирофосфорная кислота Н4Р2O7. Она может быть получена дегидратацией Н3РO4.
При
нагревании Н4Р2O7
происходит дальнейшая конденсация. В
конце концов по мере увеличения длины
цепей и образуется полиметафосфорная
кислота,
представляющая собой линейный полимер
(НРO3)n.
Ее отличают от других фосфорных кислот
благодаря способности свертывать белок.
|
Реагенты |
H3PO4 |
H4P2O7 |
(HPO3)n |
|
AgNO3 |
Желтый осадок |
Белый осадок |
Белый осадок |
|
Раствор белка |
Не реагирует |
Не реагирует |
свертывание |
-
Кристаллический бор химически инертен. С кислородом он реагирует лишь около 750 °С с образованием оксида В2O3. Кипящие концентрированные растворы HF, HC1 и NaOH на него не действуют. Аморфный бор химически более активен и медленно окисляется горячими концентрированными HNO3, H2SO4:
В + 3HNO3 = Н3ВO3 + 3NO2
в присутствии окислителя — и с щелочами:
4В + 4NaOH + 3O2 = 4NaBO2 + 2Н2O
Гидриды бора.
Бораны — ядовитые, неустойчивые молекулярные соединения с крайне неприятным запахом, хорошо растворимые в органических растворителях. Бораны химически активны, легко окисляются на воздухе и разлагаются водой. Моноборан ВН3 неустойчив. Из-за наличия трех связей В—Н и четырех орбиталей атом бора в ВН3 координационно ненасыщен, и молекула ВН3 легко присоединяет молекулы или ионы с неподеленными электронными парами, например молекулу аммиака. Хлорирование боранов приводит к разрыву связи В—В: В2Н6 + 6С12 = 2ВС13 + 6НС1
На воздухе диборан легко воспламеняется: В2Н6 + 3O2=В2O3 + ЗН2O
Боридов металлов:
При взаимодействии бора с металлами образуются разнообразные бориды, в которых бор проявляет формально отрицательные степени окисления. Бориды — исключительно твердые, химически инертные, огнеупорные материалы с температурой плавления и электропроводностью, часто превышающими аналогичные свойства исходных металлов.
Галогениды бора.
Известны четыре высших галогенида бора. Все они состоят из молекул ВХ3, имеющих форму правильного треугольника, в центре которого расположен атом бора. В ряду галогенидов бора от фторида к иодиду межмолекулярные взаимодействия усиливаются, благодаря чему растут температуры плавления и кипения. При обычных условиях BF3 и ВС13 — газы, ВВг3 — жидкость, а ВI3 — летучее твердое вещество.
Трифторид BF3 получают фторированием боратов:
6CaF2+ Na2B4O7+ 8H2SO4 = 4BF3 + 2NaHSO4 + 6CaSO4+ 7H2O
борной кислоты или ее ангидрида,
a BC13 и ВВг3 — прямым синтезом, галогенированием смеси оксида бора с углеродной сажей: В2O3 + ЗС + ЗС12 ( Вr2) = ЗСО + 2ВС13 (ВВr3)
или пропусканием трифторида бора над галогенидом алюминия:
А1Вr3 + BF3 = ВВr3 + A1F3
Кислотность соединений ВХ3 проявляется и в их склонности к гидролизу. Хлорид,
бромид и иодид дымят на влажном воздухе, а водой мгновенно разлагаются:
ВХ3 + ЗН2O = Н3ВO3 + ЗНХ (X = С1, Вr, I)
Фторид медленно взаимодействует с водой:
4BF3 + ЗН2O = H3BO3 + 3HBF4
Нитрид бора BN. подобно углероду существует в виде гексагональной (подобной
графиту) и кубической (подобной алмазу) модификаций. Первая из них — «белый графит» — получается при взаимодействии оксида с аммиаком:
В2O3 + 2NH3 = 2BN + ЗН2O
Графитоподобный BN бесцветен, не проводит электрический ток и химически более инертен, чем графит. При высоких температурах и давлении «белый графит» превращается в алмазоподобный BN, называемый боразоном. Боразон по твердости аналогичен алмазу, но химически более стоек. Боразон — важнейший абразивный материал, режет алмаз.
При нагревании диборана В2Н6 с аммиаком:
ЗВ2Н6 + 6NH3 = 2B3N3H6 + 12H2
образуется боразол B3N3H6 — бесцветная летучая жидкость. Боразол изоэлектронен бензолу. Реакционная способность боразол а гораздо выше, чем бензола. Он разлагается
при нагревании на воздухе, в воде и при действии кислот, используется как промежуточный продукт при синтезе боразона.
Оксид бора В2O3.
Получают окислением бора кислородом: 4В + 3O2 = 2В2O3
или тщательным обезвоживанием расплавленной Н3BO3: 2Н3BO3 = В2O3+ ЗН2O
В расплавленном В2O3 легко растворяются оксиды многих металлов, что используют для получения окрашенных стекол. Летучесть В2O3 значительно повышается в присутствии водяных паров из-за образования летучей метаборной кислоты:
В2O3(тв.) + Н20(г.) = 2НВO2(г.)
При повышенных температурах В2O3 восстанавливается до бора щелочными металлами, магнием, алюминием, а также углеродом. Аморфный В2O3 растворяется в воде с заметным разогреванием, превращаясь в смесь борных кислот.
Борная кислота Н3ВO3 ( B(OH)3).
Борная кислота представляет собой жирные на ощупь чешуйчатые кристаллы. Н3BO3
растворяется в воде и является слабой одноосновной кислотой. В отличие от обычных кислот ее кислотные свойства обусловлены не отщеплением иона водорода, а присоединением гидроксильной группы молекулы воды. Кислотные свойства Н3BO3 проявляются в том, что в присутствии концентрированной H2SO4 (как водоотнимающего средства) со спиртами она образует эфиры: B(OH)3 + 3CH3OH = (CH3O)3B+3H2O
Эти эфиры летучи. Их пары при поджигании на воздухе сгорают зеленым пламенем. Эта реакция служит для качественного обнаружения соединений бора.
При нагревании борная кислота теряет воду, переходя в метабораты, а затем B2O3:
H3BO3=HBO2=B2O3
Бораты. Это соли борных кислот
Тетрабораты. Бура представляет собой бесцветные кристаллы, хорошо растворимые в воде. При 60,8 °С плавится, превращаясь в гидрат Na2[B4O5(OH)4] • ЗН2O , при 161 С полностью отдает внешнесферную воду, а при 380 "С полностью обезвоживается, образуя стеклообразный тетраборат Na2B4O7. При сплавлении с солями или оксидами металлов образует окрашенные стекла — перлы:
2Na2B4O7 + 2Co(NO3)2 = 2Co(BO2)2 + 4NaBO2 + 4NO2 + O2
-
Ионная связь.
При взаимодействии наиболее электроотрицательных атомов с наиболее электроположительными образуется связь с большой степенью полярности. Силы взаимодействия между ионами (сидящими в узлах крист. решетки) электростатические –кулоновские. Связь обусловлена электростатическими силами притяжения между разноименными зарядами.
Металлическая связь.
В узлах крист. Решетки расположены положительные ионы металла. Между ними бегают электроны, отщепившиеся от атомов при образовании ионов. Эти электроны удерживают положительные ионы.
Представления о строении твердого тела.
Особенностью строения твердого тела является существование бесконечно большого количества атомов, прочно связанных друг с другом, в отличие от дискретных молекул, из которых построены жидкости и газы. Обычно все твердые вещества разделяют на кристаллические, имеющие дальний порядок расположения частиц, и аморфные, обладающие только ближним порядком. Почти все неорганические твердые вещества являются кристаллическими. По характеру химической связи различают металлические, ионные, ковалентные и молекулярные кристаллы. Можно выделить некоторые физические свойства, характерные для каждого типа. Например, молекулярные кристаллы всегда обладают низкими температурами плавления, так как силы межмолекулярных взаимодействий, удерживающие молекулы в кристалле, достаточно слабы. С другой стороны, температуры плавления ионных кристаллов, напротив, обычно высоки.
В кристаллических веществах составляющие их частицы (атомы, молекулы или ионы) периодически правильно повторяются в трех измерениях, образуя бесконечную структуру, называемую кристаллической решеткой.
Симметрия и порядок — отличительные характеристики кристаллов. Симметричными
называют тела, состоящие из равных, одинаковых частей, которые могут совмещаться друг с другом (операции пространственного отображения объекта, при которых геометрический образ совпадает с исходным). Существует много различных элементов симметрии: плоскость, ось, центр симметрии, трансляция и другие. Трансляция — это перенесение деталей структуры параллельно самим себе вдоль какого-либо направления.
Перейдем теперь к рассмотрению кристаллической структуры реальных веществ.
Одним из наиболее распространенных подходов является их описание в приближении плотнейших шаровых упаковок (ПШУ), которое чаще всего используется для характеристики структуры металлов. В плоскости существует только один способ размещения шаров — так, чтобы каждый был окружен шестью ближайшими соседями.
гексагональная
плотнейшая упаковка (ГПУ)
кубическая плотнейшая упаковка (КПУ).
Билет № 10.
1.С металлами As, Sb, Bi взаимодействуют с образование арсенидов, стибинидов и висмутидов соответственно. Их получают нагреванием смеси пниктогена с металлом в инертной атмосфере или в запаянной ампуле. С водородом не реагируют. Мышьяк аналогично фосфору реагирует с концентрированными растворами и расплавами щелочей. Наиболее легко реакция протекает в присутствии окислителя — пероксида водорода или гипохлорита: 2As + 6NaOH + 5NaOCl = 2Na3AsO4 + 5NaCl + 3H2O
Сурьма и висмут в этих условиях с щелочами не реагируют, что позволяет отличить мышьяк от сурьмы.
Оксиды Э2O3.
Оксиды Э2O3 получают при взаимодействии простых веществ с кислородом. При движении вниз по группе кислотный характер оксидов сменяется основным: мышьяка(III) проявляют кислотные свойства, сурьмы(III) — амфотерные, а висмута(III) — преимущественно основные. В этом же направлении уменьшается их растворимость в воде.
|
|
Реагент |
||
|
|
HCl (разб) |
HCl (конц) |
NaOH |
|
As2O3 |
- |
AsCl3 |
NaAsO2 |
|
Sb2O3 |
SbOCl |
SbCl3 |
NaSbO2 |
|
Bi2O3 |
BiOCl |
BiCl3 |
- |
Оксиды Э2O5.
Высший оксид мышьяка является окислителем. Оксид As2O5 представляет собой белый порошок, растворимый в воде с образованием мышьяковой кислоты H3AsO4.
Высший оксид сурьмы образуется в виде гидрата при действии на SbCl5 водного раствора аммиака. Получающийся при этом желтый осадок высушивают при 380 oС. Он плохо растворяется в воде с образованием слабой сурьмяной кислоты. Влажный Sb2O5 окрашивает лакмус в красный цвет.
Высший оксид висмута в чистом виде не получен. Черно-коричневый осадок, образующийся при подкислении висмутатов, представляет собой гидрат
Bi2O5- nН2O, который разлагается при попытке его дегидратировать.
Соединения Э(III).
В ряду As—Sb—Bi с ростом радиуса атома уменьшаются кислотные и возрастают основные свойства гидроксидов Э(ОН)3: мышьяковистая кислота Н3АsО3 проявляет кислотные свойства, гидроксид сурьмы(III) амфотерен, а гидроксид висмута(III) является основанием. Строго говоря, гидроксид состава Э(ОН)3 в твердом виде известен лишь для висмута, в случае сурьмы удается выделить лишь гидратированный оксид с переменным содержанием воды Sb2O3-nH2O, в то время как Н3АsО3 существует лишь в водных растворах — при растворении As2O3 в воде. Ее соли — арсениты — образуются при взаимодействии мышьяковистого ангидрида с щелочами:
As2O3 + 6NaOH = 2Na3AsO3 + 3H2O
Гидратированный оксид сурьмы(III) Sb2O3 образуется в виде белого осадка при действии на раствор триoхлорида сурьмы содой или щелочью:
2SbCl3 + 3Na2CO3 + nH2O = Sb2O2* nH2O + 3CO2 + 6NaCl
Гидроксид висмута Bi(OH)3 является основанием. Он образуется в виде белого
осадка при действии щелочи или соды на соли висмута(III). При нагревании гидроксид легко теряет воду, превращаясь в оксид.
В целом для оксосоединений As(III), Sb(III), Bi(III) окислительные свойства не характерны, однако при движении вниз по группе они медленно возрастают. Например, мышьяковистый ангидрид в водном растворе окисляет фосфористую кислоту:
As2O3 + ЗН3РО3 = 2As + ЗН3РО4
соли сурьмы(III) — железо: 2SbCl3 + 3Fe = 2Sb + 3FeCl2
гидроксид висмута — соединения олова(II):
2Bi(OH)3 + 3Na2[Sn(OH)4] = 2Bi + 3Na2[Sn(OH)6]
Восстановительные свойства характерны в основном для As(III) и Sb(III).
Sb ст.ок. +3; более устойчива +5
As +3 более устойчивая(из за d сжатия)
Bi +3 более устойчивая ( соли сильные окислители)
Соединения Э(V).
Высшие гидроксиды мышьяка, сурьмы и висмута являются кислотами, однако в свободном виде из них известна лишь мышьяковая кислота H3AsO4. Она образуется при растворении As2O5 в воде, однако чаще ее получают окислением мышьяковистого ангидрида концентрированной азотной кислотой:
As2O3 + 4HNO3 + H2O = 2H3AsO4 + 4NO2
Сурьмяной кислотой иногда называют ее ангидрид Sb2O5, который во влажном
состоянии в незначительной степени диссоциирует. Растворением Sb2O5 в щелочи получают антимонаты. В водных растворах они существуют в форме ионов [Sb(OH6)]-
Висмутовая кислота HBiO3 неизвестна. Ее соли — висмутаты — можно получить
окислением оксида или гидроксида висмута в щелочном растворе:
Bi(OH)3 + ЗКОН + K2S2O8 = КВiO3 + 2K2SO4 + ЗН2O
либо сплавлением оксида с пероксидом натрия в атмосфере кислорода:
2Na2O2 + 2Bi2O3 + O2 = 4NaBiO3
В ряду As(V) — Sb(V) — Bi(V) окислительные свойства соединений возрастают.
Особенно сильными окислителями являются висмутаты. С иx помощью можно окислить ион Мn2+ до перманганата:
5КВiO3 + 2Mn(NO3)2 + 14HNO3 = 2KMnO4 + 5Bi(NO3)3 + 3KNO3 + 7H2O
2.Щелочноземельные металлы при нагревании в атмосфере водорода образуют соле- подобные гидриды МН2 — серые порошки, легко взаимодействующие с водой. Магний вступает в реакцию с водородом лишь при высоком давлении. При этом образуется гидрид (MgH2)n, имеющий полимерное строение. Полимерное строение имеет
и гидрид бериллия, который получают косвенным путем.
Взаимодействие
металлов второй группы с углеродом
приводит к образованию различных
продуктов. Так, бериллий образует карбид
Ве2С.
Остальные металлы образуют карбиды
состава МС2,
содержащие ион [С С]2-.
С]2-.
Бериллий не подвержен воздействию водяного пара даже при температуре красного каления. Магний реагирует с горячей водой и водяным паром:
Mg + 2Н2O = Mg(OH)2 + Н2
Ca, Sr и Ba растворяются в воде с образованием гидроксидов, которые являтся сильными основаниями
Все металлы второй группы легко растворяются в кислотах-неокислителях, но магний не реагирует с плавиковой кислотой из-за низкой растворимости MgF2. Концентрированная азотная кислота пассивирует бериллий.
Берилий
Будучи амфотерным, ВеО взаимодействует при сплавлении и с основными, и с кислотными оксидами. При нагревании ВеО взаимодействует с кислотами и щелочами.
Сульфид берилля BeS. Образуется взаимодействием простых веществ. В горячей воде полностью гидролизуется. Амфотерная природа BeS проявляется при сплавлении с основными и кислотными сульфидами.
Из галогенидов бериллия наибольшее значение имеют фторид и хлорид. Дифторид BeF2 существует в нескольких модификациях, аналогичных по структуре соответствующим модификациям диоксида кремния SiO2. Как и кремнезем, BeF2 легко переходит в стеклообразное состояние. Другие галогениды Ве(II) также полиморфны. Одна из модификаций ВеС12 имеет волокнистое строение. Галогениды ВеС11, ВеВr2 и ВеI2 гигроскопичны и на воздухе расплываются; при их растворении в воде выделяется теплота; они растворимы также в органических растворителях.
Нитрид Be3N2 — кристаллическое вещество, получается при нагревании бериллия в атмосфере азота выше 1000 oС. Бесцветен, очень тверд, тугоплавок. Разлагается водой при нагревании: Be3N2 + 6Н2O = ЗВе(ОН)2 + 2NH3
Об амфотерном характере Be3N2 свидетельствует существование двойных нитридов, например BeSiN2 и LiBeN.
Магний
Оксид магния MgO- жженая магнезия- тугоплавкое вещество. Мелкокристаллический MgO химически активен, является основным соединением. Он взаимодействует с водой, поглощает СО2, легко растворяется в кислотах. Но сильно прокаленный MgO становится очень твердым, теряет химическую активность.
Кроме оксида широкое применение находит MgCl2. Дихлорид получают хлорированием
MgO, в присутствии угля: MgO + С12 + С = MgCl2 + СО
или обезвоживанием MgCl2*6H2O, добываемого из морской воды.
Подгруппа кальция
Оксиды получают в лаборатории термическим разложением оответствующих карбонатов или нитратов:
СаСО3 = СаО + СО2; 2Ba(NO3)2 = 2ВаО + 4NO2 + О2
Высокая активность кальция и его аналогов проявляется также в их способности образовывать многочисленные перекисные соединения, например пероксиды ЭО2, надпероксиды Э(О2)2, персульфиды ЭSn (n = 2-5), перкарбиды ЭС2. В ряду Ca(II)-Sr(II)-Ba(II) устойчивость этих соединений возрастает
