
- •1.Гидросульфиты.
- •Расчет по изобарно-изотермическому потенциалу.
- •Для описания ковалентной связи существуют два основных метода: метод валентных связей (мвс) и метод молекулярных орбиталей (ммо).
- •1.Азот.
- •Оксид азота(III) n2o3.
- •Оксид азота(V) n2o5.
- •Азотистая кислота hno2.
- •Фосфорноватистая (гипофосфористая) кислота н3po2.
- •Ортофосфорная н3рo4 и ее соли.
- •3. . Координационные соединения. Основные понятия, строение.
Оксид азота(V) n2o5.
Это
вещество очень неустойчиво и в течение
нескольких часов распадается, при
нагревании — со взрывом:
2N2O5 = 4NO2 + O2
При растворении N2O5 в воде образуется азотная кислота.
Высший оксид азота является сильным окислителем, например:
N2O5 + I2 = I2O5 + N2
Азотная кислота HNO3. Азотная кислота HNO3 — одна из важнейших неорганических
кислот. Это летучая бесцветная жидкость, с резким запахом, смешивается с водой в любых пропорциях. При переливании ее на воздухе образуется туман, состоящий из мельчайших капелек азотной кислоты, поэтому чистую (100 %-ю) HNO3 называют дымящей. В лабораториях обычно используют не дымящую, а более дешевую 68 %-ю HNO3. Такую кислоту называют концентрированной. В промышленности ее получают каталитическим окислением аммиака кислородом воздуха на платиновом катализаторе:
4NH3 + 5O2=6H2O + 4NO
с последующим окислением NO: 2NO + O2 = 2NO2
и поглощением образующегося NO2 водой при избытке воздуха:
4NO2 + O2 + 2H2O = 4HNO3
Дымящая или концентрированная HNO3 при хранении на свету вскоре приобретает
бурую окраску за счет растворения оксида азота(IV), образующегося при ее разложении: 2HNO3 = 2NO2 + Н2O + l/2 O2
Такую кислоту хранят в темных склянках.
Молекулы HNO3 как в газовой, так и в жидкой и твердой фазах имеют плоское строение. Отличительной особенностью HNO3 является ее высокая окислительная способность. Азотная кислота при нагревании легко окисляет многие неметаллы: иод,
серу, уголь, фосфор, а на холоде — иодоводород, сероводород и их соли:
6HI + 2HNO3 = 3I2 + 2NO + 4Н2O
|
+HNO3 |
||
|
Разб. Конц. |
||
|
Актив. Ме (в том числе и Al, Zn, Mg) |
N2O |
N2O |
|
Сред. Актив. Ме |
NO или N2 |
NO2 |
|
Неактив. Ме (Cu,Hg, Ag) |
NO |
NO2 |
Азотистая кислота hno2.
Азотистая
кислота в чистом виде не выделена и
существует лишь в растворах, которые
получают на холоде подкислением растворов
ее солей:
Ba(NO2)2 + H2SO4 = 2HNO2 + BaSO4
Эти растворы имеют голубую окраску, они относительно устойчивы при 0 °С, а при нагревании до комнатной температуры разлагаются: 3HNO2= HNO3 + 2NO + H2O
Азотистая кислота легко диспропорционирует.
Окислительные
свойства и прочность HNO3
и HNO2
удобно сопоставить с помощью диаграммы
вольт-эквивалент — степень окисления.
Легко заметить, что значение
вольт-эквивалента HNO2
лежит выше прямой, соединяющей значения
вольт-эквивалентов NO
и HNO3.
Следовательно,
 G
реакции
диспропорционирования оказывается
меньше нуля, иными словами, HNO2
является неустойчивой кислотой и
стремится диспропорционировать на NO
и HNO3.
Кроме того, в разбавленных растворах
одинаковой концентрации (0,1 М) HNO2
оказывается
сильным окислителем, по силе превосходящим
даже HNO3.
Так,
0,05
М HNO2,
мгновенно окисляет иодид калия:
G
реакции
диспропорционирования оказывается
меньше нуля, иными словами, HNO2
является неустойчивой кислотой и
стремится диспропорционировать на NO
и HNO3.
Кроме того, в разбавленных растворах
одинаковой концентрации (0,1 М) HNO2
оказывается
сильным окислителем, по силе превосходящим
даже HNO3.
Так,
0,05
М HNO2,
мгновенно окисляет иодид калия:
2NaNO2 + 2H2SO4 + 2KI = I2 + 2NO + K2SO4 + Na2SO4 + 2H2O
а азотная кислота той же концентрации с KI не реагирует. Это следует и из диаграммы вольт-эквивалент—степень окисления. Действительно, наклон прямой, соединяющей значения вольт-эквивалентов HNO2 и NO, оказывается круче, чем в случае пары HNO3 и NO. Атом азота в HNO2 находится в промежуточной степени окисления, поэтому для азотистой кислоты и ее солей характерны не только окислительные, но и восстановительные свойства. Так, нитриты обесцвечивают подкисленный раствор перманганата калия: 5KNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5KNO3 + K2SO4 + 3H2O
Нитриты щелочных, щелочноземельных металлов и аммония — бесцветные или желтоватые кристаллические вещества, хорошо растворимые в воде и плавящиеся без разложения. Нитриты переходных металлов в воде малорастворимы, а при нагревании легко разлагаются.
Отношение нитратов металлов к нагреванию.
Ме находящиеся левее Mg (кроме Li): МеNO2+O2
Ме находящиеся между [Mg и Cu] (и Li): MeO+NO2+O2
Ме находящиеся правее Cu: Ме+NO2+O2
Азотноватистая (гипоазотистая) кислота H2N2O2. Бесцветные кристаллы. Азотноватистая кислота — слабая и очень неустойчивая. Она и ее соли проявляют восстановительные свойства. При обезвоживании H2N2O2 концентрированной H2SO4 образуется оксид азота N2O, который формально можно рассматривать как ее ангидрид.
Нитроксиловая кислота H4N2O4. В свободном виде она неустойчива.
-
Все щелочные металлы взаимодействуют с водой, выделяя водород:
2Ме+2H2O=2МеOH+H2
Эта экзотермическая реакция протекает очень быстро, натрий часто воспламеняется, а более тяжелые металлы реагируют со взрывом. Относительно низкая активность лития по отношению к воде определяется прежде всего кинетическими, а не термодинамическими причинами: литий наиболее твердый из щелочных металлов и имеет самую высокую температуру плавления, поэтому он медленнее дробится на капли и реагирует спокойнее других щелочных металлов.
Состав
продуктов, образующихся при сгорании
щелочных металлов на воздухе или в
кислороде, зависит от природы металла.
Так, литий образует оксид Li2O,
натрий — пероксид Na2O2,
калий, рубидий и цезий — супероксиды
(надпероксиды) КO2,
RbO2,
CsO2.
Все эти вещества имеют ионную
кристаллическую решетку. Пероксиды:
ст.окисл. -1, а супероксиды (надпероксиды)
ст.окисл
 .
.
Взаимодействие с серой: При сплавлении натрия с серой образуются персульфиды типа Na2S2, Na2S3, Na2S4 и Na2S5.
Li не образует полисульфидов. Остальные образуют: K2S+nS=K2Sn
Э2S гидролизуются медленно, окисляются до тиосульфатов:
2Na2S+2O2+H2O=Na2S2O3+2NaOH
Взаимодействие с водородом:
Получают: Li(расплав)+H2=2LiH
NaH,KH,Cs,Rb разлагаются при нагревании. Все гидролизуются в воде: 2LiH+2H2O=2LiOH+H2
Взаимодействие с галогенами:
LiF- малорастворим. LiCl,LiBr,LiI-гигроскопичны, образуют кристаллогидраты.
NaГ, KГ, CsГ, RbГ- хорошо растворимые соли.
Прочность связи Li-Г в ряду F, Cl, Br, I уменьшается, причина- сильное поляризующее влияние иона лития.
Взаимодействие с азотом:
Li3N синтезируется при обычных условиях. Остальные нитриды получают действием тихого электрического разряда на пары щелочных металлов в атмосфере азота. Они не устойчивы. В воде гидролизуются: Li3N+3H2O=3LiOH+NH3
Оксиды, гидроксиды, соли.
Оксиды М2O их можно получить путем дозированного окисления металлов, однако в
этом случае конечный продукт будет содержать примеси. Цвет оксида изменяется
от белого (Li2O и Na2O) к желтому (K2O, Rb2O) и оранжевому (Cs2O). Удобным способом получения оксида натрия является взаимодействие натрия с расплавленным едким натром: 2NaOH + 2Na=2Na2O + H2
Для всех щелочных металлов получены озониды МO3, в состав которых входит парамагнитный ион [O3]-. Солеобразные КO3, RbO3, CsO3 получают действием озона на пероксиды, супероксиды или гидроксиды: КO2 + O3 = КO3 + O2
Все озониды представляют собой оранжево-красные кристаллические вещества. Они чрезвычайно взрывоопасны и неустойчивы.
Пероксиды, надпероксиды и озониды щелочных металлов при нагревании pазлагаются. Их термическая устойчивость увеличивается с ростом радиуса катиона. Пероксиды, надпероксиды и озониды являются сильными окислителями:
Na2O2 + CO = Na2CO3
Гидроксиды элементов первой группы являются сильными основаниями. Они представляют собой бесцветные гигроскопичные вещества, легко расплывающиеся на воздухе и постепенно превращающиеся в карбонаты. Гидроксиды щелочных металлов прекрасно растворимы в воде.
Гидроксиды натрия, калия, рубидия и цезия плавятся без разложения, в то время как LiOH при прокаливании выделяет воду: 2LiOH = Li2O + Н2O
Взаимодействие гидроксидов щелочных металлов с кислотами и кислотными оксидами приводит к образованию солей.
Нитраты щелочных Ме при нагревании разлагаются:
4LiNO3=2Li2O+4NO2+O2
Но остальные: 2NaNO3=2NaNO2+O2
Na2CO3*10H2O – кристаллическая сода
NaHCO3 – питьевая сода (Получение- аммиачный способ, метод Сольве:
NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
2NaHCO3= Na2CO3+CO2+H2O (при нагревании)
Литий Li от остальных щелочных металлов отличает большее значение энергии ионизации и небольшой размер атома и иона. Литий по свойствам напоминает магний (диагональное сходство в периодической системе).
-
В окислительно-восстановительном процессе всегда участвуют две (сопряженные)
пары,
каждая из которых включает окислитель
и восстановитель. Процессу образования
ионов способствует увеличение энтропии
(энтропия ионов в растворе гораздо
больше, чем энтропия металла) и образование
гидратов, а препятствуют процессы
ионизации (энергия ионизации достаточно
высока) и разрушения кристаллической
решетки. В состоянии равновесия на
пластинке локализуется положительный
заряд, который компенсируется
противоионами, находящимися в растворе.
Так возникает двойной
электрический слой, характеризующийся
некоторым скачком потенциала
 который зависит от природы металла,
температуры и концентрации ионов металла
в растворе. Величину
который зависит от природы металла,
температуры и концентрации ионов металла
в растворе. Величину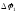 , нельзя ни измерить, ни рассчитать.
Однако, если такой полуэлемент
соединить
проводником с другим полуэлементом
(например,
, нельзя ни измерить, ни рассчитать.
Однако, если такой полуэлемент
соединить
проводником с другим полуэлементом
(например,
 то
между ними будет протекать электрический
ток, обусловленный разностью потенциалов.
Электродвижущая сила (Е)
процесса,
например реакции:
то
между ними будет протекать электрический
ток, обусловленный разностью потенциалов.
Электродвижущая сила (Е)
процесса,
например реакции:

будет равна с высокой степенью приближения разности потенциалов полуэлементов:
Е
=
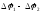 1.
1.
Вот эту величину — электродвижущую силу — измерить можно! Поэтому для характеристики полуэлементов (окислительно-восстановительных пар) используют величину ЭДС между данным полуэлементом и так называемым электродом сравнения. За электрод сравнения принят стандартный водородный электрод
2Н+(р)+2e-=H20
Условно
принято считать, что
 = 0 при давлении водорода, равном 1 атм,
= 0 при давлении водорода, равном 1 атм,
и активности Н+, равной 1. ЭДС цепи, составленной из стандартного водородного электрода и изучаемого электрода, называют электродным потенциалом последнего. Если активности (концентрации) ионов равны единице, то этот потенциал называют
стандартным (Е°). Так, для окислительно-восстановительной пары Cu2+/Cu°, при
[Си2+]
= 1
моль/л: Е
=
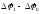 = Е°
(Cu2+/Cu°).
= Е°
(Cu2+/Cu°).
Уравнение
1. для окислительно-восстановительного
процесса в целом можно записать так:

или в более общем виде: E=Eок-Евос
где Еок — электродный потенциал пары, выступающей в качестве окислителя; Евос — электродный потенциал пары, выступающей как восстановитель.
Билет №9
Реакционная способность Р оказывается более высокой, чем азота. С металлами Р взаимодействуют с образованием фосфидов. Их получают нагреванием смеси пниктогена с металлом в инертной атмосфере или в запаянной ампуле.
Гидролиз фосфида: Mg3P2+6H2O=2PH3+3Mg(OH)2
Mg3P2+6HCl=2PH3+3MgCl2
Фосфор диспропорционирует
Р4 + 6Н2O = РН3 + ЗН3PO2
В кислой и нейтральной средах равновесие сильно смещено влево, и реакция практически не протекает. Равновесие смещается вправо под действием
щелочей: Р4 + ЗКОН + ЗH2O=PH3 + ЗКН2PO2
Фосфин образует с воздухом взрывчатые смеси, а при поджигании сгорает, превращаясь в метафосфорную кислоту: РН3 + 2O2=НРО3 + Н2O
Фосфин плохо растворим в воде. Реагирует только с очень сильными кислотами (HI, HClO4)
Алотропия фосфора.
Белый фосфор. Мягкое кристаллическое вещество с неприятным чесночным запахом, практически не растворим в воде, мало растворим в бензоле, хорошо растворим в сероуглероде. Он сильно ядовит, на воздухе горит. Имеет молекулярную решетку в узлах которой находятся тетраэдрические молекулы
P4. Высокая реакционная способность.
Красный фосфор.P∞ Образуется при нагревании белого до 320 градусов без доступа воздуха.Он не растворим в сероуглероде, но растворяется в расплавленном висмуте и свинце.
Черный фосфор. При нагревании 200 оС и давлении 1200 атм. Красный переходит в черный фосфор- термодинамически более выгодную форму. Напоминает графит.
Оксиды.
Оксиды Э2O3 получают при взаимодействии простых веществ с кислородом. Оксид фосфора(III) представляет собой белый рыхлый кристаллический порошок, легко возгоняющийся. Оксид фосфора(III) называют фосфористым ангидридом, так как он взаимодействует с холодной водой с образованием фосфористой кислоты:
Р4O6+6Н2O = 4Н3PO3
Оксиды фосфора(III) проявляют кислотные свойства
Оксиды Э2O5 (Э4О10). Оксид фосфора(V) (или фосфорный ангидрид) представляет
собой рыхлый белый порошок. Оксид фосфора(V) чрезвычайно жадно присоединяет воду. Реакция сопровождается сильным разогреванием и приводит к образованию
сложной смеси, состоящей из метафосфорных кислот разного состава, которые при кипячении гидролизуются до ортофосфорной кислоты Н3PO4.
