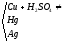- •1.Гидросульфиты.
- •Расчет по изобарно-изотермическому потенциалу.
- •Для описания ковалентной связи существуют два основных метода: метод валентных связей (мвс) и метод молекулярных орбиталей (ммо).
- •1.Азот.
- •Оксид азота(III) n2o3.
- •Оксид азота(V) n2o5.
- •Азотистая кислота hno2.
- •Фосфорноватистая (гипофосфористая) кислота н3po2.
- •Ортофосфорная н3рo4 и ее соли.
- •3. . Координационные соединения. Основные понятия, строение.
Билет №6
1.Гидросульфиты.
растворимые сульфиты сильно гидролизуются с образованием гидросульфитов:

Особенностью гидросульфитов — ионов HS03- — является таутомерия — равновесие
между двумя изомерами, способными легко переходить друг в друга:

В
изомере I атом водорода связан с атомом
серы, а в изомере II — с атомом
кислорода.



Попытки выделить гидросульфиты легких щелочных металлов при насыщении растворов их сульфитов сернистым газом приводят к получению несимметричных дисульфитов (пиросульфитов): 2MHS03 = M2S205 + H20
в которых реализуется связь —S—S—, а не —S—О—S—. В водном растворе они вновь превращаются в гидросульфиты. В твердом состоянии выделены лишь кислые сульфиты с крупными катионами (RbHS03) CsHS03), стабилизирующими гидросульфит-ион.
Оксид серы(VI)
ангидрид SO3 который производится в гигантских промышленных масштабах каталитическим окислением SO2 с целью получения серной кислоты. Он образуется также при термическом распаде сульфатов и пиросульфатов:
Na2S2O7 = Na2S04 + S03
Мономерные молекулы S03 присутствующие в газовой фазе, имеют форму
правильного
треугольника.
Серный ангидрид — одно из самых реакционноспособных соединений. Он проявляет окислительные свойства, например превращает уголь в углекислый газ: 2S03 + С = 2S02 + С02
Особенности взаимодействия SO3 с галогенводородами связаны с ростом восстановительных свойств в ряду НCl—HBr—HI. Окислительные свойства SO3 усиливаются с ростом температуры. При слабом нагревании SO3 реагирует с газообразным НСl, образуя хлорсульфоновую кислоту HSO3Cl:
SO3 + НСl = HO(Cl)SO2
При повышении температуры НСl восстанавливает SO3 до SO2 с одновременным образованием С12. При действии на НВr триоксида серы при 0 oС выделяются SO2 и свободный бром: 2SO3+ 2НВг = SO2 + Вг2+ H2SO4
Йодистым водородом SO3 восстанавливается до H2S даже при охлаждении ниже 0 °С: SO3+ 8HI = H2S+ 4I2 + 3H2O
Серный ангидрид действует как сильнейшая кислота Льюиса, образуя аддукты с трифторидами мышьяка и сурьмы: SbF3 + SO3 = SbF3(SO3)
превращает оксиды металлов в сульфаты: Fe2O3 + 3SO3 = Fe2(SO4)3
Эта реакция служит для отчистки промышленных газов от следов SO3
SO3 бурно взаимодействует с водой с выделением большого количества теплоты. Интересно, что газообразный серный ангидрид плохо поглощается водой, так как образует туман. Именно поэтому в промышленности для его поглощения используют не воду, а концентрированную серную кислоту. При этом образуется олеум, состоящий из полисерных кислот H2SnO3n+1 где n=1,2,3..
Серный ангидрид термически неустойчив. Его термическая диссоциация на SO2 и O2
начинается при 450 oC, а при 1200 oC в газовой фазе полностью отсутсвуют молекулы SO3.
Серная кислота.
Промышленное
производство серной кислоты осуществляется
способом, в основе которого лежит
окисление сернистого газа в серный
ангидрид на ванадиевом катализаторе с
последующим поглощением серного
ангидрида концентрированной серной
кислотой:

Этот метод в настоящее время почти полностью вытеснил нитрозный способ, в котором окислителем служит не кислород, а оксид азота(IV). Возможно как прямое окисление SO2 в серную кислоту: SO2 + NO2 + Н2O = H2SO4 + NO
В молекуле H2SO4 сера тетраэдрически окружена четырьмя атомами кислорода, два из которых входят в состав гидроксильных групп. Длины связей в молекуле H2SO4 таковы, что связи S—О можно считать двойными, а связи S—ОН — одинарными.
Бесцветные, похожие на лед кристаллы H2SO4 имеют слоистую структуру:
каждая молекула H2SO4 соединена с четырьмя соседними молекулами прочными
водородными связями, образуя единый пространственный каркас. Структура жидкой H2SO4 такая же, как твердой, только целостность пространственного каркаса нарушена, и его можно представить как совокупность микрокристалликов, постоянно меняющих свою форму. Серная кислота смешивается с водой в любых соотношениях, процесс сопровождается образованием различных гидратов H2SO4 *nH20.
Теплота гидратации настолько велика, что смесь может даже вскипеть, разбрызгаться и вызвать ожоги кожи и разрушение одежды. Поэтому необходимо добавлять кислоту к воде, а не наоборот, поскольку при добавлении Н20 в H2SO4 более легкая вода окажется на поверхности кислоты, где и сосредоточится вся выделяющаяся теплота. В результате может произойти вскипание и разбрызгивание. Высокое сродство серной кислоты к воде позволяет использовать ее как водоотнимающее средство. По структурным особенностям и аномалиям жидкая H2SO4 похожа на воду. Из-за высокой полярности связь Н—О легко разрывается, причем отщепление протона требует меньших энергетических затрат, чем в случае воды. Благодаря этому кислотные свойства H2SO4 выражены сильно, и при растворении в безводной H2SO4большинство соединений, традиционно считающихся кислотами (СН3СООН, HN03 и др.), ведут себя как основания.
Сульфаты.
Термическая
устойчивость сульфатов определяется
природой катиона, а состав продуктов
разложения зависит от температуры
процесса. Главными продуктами их
термической диссоциации являются оксид
металла и серный ангидрид, однако чем
выше температура разложения, тем в
большей степени SO3
распадается на сернистый газ и кислород:

Если нагревают сульфат металла в низшей степени окисления (Fe(II), Mn(II)),
то
выделяющийся серный ангидрид окисляет
металл:


Сравнение окислительных свойств серной и селеновой кислоты.
В
ряду
 наблюдается немонотонное изменение
термодинамической стабильности и
окислительной способности: селеновая
кислота и ее соли термодинамически
оказываются менее стабильными и более
сильными окислителями, чем соответствующие
кислоты и соли S(VI). Селеновая кислота
выделяет хлор из концентрированной
НС1:
наблюдается немонотонное изменение
термодинамической стабильности и
окислительной способности: селеновая
кислота и ее соли термодинамически
оказываются менее стабильными и более
сильными окислителями, чем соответствующие
кислоты и соли S(VI). Селеновая кислота
выделяет хлор из концентрированной
НС1:

растворяет без нагревания медь и даже золото:

Действие разбавленной и концентрированной серной кислоты на металлы.
|
|
H2SO4концентрированная |
H2SO4разбавленная |
|
Ме до H2 |
Искл.:
|
Реакции замещения
|
|
Ме после H2
|
|
|
Тиосерная кислота.
При
кипячении раствора сульфита натрия с
порошком серы образуется тиосульфат
натрия Na2S2O3.
Свободная
тиосерная кислота Na2S2O3
в присутствии воды распадается:

поэтому выделить ее из водных растворов невозможно. Она получена при низкотемпературном взаимодействии сухого сероводорода и безводной хлорсульфоновой кислоты без каких-либо растворителей:

В отличие от кислоты ее соли устойчивы и легко образуются при взаимодействии
растворов
кислых сульфитов и сульфидов:
ион S2O32- обладает восстановительными свойствами. Например
а
более сильными окислителями — до
сульфата:

На этом основано использование Na2S203 для удаления избытка хлора при отбеливании тканей. Тиосульфат-ион — сильный комплексообразователь, использующийся в фотографии для удаления из фотопленки невосстановленного бромида серебра:

Дитионовая
кислота, политионовые кислоты и их соли.

дитионовая H2S2O6, тритионовая и другие политионовые кислоты H2SnO6 (n= 3 — 22) Они не выделены в свободном виде, но известны в водных растворах, часто в смеси друг с другом (жидкость Вакенродера).
Кислота
H2S2O6
в
свободном виде не выделена, однако
обменным взаимодействием получены ее
достаточно концентрированные растворы:

Соли (дитионаты) синтезируют окислением водных растворов SO2 суспензиями
порошков
оксидов марганца МnO2
или железа Fe2O3:

Политионаты
можно получить взаимодействием
тиосульфатов с хлоридами серы, например:

При
нагревании политионаты разлагаются на
сульфат, сернистый газ и (если п
 3)
серу.
3)
серу.
2. Степени окисления V (2+, 3+, 4+), оксиды, соли.
Оксиды ванадия.
|
Формула оксида |
Характер оксида |
|
VO |
Основный |
|
V2O3 |
Амфотерный |
|
VO2 |
Амфотерный |
|
V2O5 |
Амфотерный |
Оксид ванадия (II) проявляет свойства основного оксида: не растворим в воде и щелочах, но медленно взаимодействует с кислотами, хорошо растворим в азотной кислоте. При нагревании на воздухе он легко окисляется до высших оксидов.
Оксид ванадия (III). По химической природе оксид V203 проявляет слабую амфотерность с существенным преобладанием основных свойств: растворяется в кислотах с образованием зеленых растворов солей V(III), но не реагирует с растворами
щелочей.
Оксид
ванадия(V).
Он
имеет желто-оранжевый цвет.
Слабо
растворим в воде.
Значительно
выше его растворимость в спирте. В
лаборатории оксид получают разложением
на воздухе метаванадата аммония:
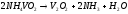
Хотя высший оксид ванадия амфотерен, кислотные свойства у него существенно преобладают, поэтому его часто называют ванадиевым ангидридом, несмотря на то что соответствующая кислота в свободном виде не выделена.
Соединения Ванадия (II). На воздухе соли ванадия(II) легко окисляются кислородом до соединений ванадия(III), (IV). Устойчивость к окислению иона V2+ усиливается в присутствии анионов, образующих с ним комплексные соединения. Водные растворы солей ванадия(II) даже при подкислении медленно разлагаются с выделением водорода.
При действии на соли ванадия(II) растворов щелочей выпадает коричневый осадок гидроксида V(OH)2.
Соединения ванадия(III). Соли ванадия(III) получают электрохимическим восстановлением солей ванадила, растворением оксида V203 в кислотах или сопропорционированием разновалентных соединений ванадия в кислой среде:
4V + 3V2O5 + 30НС1 = 10VCI3 + 15Н2O
VSO4 + VOSO4 + H2SO4 = V2(S04)3 + Н20
Ванадий(III) образует большое число комплексов: VC13 + 6KCN = K3[V(CN)6] + 3KC1
Соединения ванадия(IV).(Оксо-соль). Высокий заряд и малый радиус иона V4+ делают невозможным его присутствие в водных растворах, поэтому соединения ванадия(IV) представляют собой оксосоли. Соли ванадила получают восстановлением ванадиевого ангидрида в кислом растворе этиловым спиртом, щавелевой кислотой, соляной кислотой, сернистым газом, тиосульфатом, роданидом и др.:
V2O5 + H2SO4 + S02 = 2VOSO4 + Н2O
Соединения ванадия(V). Высшая степень окисления ванадия наиболее устойчива в щелочной среде. Ванадаты щелочных металлов хорошо растворимы в воде. Ионы меди(II) позволяют различить растворы орто- и метаванадатов. С ортованадатами они дают синевато-зеленый, а с метаванадатами — яблочно-зеленый осадок.
Соединения ниобия и тантала.
О химии водных растворов соединений ниобия и тантала известно очень мало.
3. Химическое равновесие – состояние реакционной системы, когда скорость прямой реакции = скорости обратной.
Признаки:
1.не изменяется во времени ни одна из доступных физических величин;
2.∆G=0
3.обратимость;
4.скорость прямой реакции = скорости обратной
Константа равновесия – равна отношению произведения равновесных концентраций продуктов реакций, к произведению равновесных концентраций исходных веществ, в степенях соответствующих стехиометрических коэффициентов.
Принцип Ле Шателье: если находящаяся в равновесии система подвергается внешнему воздействию, равновесие смещается в таком направлении, которое способствует ослаблению этого воздействия.
- В системе, находящейся в равновесии, нельзя изменить концентрацию какого-нибудь из реагентов, не вызывая изменения концентрации всех остальных
- Давление влияет на состояние равновесия в тех случаях, когда реакция сопровождается изменением объема системы.
- Повышение давление сдвигает равновесие в сторону реакций, идущей с уменьшением объема.
- Повышение температуры вызывает смещение равновесия в направлении того из процессов, идущего с поглощением теплоты , а понижение температуры – противоположном направлении.



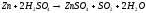
 без
нагрев-ия
без
нагрев-ия