
- •Физическая химия учебное пособие к лабораторным работам По курсУ «Физическая химия»
- •© Иркутский государственный университет
- •Содержание
- •Введение
- •1. Правила работЫ в химических лабораториях
- •1.1. Общие правила
- •1.2. Правила по технике безопасности
- •2. Основные понятия химии. Закон эквивалентов
- •2.1. Лабораторная работа № 1 «Определение эквивалентной массы магния»
- •3. Термохимия
- •3.1. Лабораторная работа № 2 «Определение теплоты нейтрализации»
- •3.2. Лабораторная работа № 3 «Тепловые эффекты реакций растворения»
- •4. Химическая кинетика
- •4.1. Лабораторная работа № 4 «Определение влияния концентрации веществ и температуры на скорость реакции и смещение равновесия»
- •4.2. Лабораторная работа № 5 «Определение влияния различных факторов на скорость химических реакций и смещение равновесия»
- •4.3. Лабораторная работа № 6 «Изучение влияния различных факторов на скорость химических реакций и смещение равновесия»
- •5. Поверхностные явления. Адсорбция
- •(А) колоночная; (б) газовая; (в) тонкослойная
- •5.1. Лабораторная работа № 7 «Изучение явления адсорбции»
- •5.2. Лабораторная работа № 8 «Адсорбция уксусной кислоты углем»
- •5.3. Лабораторная работа № 9 «Хроматографическое разделение аминокислот»
- •6. Взаимная растворимость жидкостей. Закон распределения. Экстрагирование
- •6.1. Лабораторная работа № 10 «Изучение процесса экстрагирования»
- •7. Рефрактометрия
- •7.1. Лабораторная работа № 11 «Рефрактометрическое определение массовой доли растворенного вещества в растворе»
- •7.2. Лабораторная работа № 12 «Определение строения молекулы и ее полярности по молекулярной поляризации и рефракции»
- •7.3. Лабораторная работа № 13 «Определение концентрации растворенного вещества»
- •8. Оптические методы. СветопоглОщение
- •8.1. Лабораторная работа № 14 «Фотометрическое определение содержания углерода в растворах глюкозы»
- •9. Потенциометрическое титрование
- •9.1. Лабораторная работа № 15 «Потенциометрическое определение рН растворов»
- •9.2. Лабораторная работа № 16 «Определение содержания щелочи и соды при совместном присутствии»
- •9.3. Лабораторная работа № 17 «Построение кривой титрования»
- •10. Электролиз
- •Закономерности катодных процессов
- •Закономерности анодных процессов
- •10.1. Лабораторная работа № 18 «Электролиз солей»
- •11. Коррозия металлов
- •11.1. Лабораторная работа № 19 «Коррозия металлов и методы защиты»
- •Давление насыщенного водяного пара при различных температурах
- •Показатели преломления жидкостей при 20 оС
- •Атомные рефракции rd
- •Инкрименты связей и циклов
- •Диэлектрическая проницаемость (ε) жидкостей
- •Кислотно-основные индикаторы
- •Стандартные электродные потенциалы Eo некоторых металлов (ряд напряжений)
- •Рекомендуемая литература
- •Библиографический список
- •Физическая химия учебное пособие к лабораторным работам
10. Электролиз
Электролиз – это совокупность процессов, протекающих в растворе или расплаве электролита при пропускании через него электрического тока.
Электролиз – дословно: «lysis» – разложение, растворение, распад и «электро» – электрическим током.
Электролиз является одним из важнейших направлений в электрохимии.
Электрический ток, проходя через растворы, вызывает в них, так же как и в расплавах, химические изменения, выражающиеся в том, что из растворов выделяются продукты разложения растворенного вещества или растворителя. Вещества, растворы которых проводят электрический ток за счет движения ионов, получили название электролитов. Электролитами являются кислоты, основания и соли. Это проводники электричества II рода.
Электролиз осуществляется в электролизёрах. Простейший электролизер – это сосуд, заполненный раствором электролита, в который погружены два электрода, соединенные с источником постоянного тока (рис. 6).
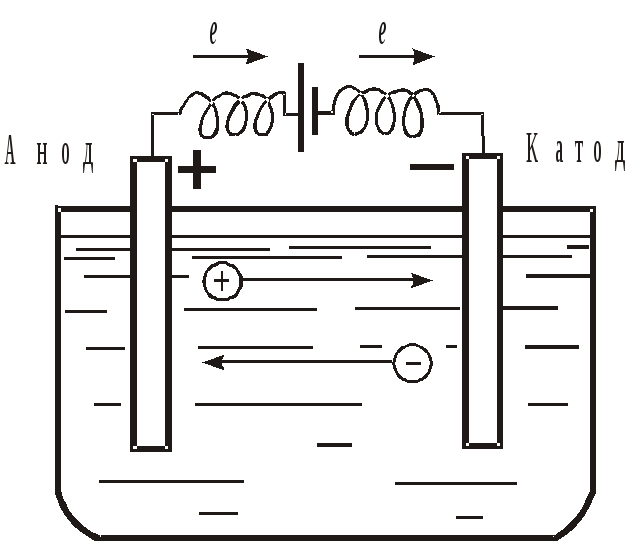
Рис. 6. Схема электролизера
Для осуществления электролиза к отрицательному полюсу внешнего
источника тока присоединяют катод, а к положительному – анод и погружают их в электролит. При прохождении тока через электролит положительно заряжённые ионы (K+, Cu2+, NH4+, Fe2+ и другие) под действием электрического поля движутся к отрицательному электроду – катоду, называются катионами, а отрицательно заряжённые ионы (Cl–, CN–, F–, SO42–, NO3– и др.) – к положительному электроду – аноду, и называются анионами.
На катоде идёт процесс восстановления катионов: Меn+, H+, H2O.
На аноде процесс окисления анионов: Anm–, OH–, H2O.
Различают электролиз расплавов и растворов электролитов.
Электролиз расплавов. Процессы в расплавленных электролитах – наиболее простой случай электролиза, т.к. при таком виде электролиза разложению подвергается только одно исследуемое вещество – сам электролит.
Рассмотрим электродные реакции на примере электролиза расплава хлорида натрия (NaCl) и гидроксида калия (KOH).
а) Хлорид натрия как сильный электролит диссоциирует на ионы:
![]() .
.
К катоду притягиваются положительно заряженные ионы Na+, а к аноду – отрицательно заряженные ионы Cl–.
На катоде протекает процесс восстановления из ионов натрия – натрия металлического
Na+
+
![]()
Naо,
Naо,
а на аноде – процесс окисления, за счет которого и образуется молекулярный хлор из соответствующих ионов Cl–:
![]()
Суммарное уравнение электролиза расплава хлорида натрия:

Разберем еще один пример электролиза расплава гидроксида калия (KOH). В расплаве едкого калия содержатся ионы K+ и OH–, на катоде происходит выделение металлического калия, а у анода ионы OH– окисляются с образованием воды и кислорода.
Уравнение электролиза расплава KOH записывается следующим образом:
![]()

Если электролизу подвергается расплав, который содержит несколько катионов металлов, то в этом случае последовательность восстановления определяется электродными потенциалами металлов (см. приложение, табл. 7), причем, в первую очередь восстанавливаются катионы металлов, обладающие большими значениями электродного потенциала.
Электролиз водных растворов. Процессы в водных растворах электролитов – более сложный случай электролиза, т.к. в этом случае разложению действием тока подвергаются не только молекулы электролита, но и молекулы воды.
Характер химических реакций в водных растворах на катоде определяется положением металла в ряду стандартных электродных потенциалов.
Руководствуясь рядом стандартных электродных потенциалов металлов, последовательность восстановительных процессов на катоде можно представить в следующем виде:

