
- •I.Получение so2
- •2.Очистка газа от пыли.
- •I. Контактное окисление аммиака до no
- •II. Окисление no до no2
- •III. Абсорбция no2 водой
- •1.Изменение технологического режима
- •2.Методы абсорбции и адсорбции для улавливания окислов азота
- •3.Каталитическое восстановление окислов азота до молекулярного азота.
- •1. Нейтрализация азотной кислоты аммиаком
- •2. Упаривание полученного раствора аммиачной селитры
- •2. Трубчатые вращающиеся печи.
- •3. Печи кипящего слоя.
II. Окисление no до no2
Окисление NO до NO2 идет по следующей реакции:
2NO + O2 ↔ 2NO2 + 112.3 кДж
Эта реакция идет с уменьшением объема и выделением тепла, следовательно уменьшение температуры и повышение давления будут смещать равновесие вправо и увеличивать выход NO2.
Ниже 150 0С эта реакция практически полностью протекает в сторону об-разования NO2 . При повышении температуры равновесие сдвигается влево и при t>8000С идет только обратная реакция. Эта реакция является исключением из общего правила, так как с ростом температуры ее скорость падает.
Объяснение этому факту : считают, что окисление NO в NO2 идет в две ста-дии:
1-я стадия 2NO ↔ (NO)2+ Q – идет образование димера
2-я стадия (NO)2 + O2 ↔ 2 NO2 + Q
1стадия - процесс обратимый и экзотермический, поэтому повышение темпе-ратуры смещает равновесие влево и, как следствие, понижается концентрация димера.
Скорость же второй стадии зависит от концентрации димера: чем она меньше, тем меньше скорость реакции.
В процессе окисления NO в NO2 протекает еще ряд побочных реакций, например, образование ассоциатов, N2O3 и т.д.
2NO2 ↔ N2O4 + 57кДж
NO + NO2 ↔ N2O3 + 40,2кДж
В результате протекания всех этих реакций образуется смесь нитрозных газов: NO, N2O3 , NO2 , N2O4 , N2O, H2O. Состав смеси может сильно меняться, но основным компонентом всегда является NO2 .
III. Абсорбция no2 водой
Абсорбция NO2 водой – конечная стадия процесса. В процессе абсорбции протекают следующие реакции:
2NO2 + H2O ↔ HNO3 + HNO2 +116 кДж
N2O 4 + H2O ↔ HNO3 + HNO2 + 59 кДж
Азотистая кислота неустойчива. Она распадается:
3HNO2 → HNO3 + 2 NO + H2O -75,8 кДж
Поэтому суммарное уравнение этого процесса имеет вид:
3NO2 + H2O → 2HNO3 + NO +136 кДж
Из оксидов азота, присутствующих в нитрозной смеси также взаимодей-ствуют с водой:
N2O3 + H2O → 2 HNO3
NO, N2O с водой не взаимодействуют
Для повышения степени абсорбции NO2 водой необходимо увеличение давле-ния и уменьшение температуры. При атмосферном давлении удается получить азотную кислоту с концентрацией не более 50%, а при 10 атм - до 62%.
Технологическая схема производства разбавленной азотной кислоты.
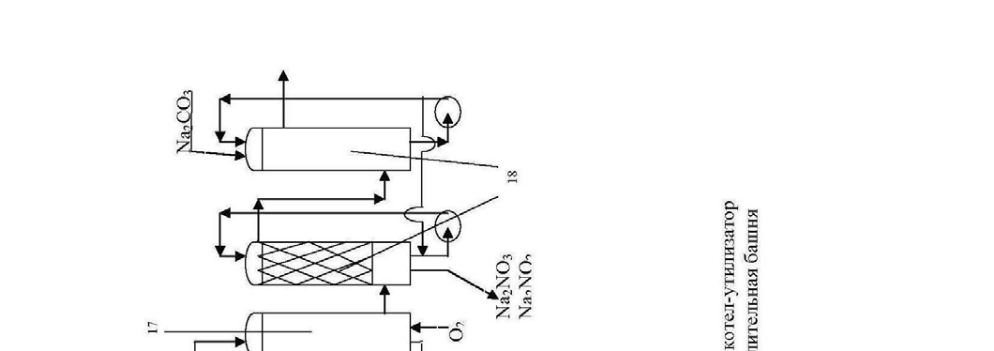
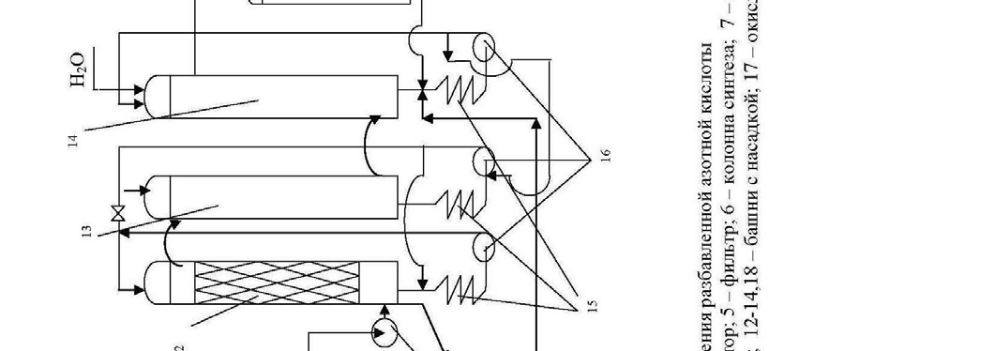
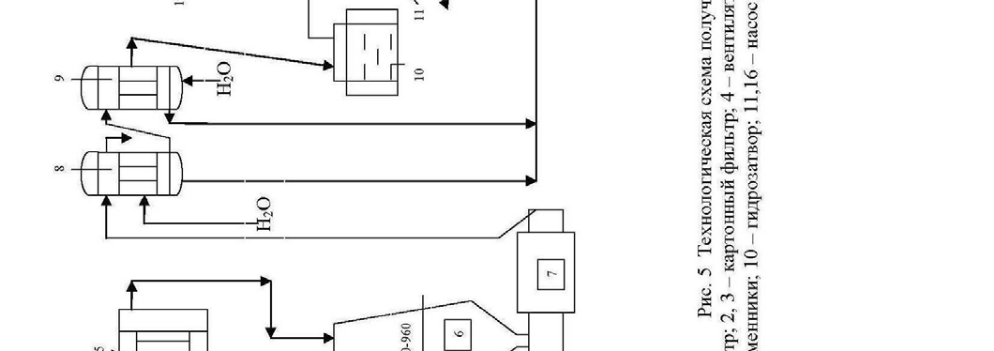
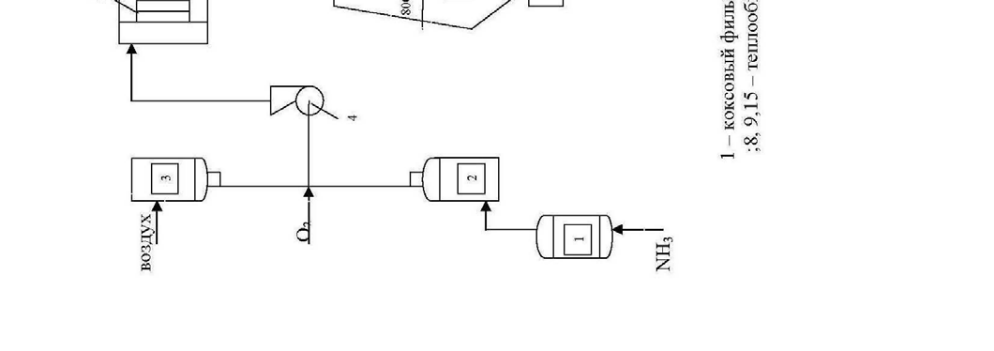
Технологическая схема производства разбавленной азотной кислоты представлена на рис.5.
Аммиак очищается от механических примесей и масла в коксовом 1 и картонном 2 фильтрах. Воздух очищается в картонном фильтре 3. Смесь воз-духа, аммиака и добавочного кислорода подается вентилятором 4 через фильтр 5 в колонну синтеза 6. Степень окисления аммиака до NO составляет 97-98%. Температура газов на выходе из колонны составляет 800 0С. Газ из колонны поступает в котел-утилизатор 7, где его температура падает до 250 0С. Затем смесь нитрозных газов охлаждают водой в теплообменниках 8 и 9 примерно до 30 0С, при этом происходит частичная конденсация паров воды и начинает-ся окисление NO в NO2 .
Степень окисления в первом теплообменнике незначительна, поэтому образуется кислота с концентрацией 3%. Во втором тепло-обменнике образуется 25% кислота.
Нитрозные газы из теплообменника 9 через гидрозатвор 10 подаются в абсорбционное отделение, которое состоит из 6-8 последовательно включен-ных башен с насадкой 12-14. Башни снабжены холодильниками 15 для охлаж-дения вытекающих растворов и насосами 16 для циркуляции этих растворов.
Вода движется противотоком газу. Из башни 12 выводится 50%-ная азотная кислота. В кислотных башнях перерабатывается около 92% оксидов азота, поступивших на абсорбцию. Газ, содержащий NO, из башни 14 поступа-ет в окислительную башню 17, где NO превращается в NO2, туда же подается кислород для окисления. Затем этот газ поступает на щелочную абсорбцию в башню 18 раствором соды. При этом идет следующая реакция:
2 NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2
При этом исключается выделение NO в атмосферу. Башен щелочной аб-сорбции обычно 2-3 и процесс идет противотоком. Раствор выводится из пер-вой по ходу движения газа башни. Далее газ выбрасывается в атмосферу через выхлопную трубу 19.
Получение концентрированной азотной кислоты методом
концентрирования.
Если упаривать раствор азотной кислоты, то можно получить концентра-цию не больше 68%, так как при этой концентрации образуется азеотропная смесь. Для получения более концентрированной кислоты применяют перегон-ку разбавленной кислоты в присутствии концентрированной серной кислоты, как водоотнимающего средства.
При взаимодействии серной кислоты с водой образуются гидраты, тем-пература кипения которых выше температуры кипения концентрированной азотной кислоты.
Перегонку азотной кислоты осуществляют в тарельчатых колоннах или колоннах с насадкой, изготовленных из кислотоупорного чугуна содержащего до 18% кремния.
Технологическая схема получения концентрированной азотной ки-слоты методом концентрирования
Технологическая
схема получения концентрированной
азотной кислоты методом концентрирования
представлена на рис.6.
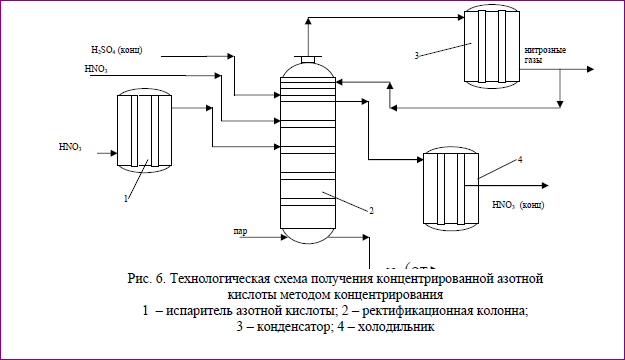
92-94% серная кислота поступает на одну из верхних тарелок колонны 2. Несколько ниже подается разбавленная азотная кислота, часть которой пода-ется через испаритель 1, нагревание в котором осуществляется острым паром, имеющим температуру 180-200 0С, подаваемым в нижнюю часть колонны. Пары азотной кислоты с небольшим содержанием паров воды и оксидов азота, образовавшимися в результате разложения азотной кислоты, поступают из ко-лонны 2 в конденсатор 3, где азотная кислота конденсируется, а окислы азота идут на переработку или улавливание. Часть окислов азота растворяется в азотной кислоте, поэтому из конденсатора 3 азотная кислота возвращается в колонну 2, где продувается парами азотной кислоты, а затем через холодиль-ник 4 отводится на склад. Отработанная серная кислота с концентрацией 70% вытекает из нижней части колонны 2 и направляется на упаривание. Расход серной кислоты составляет 3-4 тонны на 1 тонну концентрированной азотной кислоты. Для возврата в производство ее нужно упарить до концентрации 92-94% , что связанно с большим расходом энергии и коррозией аппаратов.
Прямой синтез концентрированной азотной кислоты.
Прямой синтез идет по уравнению:
2 N2O4(ж) + 2H2O (ж)+ O2(г) ↔ 4 HNO3 + Q
N2O4 получают из нитрозных газов абсорбцией концентрированной азотной кислотой при пониженной температуре с последующим выделением двуокиси азота. Двуокись азота хорошо растворяется в концентрированной азотной ки-слоте при низких температурах (около -10 0С), с получением нитроолеума:
nNO2 + HNO3 = HNO3x nNO2
Затем из нитроолеума при нагревании до 80 0С выделяют двуокись азота, ко-торую конденсируют охлаждением до -8 0С. Полученную жидкую двуокись азота смешивают с разбавленной азотной кислотой (55-60%) и направляют в автоклав. Туда же подают кислород. Реакция идет при температуре 900С и давлении 50атмосфер:
2 N2O4(ж) + 2H2O (ж)+ O2(г) ↔ 4 HNO3 + Q
Для смещения равновесия вправо и повышения скорости реакции создают 100% избыток двуокиси азота. Из автоклава концентрированную азотную ки-слоту, содержащую избыток двуокиси азота подают в отбелочную колонну, где при температуре 80 0С идет выделение двуокиси азота, которую улавлива-ют и возвращают в производство.
Очистка отходящих газов производства азотной кислоты
Отходящие газы производства разбавленной азотной кислоты содержат окислы азота. Снижение содержания окислов азота в отходящих газах можно осуществлять следующими способами:
