
Лекция 19.Полипептиды, белки 05.12.10
.doc|
Лекция 19 |
Полипептиды, белки
Биологическая роль белков и полипептидов
Полипептиды и белки – основные вещества живого организма. "Жизнь – это форма существования белковых тел" (Ф.Энгельс). Роль их в обмене веществ уникальна, они выполняют все основные функции метаболизма:
1) Белки – пластический материал тканей;
2) Белки – один из трех видов питательных веществ, необходимых организму;
3) Белковые структуры являются ключевыми в составе ферментов – биохимических катализаторов, "двигателей" метаболизма;
4) Гормоны и вещества, регулирующие пути биохимических превращений – это в основном, полипептиды и белки. Тканевые рецепторы гормонов, биорегуляторов и лекарственных веществ также представляют собой белковые структуры.
Первичная структура полипептидов и белков
Полипептиды и белки – это полимеры, состоящие из остатков аминокислот, связанных между собой пептидными связями.
Условно считается, что полипептиды – это полимеры, содержащие до 100 аминокислотных остатков, более 100 остатков – это белки. Особо выделяются олигопептиды – до 10 аминокислотных остатков.
Полипептиды и белки образуются в результате поликонденсации α-аминокислот:
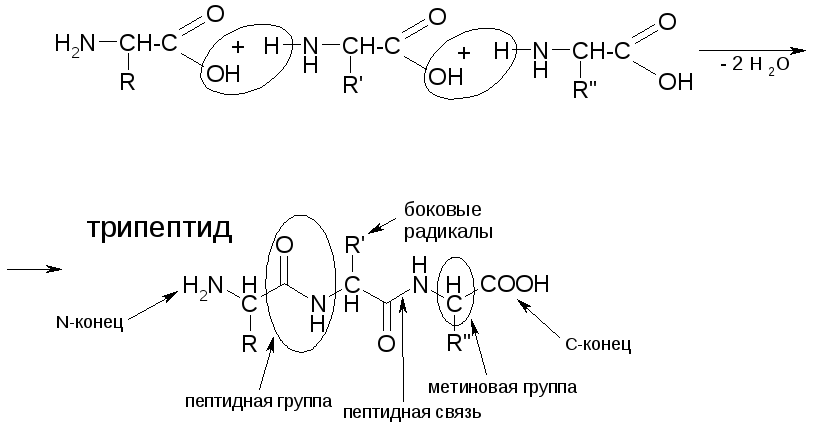

Физико-химические свойства полипептидов и белков
Молекулы полипептидов и белков имеют в своем составе ионогенные карбоксильные и аминогруппы и, подобно аминокислотам, всегда несут на себе электрический заряд, знак и величина которого зависит от рН раствора.
Все полипептиды и белки характеризуются определенной изоэлектрической точкой (pI) - значением рН, при котором суммарный заряд молекулы равен нулю.
Если рН раствора ниже изоэлектрической точки (pH < pI), то молекула в целом имеет положительный заряд.
Если рН раствора выше изоэлектрической точки (pH > pI), то молекула в целом имеет отрицательный заряд.
Если количества карбоксильных и аминогрупп в молекуле одинаковы, то изолектрическая точка вещества находится в области нейтрального рН (pI = 7). Это нейтральные полипептиды.
Если в молекуле преобладают карбоксильные группы, то изолектрическая
точка находится в кислотной области рН (pI < 7). Это кислые полипептиды.
Если в молекуле преобладают аминогруппы, то изолектрическая точка находится в основной области рН (pI > 7). Это основные полипептиды.
Растворимость полипептидов в воде зависит от их молекулярной массы.
Олигопептиды и низкомолекулярные полипептиды подобно аминокислотам хорошо растворимы в воде.
Высокомолекулярные белки образуют коллоидные растворы. Их растворимость зависит от рН (т.е. от заряда молекулы). В изоэлектрической точке растворимость белка минимальна и он выпадает в осадок. При подкислении или подщелачивании молекулы снова приобретают заряд и осадок растворяется.
Пространственное строение белков и полипептидов
Высокомолекулярные полипептиды и белки кроме первичной структуры обладают более высокими уровнями пространственной организации – вторичную, третичную и четвертичную структуры.
ПЕПТИДНАЯ ГРУППА

Вторичная структура
1) α-спираль
Строение пептидной группировки определяет пространственное строение полипептидной цепи.
Л.Полинг (1950 г.) расчетным путем показал, что для α-полипептиной цепи одной из наиболее вероятных является структура правозакрученной α-пирали. Вскоре это было экспериментально подтверждено рентгено-структурным анализом:
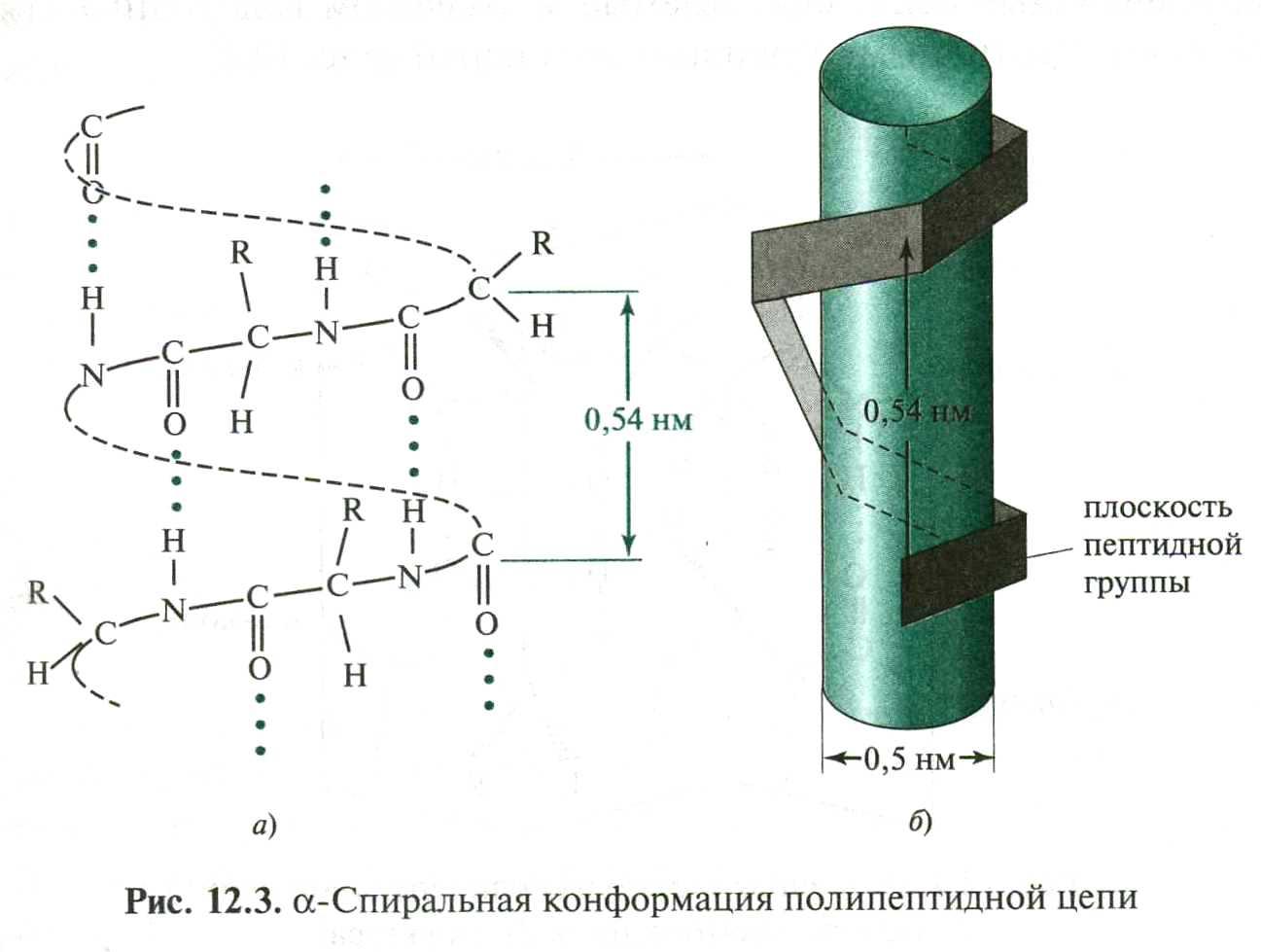
Между С=О 1-го и N-H 5-го аминокислотных остатков образуются водородные связи, направленные почти параллельно оси спирали, они скрепляют спираль. Боковые радикалы R расположены по периферии спирали.
2) β-складчатая структура
В этом виде вторичной структуры вытянутые одна вдоль другой полипептидные цепи образуют водородные связи между собой:


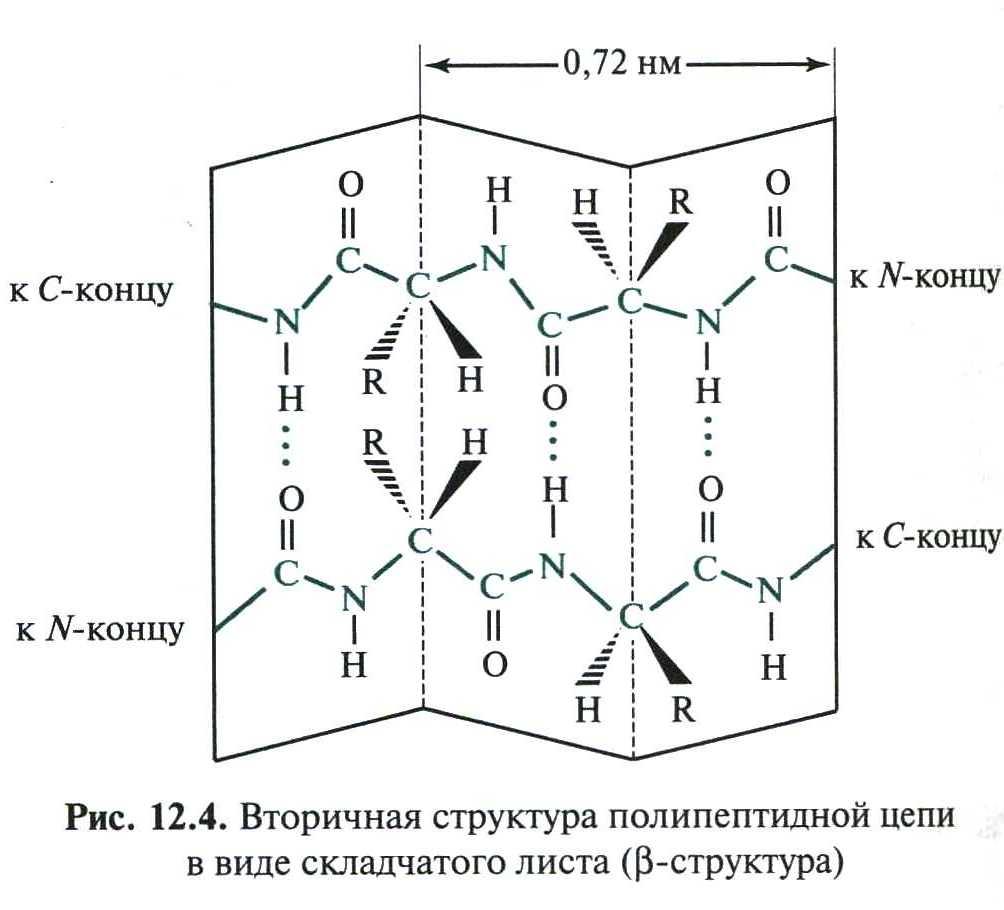
Многие белки имеют вторичную структуру с чередующимися фрагментами α-спирали и β-складчатой структуры.
Третичная структура
α-Спираль, будучи достаточно протяженной, изгибаясь, складывается в клубок. Это происходит в результате взаимодействия боковых радикалов достаточно удаленных друг от друга. Образуется глобула:

Виды взаимодействия, формирующие третичную структуру
1) Водородные связи

2) Ионное взаимодействие

3) Гидрофобное взаимодействие

4) Дисульфидные связи
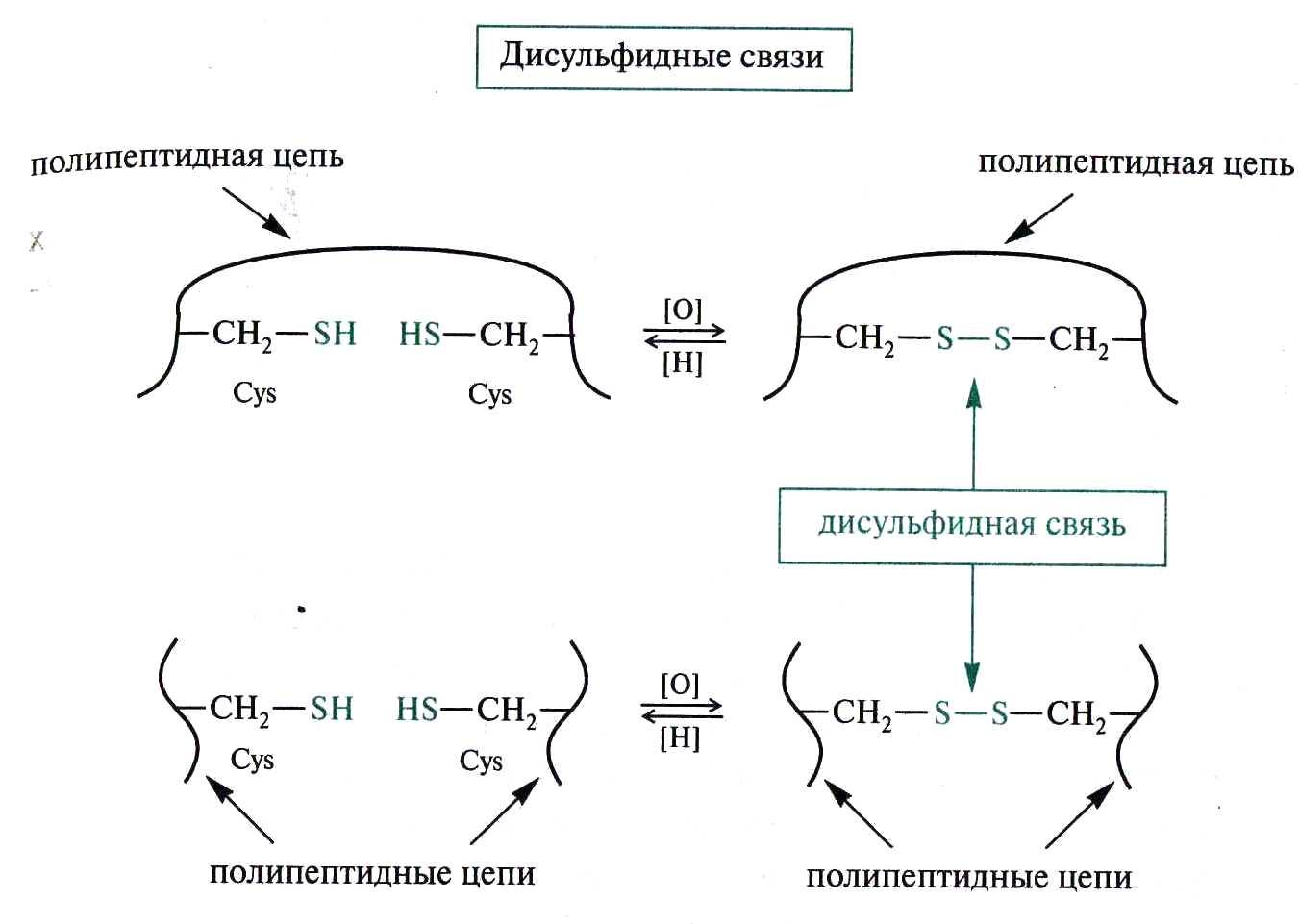
Четвертичная структура
Четвертичная структура – это агрегат субъединиц – глобул. Она формируется теми же видами взаимодействия, что и третичная структура:
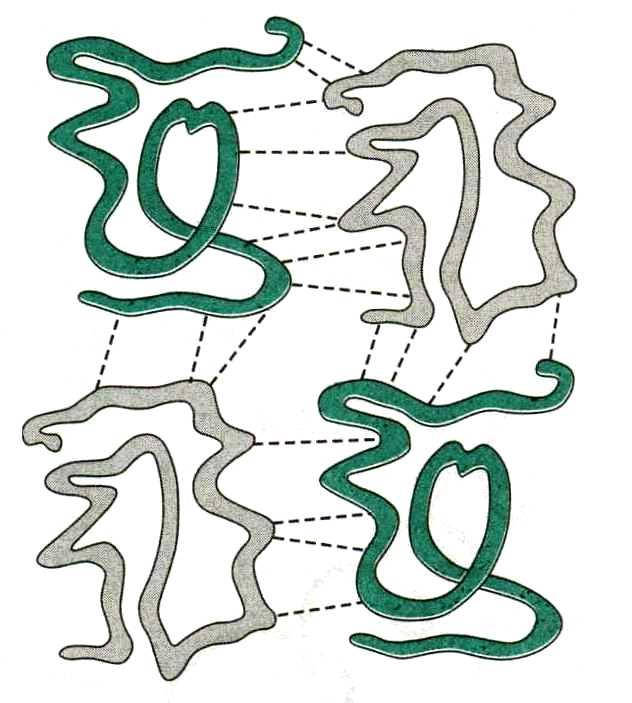
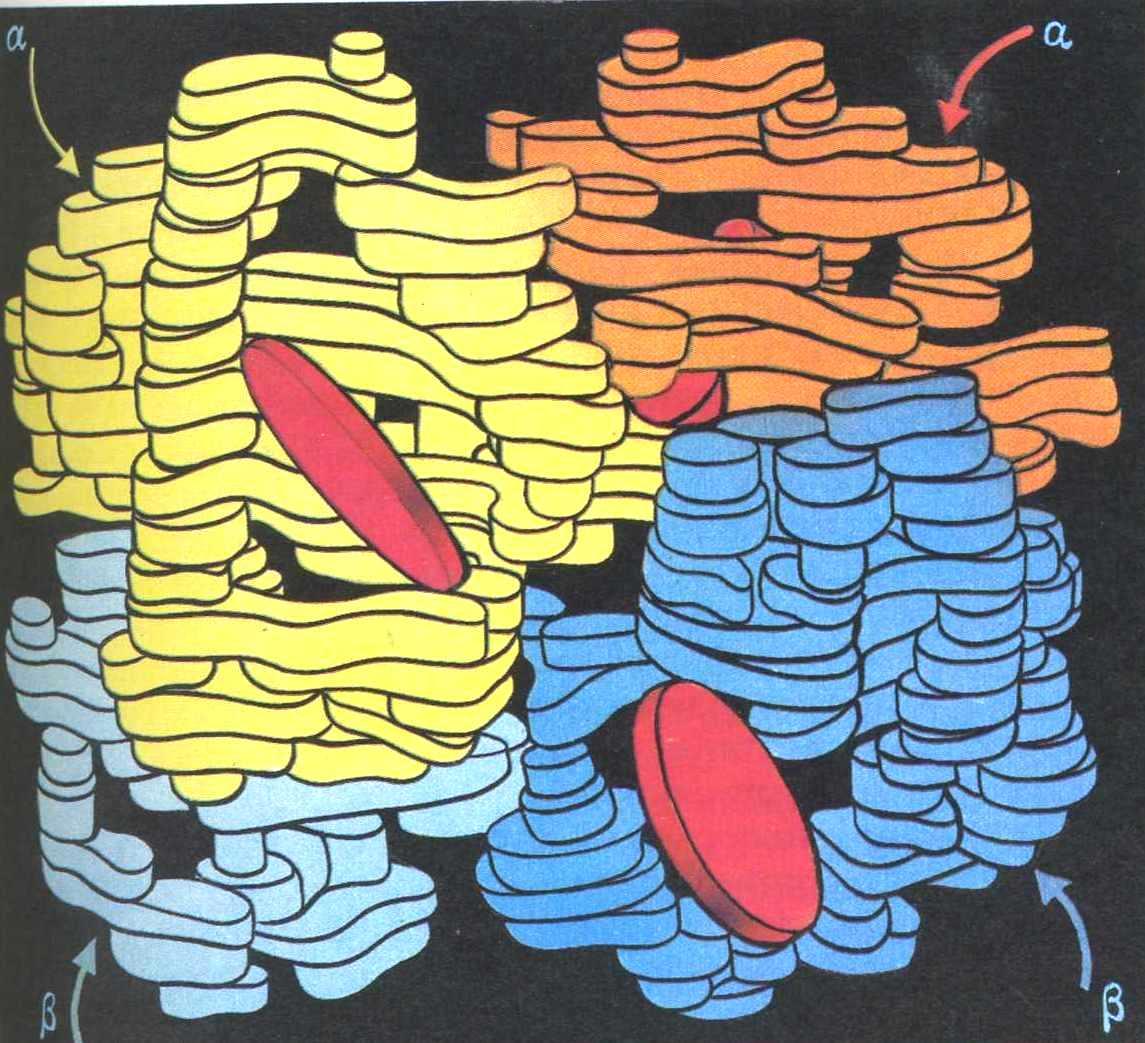
Четвертичная структура белка Четвертичная структура гемоглобина
Четвертичной структурой обладают некоторые сложные белки – гемоглобин, некоторые ферменты и др.
ЛИТЕРАТУРА:
Основная
1. Тюкавкина Н.А., Зурабян С.Э., Белобородов В.Л. и др. – Органическая химия (специальный курс), кн.2 – Дрофа, М., 2008 г., с. 207-227.
2. Тюкавкина Н.А., Бауков Ю.И.– Биоорганическая химия – ДРОФА, М., 2007 г., с. 314-315, 345-369.
Дополнительная
1. Овчинников Ю.А. – Биоорганическая химия – М., Просвещение, 1987, с.20-295.
05.12.10
