экзамен. органика. второй вопрос
.doc|
№
Химические
свойства:
в основном присоединение. π-связь
легко поляризуется, атакуют электрофлы
и радикалы.
Химические свойства: 1.
Электрофильное присоединение: а
– вода и галогенводороды (в кислой
среде!!):
|
|
б
– серная кислота:
в
– галогены (кроме F):
г – хлорноватистая кислота(справа выше). 2. Радикальное присоединение:
3.
Аллильное замещение:
4.
Окисление:
Значение – сырье для спиртов, альдегидов, кислот, полимеров (полиэтилен, каучук). Этилен ускоряет созревание овощей и фруктов. |
|
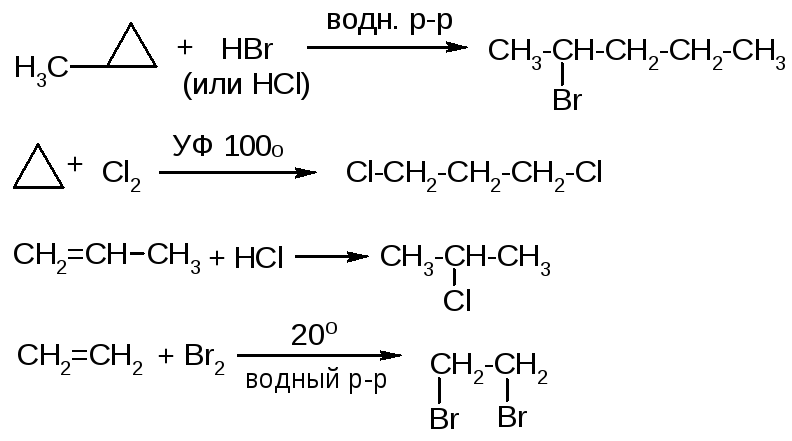
№20. Алкины - CnH2n-2. Изомерия – структурная. До 4 углеродов – газы (Ткип 27), до 17 – жидкости. Неполярны. Получение:
Хим.
свойства:
1.
Гидрир-е:
2.
Окисление.
4.
Нуклеоф. присоед-е (в присутств. Hg):
5. Кислотность: 6. Присоед-е к карбонильн. соед-ям:
|
|
№
Бутадиен
получают методом ступенчатого
дегидрирования бутан-бутеновой
фракции крекинга нефти. Аналогично
из изопентан-изопентеновой фракции
получают изопрен.
При
низких температурах преимущество
имеет 1,2-изомер как более быстро
образующийся, при высоких - 1,4 изомер
как более термодинам. устойчивому.
Химические свойства:
|
|
№21. Арены. Имеют сопряженную аром. систему. Делятся на бензоидные и небензоидные. Бензоидные бывают многоядерные (конденсиров-е или изолир-е). Бензол – жидкость с т.кип. 80о; производные бензола – более высоко кипящие жидкости или низкоплавкие твердые вещества. Многоядерные арены – низкоплавкие твердые вещества. Все ароматические углеводороды имеют характерный запах. Способы получения:
Хим. свойства: 1. Электрофильн. замещ-е:
2. Разрушение системы (окис-е, гидрир-е, радик. хлорир-е):
|
|
3. Реакции боковых цепей алкилбензолов: а- радик. замещ-е:
б – окис-е:
4. Реакции многоядерных аренов:
|
|
№17.
Спирты. Бывают первичные, вторичные,
третичные. Одноатомные и многоатомные.
До11 С-атомов – жидкости, больше–
твердые. Плотность < 1. Полярны.
Получение:
1. Кислотность одноатомных: 2. Кислотность 1.2-диолов:
3. Основность: 4. Нуклеофильные свойства:
|
|
5. Нуклеоф. замещ-е гидрокс. группы: 6. Элиминирование: Легкость
дегидратации: первичные
< вторичные < третичные
В
сложных реакция идет по
правилу
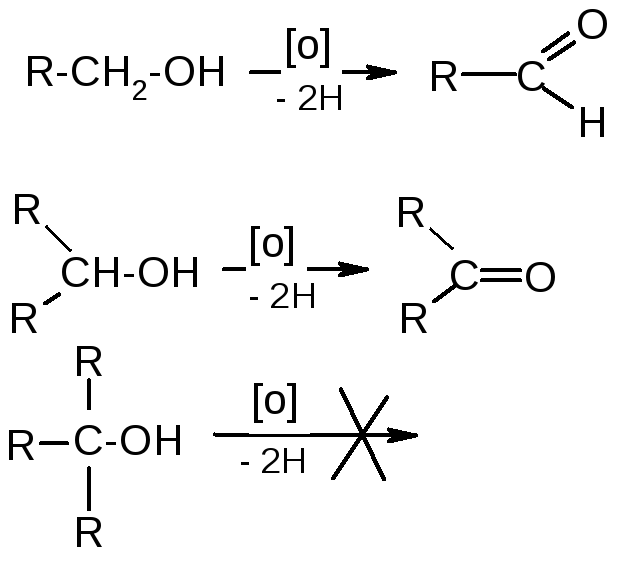
Зайцева. 7. Мягкое окисление:
|
|
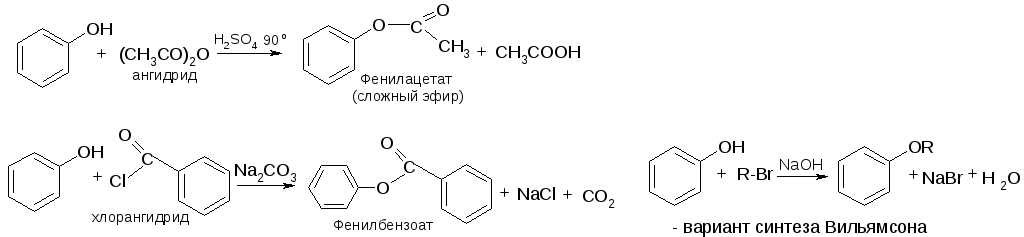
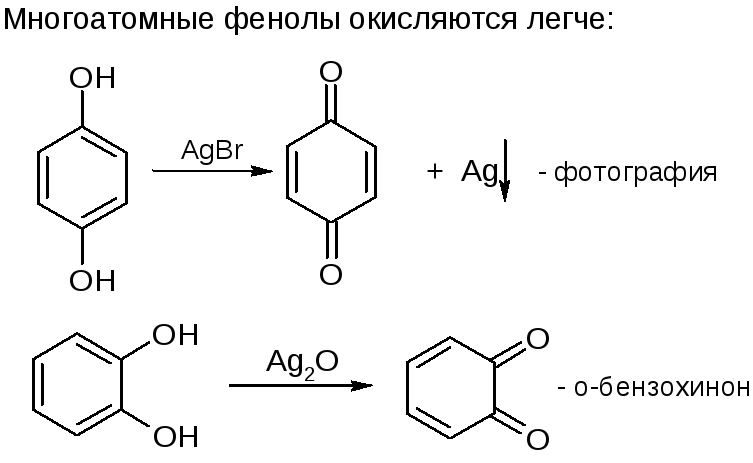
№22. Фенолы – ароматические спирты. Это пигменты, дубильн. в-ва и др. Одноатомные – низкоплавкие твердые. Многоатомные – менее летучи. Фенол мало растворим в воде. Многоатомные хорошо растворимы в воде. Способы получ-я:
Химические свойства: 1.
Кислотность:
2. Нуклеофильность:
|
|
3. Замещ-е гидрокс. группы (только при наличии заместителей-акцепторов):
5. Окисление:
|
|
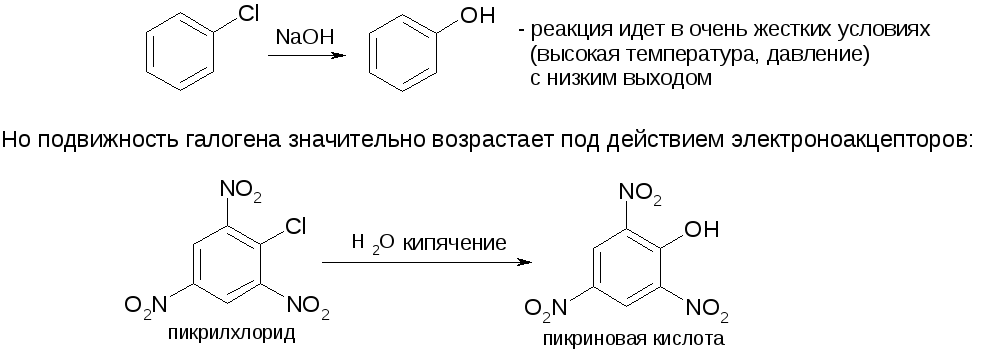
№16. Галогенопроизводные. Изомерия – по структуре углеродной цепи и по положению галогена. Низшие – газы или низко кипящие жидкости. С увеличением массы галогенов (F→Cl→Br→I) и их количества увелич. плотность и Ткип. Способы получения:
Химические свойства: 1. Нуклеофильное замещение:
|
|
2. Отщепление: 3. Реакции аллил- и бензилгалогенидов:
4. Реакции винил- и арилгалогенидов: В соединениях, содержащих галоген у двойной связи, подвижность последнего резко снижается.
|
|
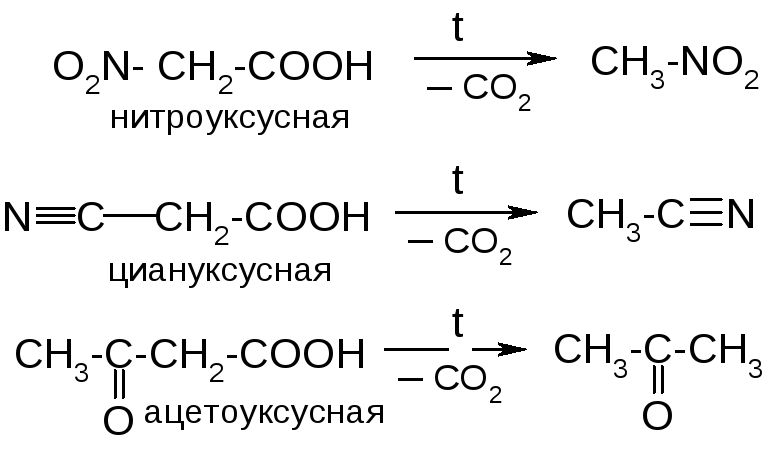
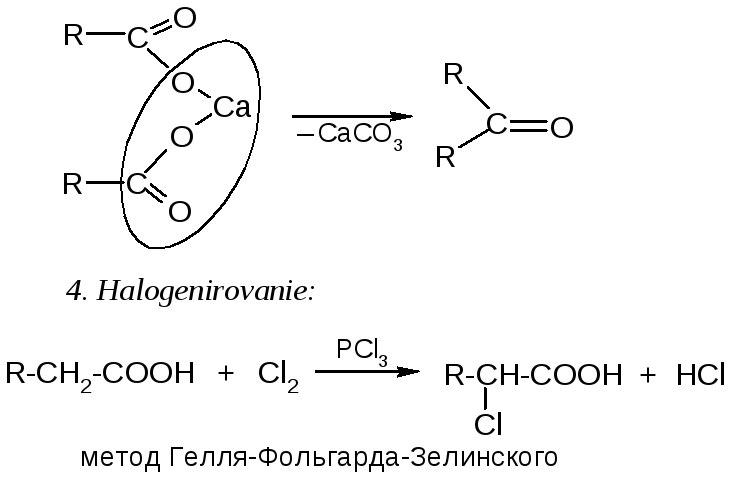
№23. Карбоновые кислоты. Делятся на моно-, ди- и трикарбоновые. Низшие алифатические монокарбоновые кислоты – жидкости с резким запахом, ароматические и дикарбоновые – твердые. Способы получения:
Химические
свойства: 1.
Кислотность:
2. Нуклеоф. замещение:
3. Декарбоксилирование:
|
|
ОСОБЕННОСТИ ХИМИЧЕСКИХ СВОЙСТВ ДИКАРБОНОВЫХ КИСЛОТ:
|
|
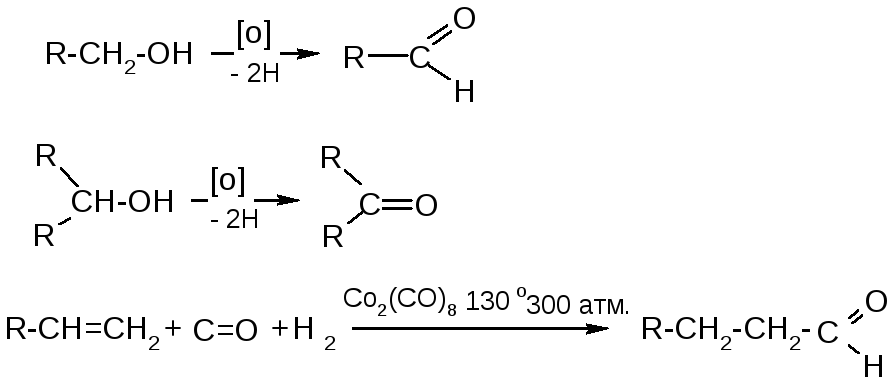
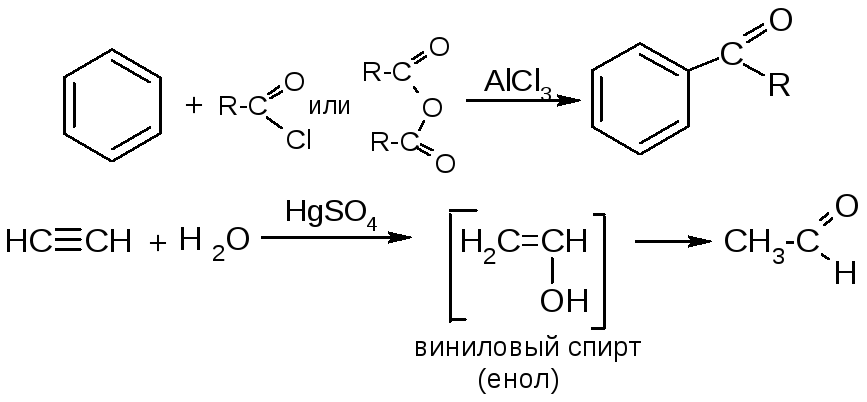
№15. Альдегиды и кетоны. Способы получения:
|
|
2. Кислотность:
3. Восстановление: 4. Окисление: 5. Диспропорционир-е (Тищенко и Канницарро):
|
|
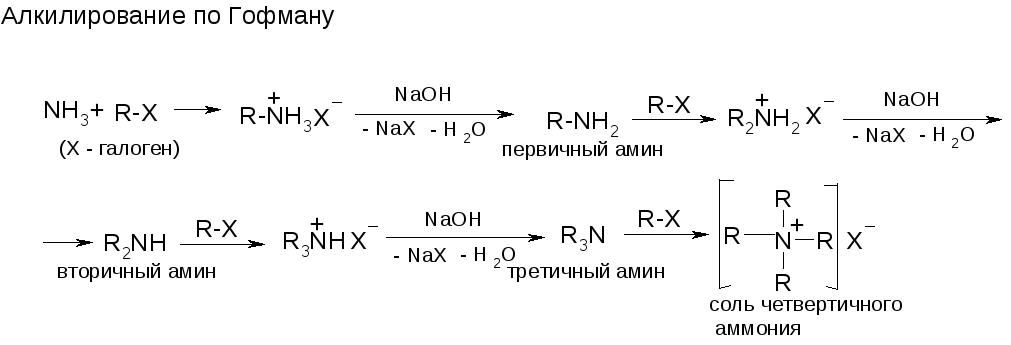
№24. Амины. Первичн., вторичн., третичн. и соли четвертич. аммония. Получение:
Хим.
св-ва:
1.
Основ-ть (самые осн-е – вторичные):
2. Нуклеофильность (первая – р-я Гофмана, см. выше):
3. Реакции с азотистой к-той:
4.
Электроф. замещ.
|
|
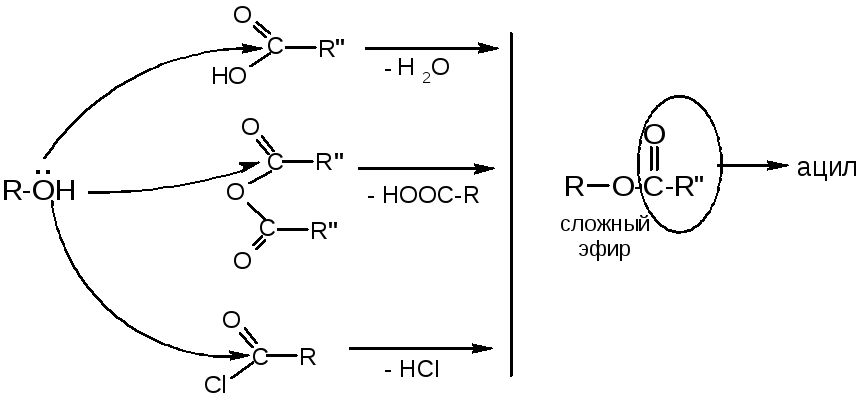
№14. Сложные эфиры. Получение:
Химические свойства: 1. Гидролиз:
2.
Переэтерификация:
3. Сложноэфирная конденсация Кляйзена: : 5. Восстановление
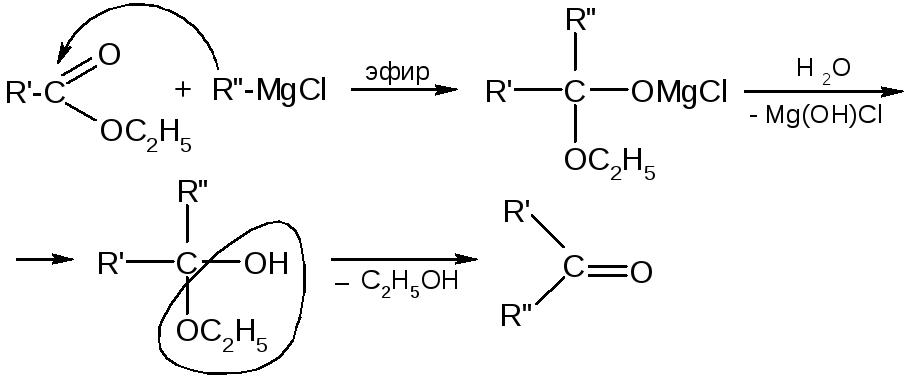
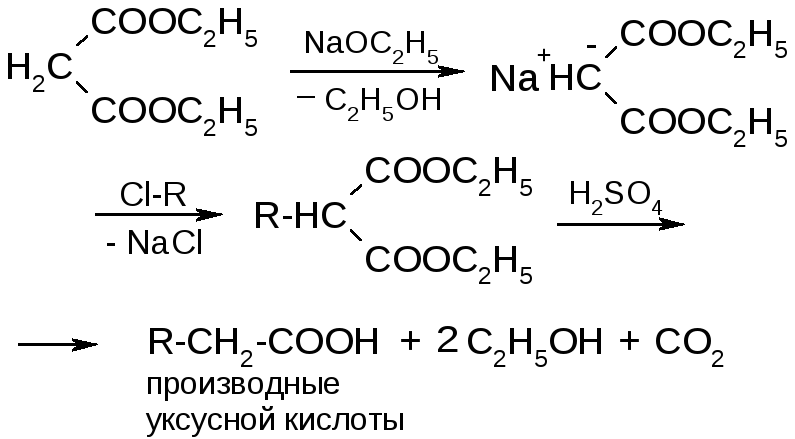
4. Взаимод-е с магнийорг. соед-ми МАЛОНОВЫЙ ЭФИР
|
|
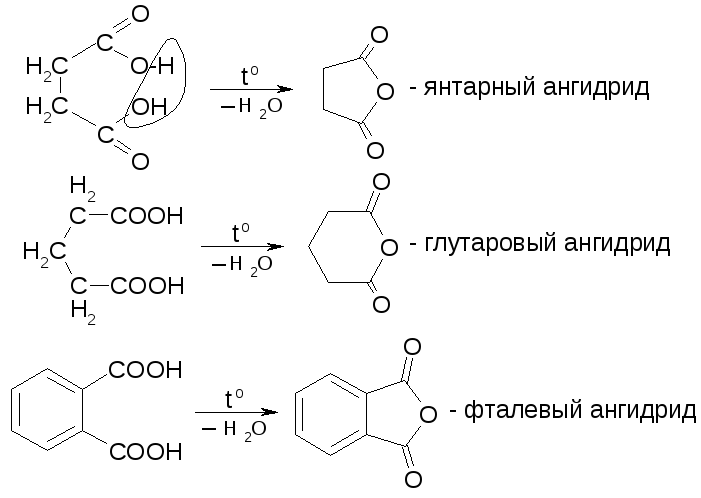
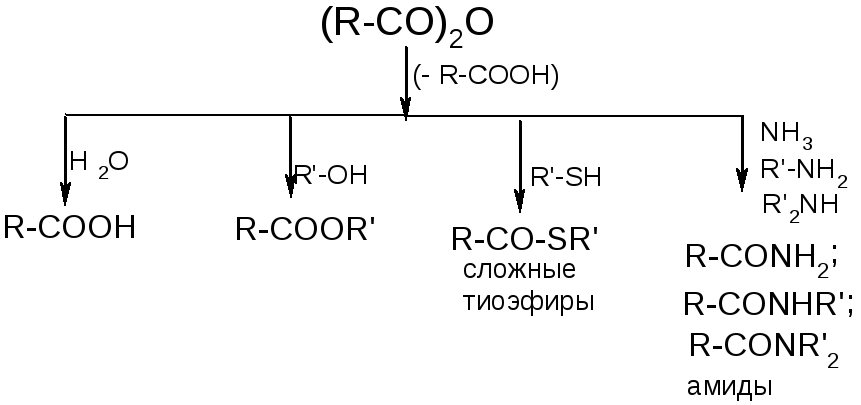
№25.
Ангидриды.
Циклические ангидриды получаются при нагревании соответствующих дикарбоновых кислот.
Галогенангидриды.
|
|
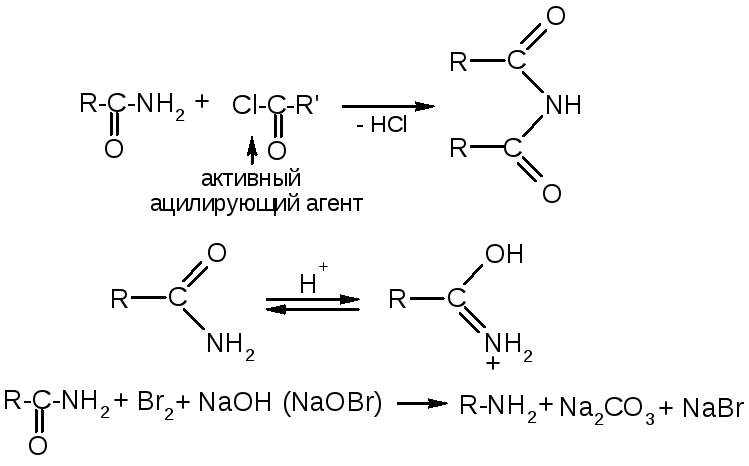
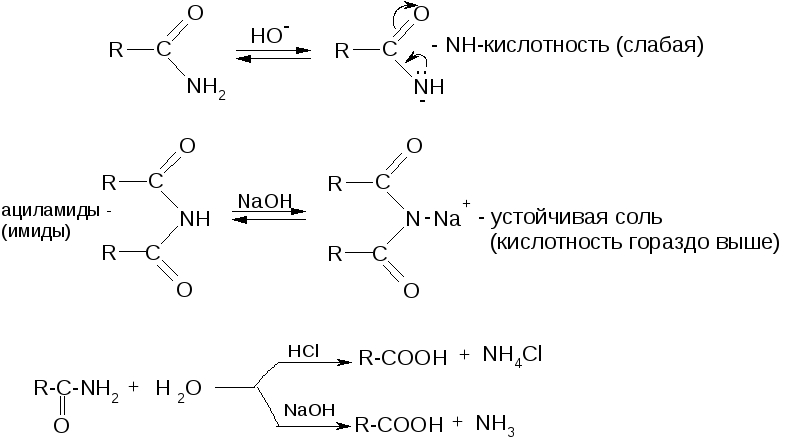
№13.
Амиды и нитрилы. Амиды:
Химические св-ва:
Нитрилы
(цианиды):
Химические св-ва:
|
|
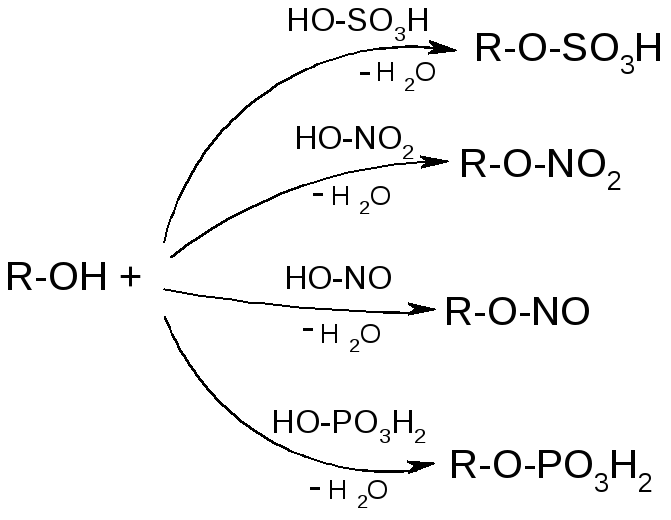
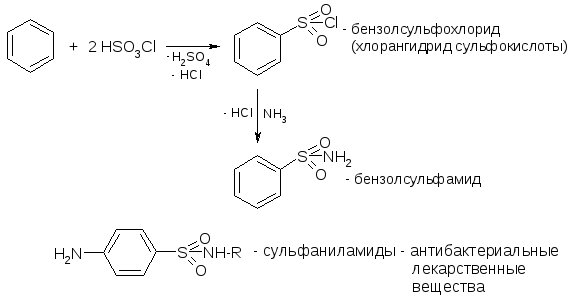
№26. Серосод. соед-я – тиолы (R-SH), тиоэфиры (R-S-R’), дисульфиды (R-S-S-R), сульфоксиды, сульфоны, сульфоновые кислоты. Тиолы: Получение: Кислотность: Окисление:
Тиоэфиры: Получение: Нуклеофильность:
Сульфоксиды и сульфоны: Получение: Сульфон. к-ы (R-SO3H). Получ-е:
Химические св-ва:
|
|
№12. Нитросоединения: Получение:
Химические св-ва:
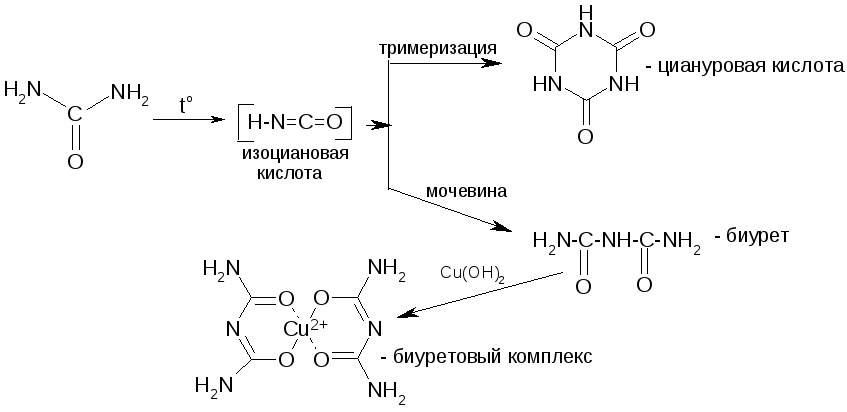
Мочевина – диамид угольной кислоты. Получение (синтез Вёлера):
Химические св-ва:
|
|
Гуанидин (иминомочевина) – азотистый аналог мочевины. Обладает необычно высокой основностью. Это связано с высокой степенью структурной симметрии его протонированной формы и максимальной делокализацией (+)-заряда:
Остатки содержатся во многих прир. соед-ях и лекю в-вах:
|
|
№27.
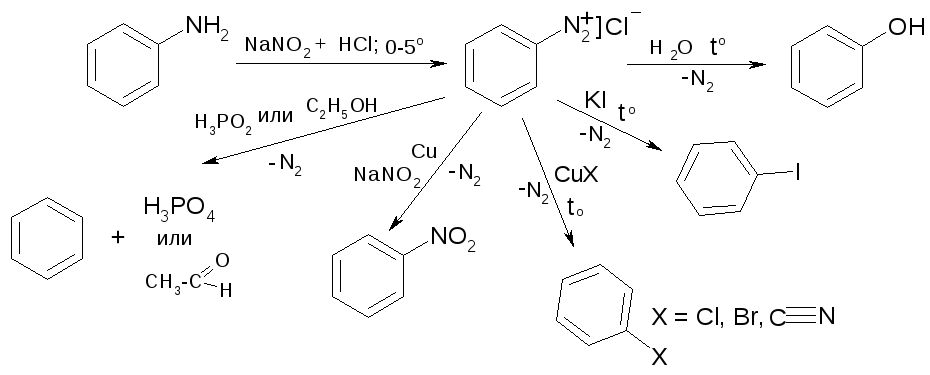
Соли диазония
Получение аром. солей диазония:
Хим. реакции с выдел-ем азота:
Без выдел-я азота:
|
|
Теория цветности объясняла наличие у вещества окраски присутствием в его структуре хромофоров – группировок, содержащих двойные связи: С=С, С=О, С=N, N=N и др. При включении хромофоров в сопряженную систему вещество приобретает окраску. По современным представлениям собственно хромофором является развитая сопряженная система как, например, у азобензола:
Заместители у сопряженной системы углубляют окраску, это явление называется ауксохромным эффектом. Ауксохромами являются достаточно сильные и электронодоноры, и электроноакцепторы: они поляризуют молекулу и увеличивают интенсивность окраски. Производные и аналоги азобензола получили широкое применение в качестве красителей. Главным исходным сырьем для получения послужил анилин, отсюда их название – анилиновые красители или азокрасители, поскольку основной метод получения этих веществ – это реакция азосочетания.
Многие красители изменяют цвет при изменении рН и применяются как индикаторы.
|
|
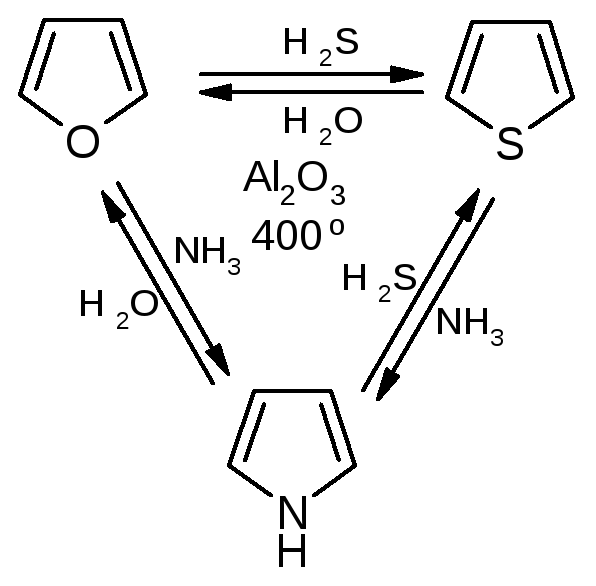
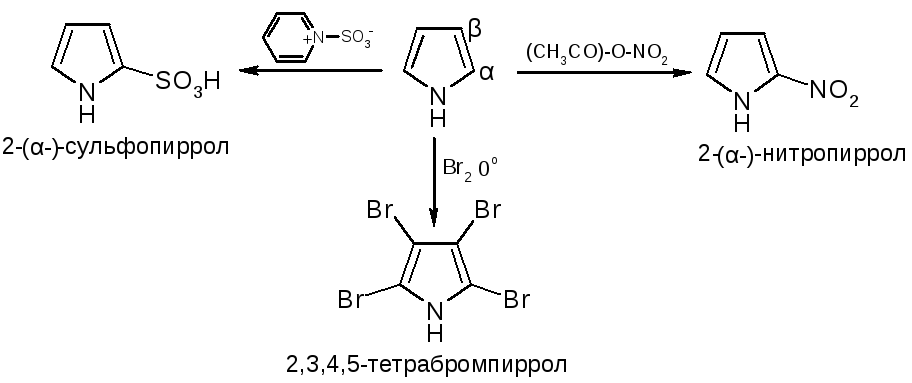
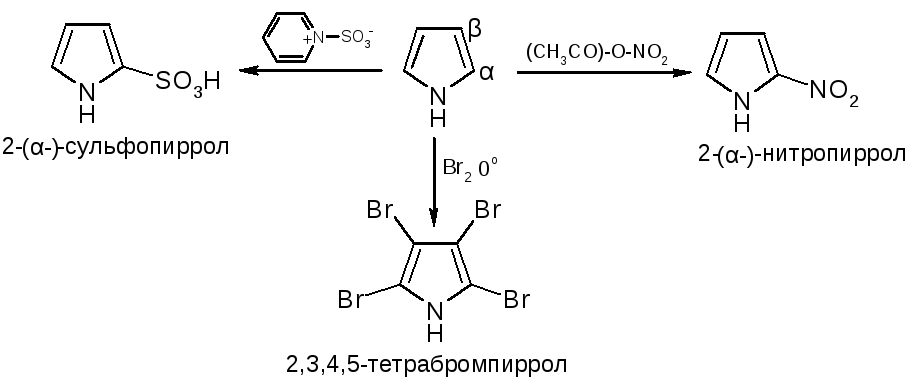
№11.
Пятичленные
гетероциклы с одним гетероатомом. Получение: Хим. св-ва: NH-кислотность
(пиррол почти лишен основности).
В
кислой среде пиррольный азот
протонируется и система превращается
в сопряженный диен, который
полимеризуется. Из-за ацидофобности
для сульфирования и нитрования
применяются апротонные реагенты.
|
|
Реакции фурана:
Реакции тиофена (не ацидофобен!):
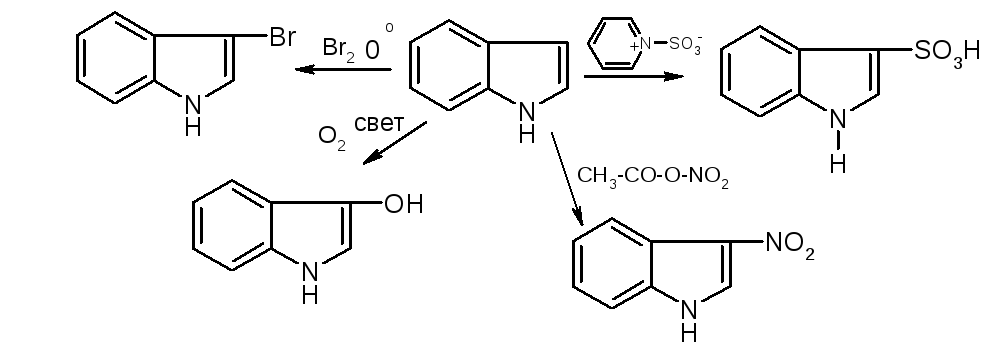
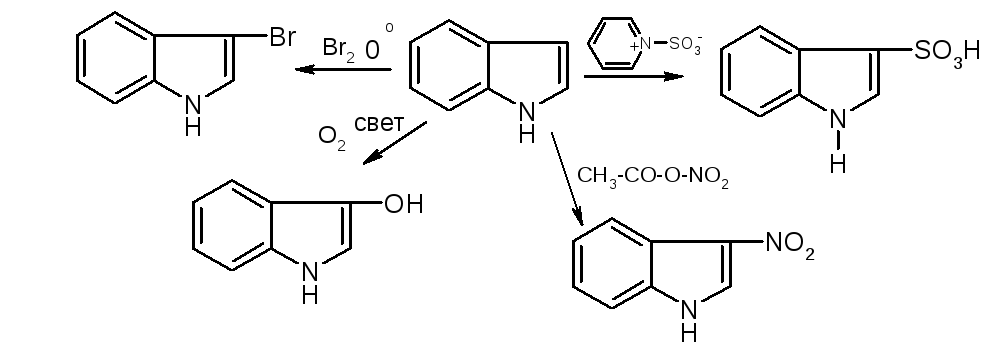
Аналог пиррола – индол:
|
|
№28. Диазолы. Получение:
Пиррольные атомы азота почти лишены основности и обладают NH-кислотностью. Пиридиновые атомы обладают высокой основностью и образуют устойчивые соли с кислотами. Диазолы амфотерны:
Таутомерия:
|
|
№10. Пиррол и индол. Пиррол: NH-кислотность (пиррол почти лишен основности). В кислой среде пиррольный азот протонируется и система превращается в сопряженный диен, который полимеризуется. Из-за ацидофобности для сульфирования и нитрования применяются апротонные реагенты.
Аналог пиррола – индол:
По реакционной способности индол напоминает пиррол. Он ацидофобен, практически лишен основности. Проявляет себя как слабая NH-кислота. В реакциях электрофильного замещения более активным является пиррольное кольцо. При этом заместитель вступает в положение 3, в котором имеется некоторый избыток электронной плотности. |
|
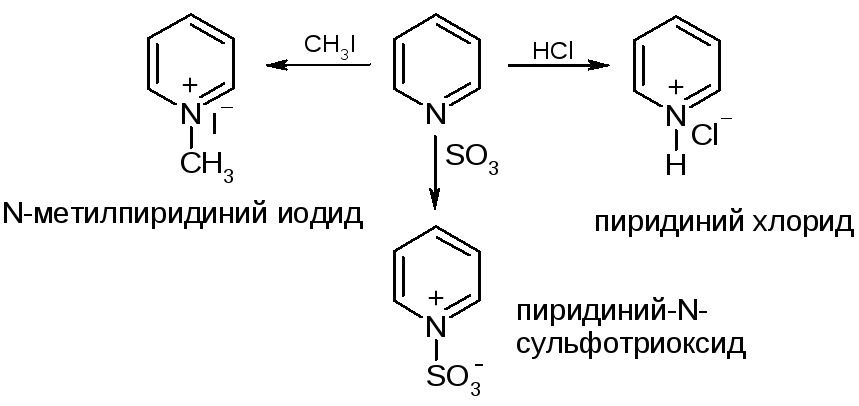
№29. Пиридин (шестичленный с одним азотом). Ароматичен. Есть свободная эл. пара у азота, не вовлеч. в сопряж-е, что объясняет основность и нуклеофильность. π-дефицитность углеродных атомов (электроотрицательный N стягивает электронную плотность), это затрудняет атаку С-атомов электрофилами и делает возможной атаку их нуклеофилами. Нуклеофильность и основность: Электроф. замещ-е:
Нуклеоф. замещ-е:
Нуклеоф. присоед-е: Присоед-е гидрид-иона:
|
|
Хинолин:
Электрофильная атака хинолина идет по бензольному циклу, имеющему бόльшую электронную плотность, преимущественно в положения 5 и 8.
Нуклеофильные реакции:
|
|
№9. Диазины (пиримидин, пиридазин (N в 1 и 2), пиразин (N в 1 и 4), пиперазин). Пиримидин (бензол с N в 1 и 3). По химическим свойствам – это соед-е, аналогичн. пиридину, обладающее основн. св-ми (меньше, чем пиридин) и более π-дефицитное. Нуклеофилы атакуют в места с наименьш. электр. плотностью – 2, 4, 6; электрофилы – в 5, имеющее более высокую плотность. Электроф. реакции затруднены из-за пониженной π-электронной плотности, а нуклефильные – наоборот облегчены:
Получение производных:
|
|
Получение пиридазина: Реакции пиридазина и его производных:
Препараты и применение: |
|
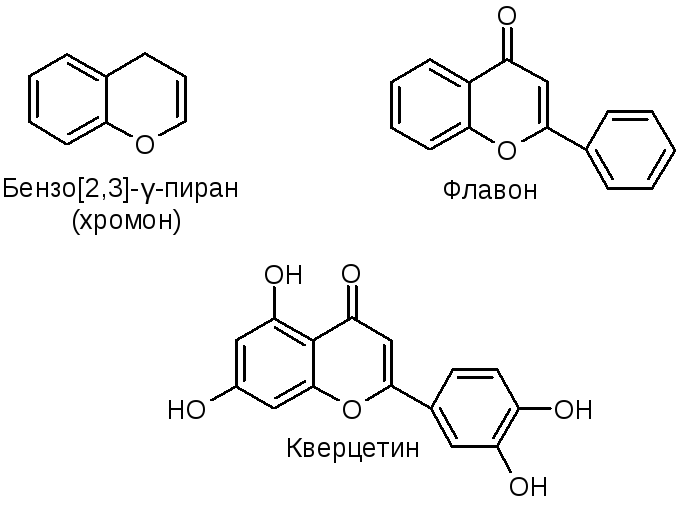
№30.
Пиран
и бензопиран.
Характерным свойством γ-пирона является его сравнительно высокая основность, которая связана с тем, что образующийся катион имеет строение пирилиевой соли: В растениях распространены соединения, содержащие конденсированную систему бензопирана. Этот цикл лежит в основе структуры токоферолов.
|
|
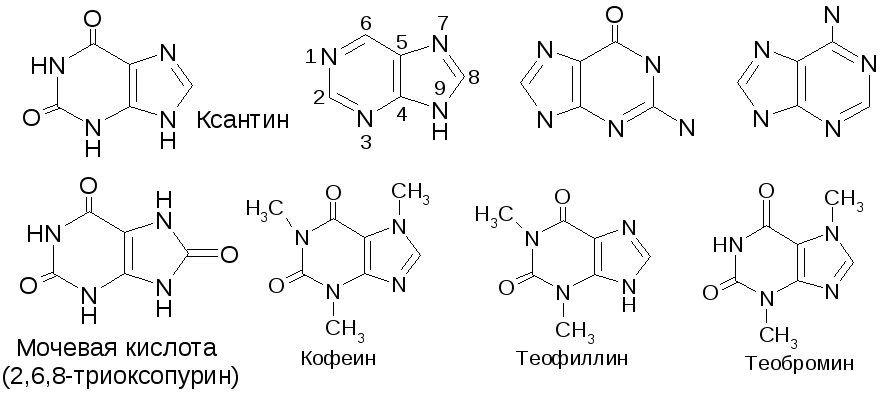
№8. Пурин. Пурин – ароматический цикл, устойчив к окислению. Растворим в воде. Амфотерен. Характерна 9NH-7NH-таутомерия. Это п-дефицитная система. Электроф. агенты присоединяются по N. Электроф. замещение по С характерно только для производных пурина с активирующими заместителями и идет всегда по положению 8. Производные пурина:
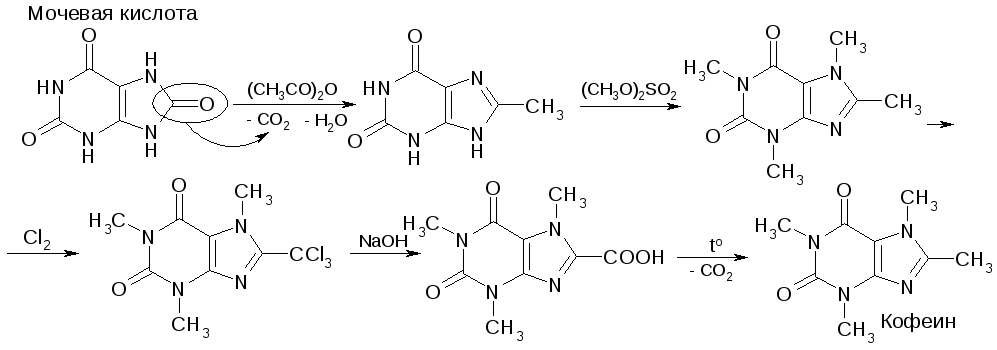
Синтез кофеина из мочевой кислоты:
|
|
Пурины, имеющие NH-группировку, образуют с тяжелыми металлами не растворимые в воде соли, что применяется для их качественного определения:
Мурексидная реакция – качественное определение ксантинов:
|
|
№31. Аминокислоты. Имеют карбоксильную группу и аминогруппу. Делятся на α, β и γ по полож-ю аминогруппы относ-но карбоксильной. Самые важные – альфа. Обладают стереоизомерией. В организме L-аминокислоты.
Химические свойства: 1. Амфотерность(в водном р-ре АК биполярны):
Изоэлектрич. точка (рI) –значение рН, при котором суммарный заряд молекулы равен О. 1) Если кол-ва групп COOH и NH2 в молекуле одинаковы, то изолектрическая точка находится в области нейтрального рН (нейтральные АК). 2) Если преоблад. карбокс. группы, то изолектр. точка - в кислой области (кислые АК). 3) Если преоблад. аминогруппы, то изолектр. точка - в основной области (основные АК). 4) Если рН ниже ИЭТ - «+» заряд, если рН выше ИЭТ - «-» заряд.
|
|
Общие реакции карбокс. группы - образование солей и функциональных производных. Общие реакции аминогруппы - солей, ацилирование, алкилирование. Аминокислоты: |
|
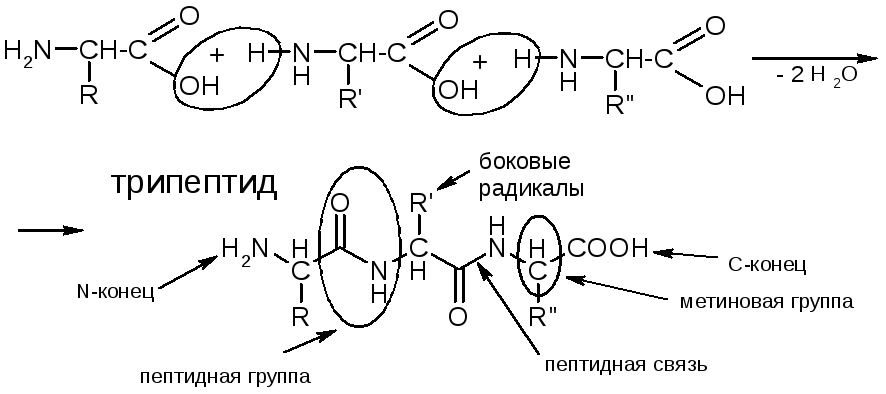
№7. Полипептиды и белки. Это полимеры, состоящие из остатков АК, связанных пептидными связями. Условно считают, что полипептиды - до 100 аминокислотных остатков, более 100– это белки. Олигопептиды – до 10 аминокислотных остатков.
Пептидная группа:
Вторичная структура. Делится на α-спираль и β-складчатую стр-ру. Строение пептидной группировки определяет пространственное строение полипептидной цепи. Спираль: Между С=О 1-го и N-H 5-го аминокислотных остатков образуются водородные связи, направленные почти параллельно оси спирали, они скрепляют спираль. Боковые радикалы R расположены по периферии спирали. |
|
Складчатая: вытянутые одна вдоль другой полипептидные цепи образуют водородные связи между собой. Многие белки имеют вторичную структуру с чередующимися фрагментами α-спирали и β-складчатой структуры. Третичная структура: α-Спираль, будучи достаточно протяженной, изгибаясь, складывается в клубок. Это происходит в результате взаимодействия боковых радикалов достаточно удаленных друг от друга. Образуется глобула. Виды связей: водородные между боковыми радикалами, ионные между боковыми радикалами, гидрофобное между неполярными радикалами, дисульфидные связи. Четвертичная структура – это агрегат глобул. Она формируется теми же видами взаимодействия, что и третичная структура. Биполярность и амфотерность:
Изоэлектрич. точка (рI) –значение рН, при котором суммарный заряд молекулы равен О. 1) Если кол-ва групп COOH и NH2 в молекуле одинаковы, то изолектрическая точка находится в области нейтрального рН (нейтральные АК). 2) Если преоблад. карбокс. группы, то изолектр. точка - в кислой области (кислые АК). 3) Если преоблад. аминогруппы, то изолектр. точка - в основной области (основные АК). 4) Если рН ниже ИЭТ - «+» заряд, если рН выше ИЭТ - «-» заряд. Всё это справедливо и для белков и полипептидов. |
|
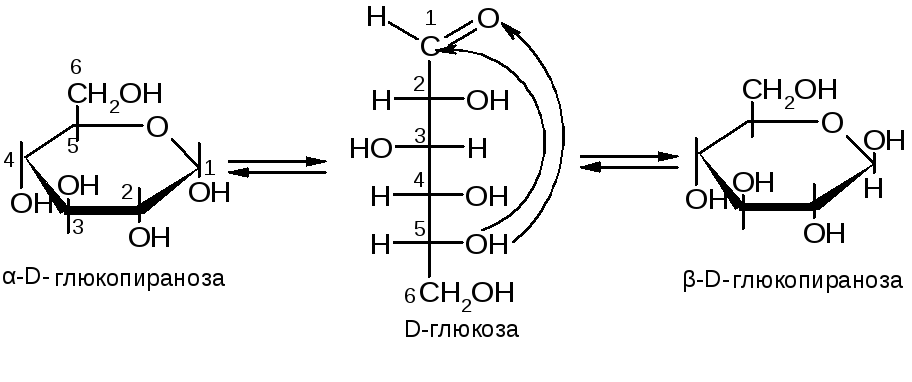
№32. Моносахариды Cn(H2O)n. Моносахариды – это вещества, содержащие оксогруппу и несколько (не менее двух) гидроксильных групп. Классификация и номенклатура: 1) по количеству атомов углерода: триозы, пентозы, гексозы и т.д. 2) по характеру оксогруппы: альдозы, кетозы. Обладают стереоизомерией. Принадлежность к стереохим. ряду опр-ся по конфигурации последнего хирального атома. Все природные моносахариды относятся к D-ряду.
Главный моносахарид – глюкоза:
Химические свойства определяются функциональными группами (С=О, ОН).
|
|
Образ-е гликозидов:
Образ-е простых эфиров (алкилир-е):
Образ-е слож. эфиров: Окисление:
Еще р-и восст-я: глюкоза, над стрелкой H2 и палладий, альд. группа восст. до спиртовой. |
|
№6. Моносахариды Cn(H2O)n. Моносахариды – это вещества, содержащие оксогруппу и несколько (не менее двух) гидроксильных групп. Классификация и номенклатура: 1) по количеству атомов углерода: триозы, пентозы, гексозы и т.д. 2) по характеру оксогруппы: альдозы, кетозы. Обладают стереоизомерией. Принадлежность к стереохим. ряду опр-ся по конфигурации последнего хирального атома. Все природные моносахариды относятся к D-ряду.
Фруктоза — структурный изомер глюкозы. Кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза. Химические свойства фруктозы обусловлены наличием кетонной и пяти гидроксильных групп.
При восстановлении карбонильной группы фруктозы образуются сорбит и маннит. Проба Селиванова — качественное обнаружение фруктозы. При нагревании пробы с фруктозой в присутствии резорцина и соляной кислоты появляется вишнево-красное окрашивание. Фруктозе свойственны реакции глюкозы (образование эфиров, брожение). |
|
№33. Моносахариды Cn(H2O)n. Моносахариды – это вещества, содержащие оксогруппу и несколько (не менее двух) гидроксильных групп. Классификация и номенклатура: 1) по количеству атомов углерода: триозы, пентозы, гексозы и т.д. 2) по характеру оксогруппы: альдозы, кетозы. Обладают стереоизомерией. Принадлежность к стереохим. ряду опр-ся по конфигурации последнего хирального атома. Все природные моносахариды относятся к D-ряду.
Химические свойства рибозы обусловлены наличием альдегидной и гидроксильных групп. При восстановлении рибозы образуется спирт —рибит НОСН2—(СНОН)3—СН2ОН, а при окислении — рибоновая кислота НОСН2—(СНОН)3—СООН. В растворе рибоза существует в ациклической и циклической формах: бета-Д-рибопираноза, альфа-Д-рибопираноза, бета-Д-рибоза, альфа-Д-рибоза. Реакции: окисление моносахаридов (например, «сереб. зеркало»); реакция спиртовых гидроксидов: а) взаимодействие с гидроксидом меди (II) с образованием алкоголята меди (II); б) образование простых эфиров; в) образование сложных эфиров при взаимодействии с карбоновыми кислотами — реакция этерификации; образование гликозидов); брожение. Брожение — это сложный процесс, при котором происходит расщепление моносахаридов под влиянием различных микроорганизмов.
|
|
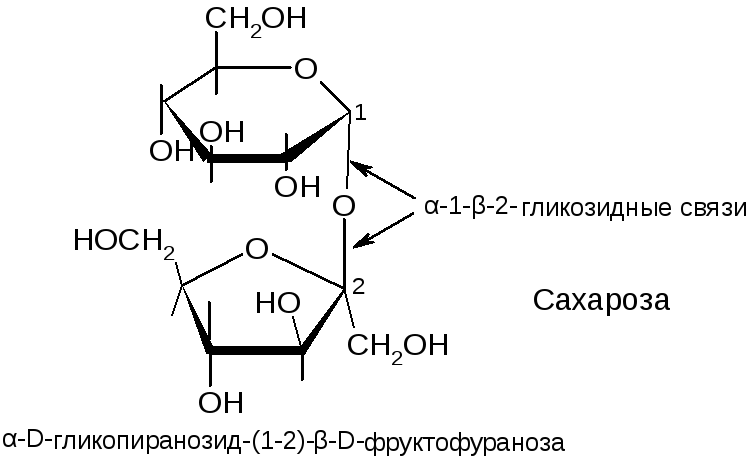
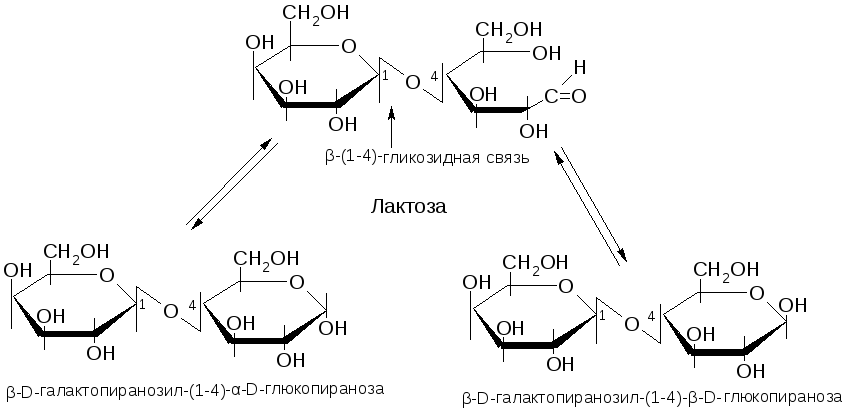
№5. Полисахариды. Это полимеры из моносахаридных остатков, связанных гликозидными связями. Классификация: 1) по числу моносахаридных остатков: олигосахариды и высшие полисахариды; 2) по строению остатков: гомополисахариды и гетерополисахариды. Дисахариды состоят из двух остатков, гликозидная связь образована гдикозидным гидроксилом одного остатка с гидроксилом второго остатка. Если в образ-и связи участвует один гликозидный ОН и один спиртовый ОН, то такие дисахариды восстан-ют реактив Фелинга и называются восстанавливающими. Если же в образ-и связи участвуют оба гикозидных ОН, то они называются невосстанавливающими. Восстанавливающие – мальтоза, целлобиоза, лактоза. Невосст. – сахароза. Высшие полисахариды. Гомополисахариды – крахмал, гликоген, целлюлоза, пектины, декстраны. Гетерополисахариды – гиалуроновая к-та, гепарин, хондроитин-сульфат. Крахмал состоит из двух фракций: амилозы и амилопектина. Структура амилозы – неразветвленная цепь, состоящую из 200-1000 остатков D-глюкопиранозы, соединенных α-(1→4)-гликозидными связями. Амилопектин построен из таких же цепей, как амилоза, но разветвленных. В местах ветвлений боковые цепи соединяются с основной α-(1→6)-гликозидными связями. Химические свойства:
|
|
№34. Полисахариды. Это полимеры из моносахаридных остатков, связанных гликозидными связями. Классификация: 1) по числу моносахаридных остатков: олигосахариды и высшие полисахариды; 2) по строению остатков: гомополисахариды и гетерополисахариды. Дисахариды состоят из двух остатков, гликозидная связь образована гдикозидным гидроксилом одного остатка с гидроксилом второго остатка. Если в образ-и связи участвует один гликозидный ОН и один спиртовый ОН, то такие дисахариды восстан-ют реактив Фелинга и называются восстанавливающими. Если же в образ-и связи участвуют оба гикозидных ОН, то они называются невосстанавливающими. Восстанавливающие – мальтоза, целлобиоза, лактоза. Невосст. – сахароза. Высшие полисахариды. Гомополисахариды – крахмал, гликоген, целлюлоза, пектины, декстраны. Гетерополисахариды – гиалуроновая к-та, гепарин, хондроитин-сульфат. Целлюлоза представляет собой длинные неразветвленные цепи, состоящие из остатков D-глюкопиранозы, соединенных β-(1→4)-гликозидными связями. Параллельные цепи скрепляются водор. связями, образуя волокнистую макроструктуру. Целлюлоза гидролизуется в кислой среде, при её полном гидролизе образуется глюкоза. Химическая модификация – образование простых и сложных эфиров целлюлозы по гидроксильным группам – дает большой ряд ценных в практическом отношении продуктов. Например:
Целлюлоза способна образовывать простые (метилцеллюлоза) и сложные (нитроцеллюлоза, ацетилцеллюлоза) эфиры. |
|
№4. Полисахариды. Это полимеры из моносахаридных остатков, связанных гликозидными связями. Классификация: 1) по числу моносахаридных остатков: олигосахариды и высшие полисахариды; 2) по строению остатков: гомополисахариды и гетерополисахариды. Высшие полисахариды. Гомополисахариды – крахмал, гликоген, целлюлоза, пектины, декстраны. Гетерополисахариды – гиалуроновая к-та, гепарин, хондроитин-сульфат. Дисахариды состоят из двух остатков, гликозидная связь образована гдикозидным гидроксилом одного остатка с гидроксилом второго остатка. Если в образ-и связи участвует один гликозидный ОН и один спиртовый ОН, то такие дисахариды восстан-ют реактив Фелинга и называются восстанавливающими. Если же в образ-и связи участвуют оба гикозидных ОН, то они называются невосстанавливающими. Восстанавливающие – мальтоза, целлобиоза, лактоза. Невосст. – сахароза. Химические свойства дисахаридов, в основном, повторяют химические свойства соответствующих моносахаридов. Отличительной реакцией является кислотный гидролиз, в результате дисахарид распадается на составляющие его моносахариды. Сахароза: Не проявляет восстанавливающих свойств - не реагирует с реактивом Фелинга. Не образует открытую форму, поэтому не проявляет свойств альдегидов и кетонов. Наличие гидроксильных групп в молекуле сахарозы легко подтверждается реакцией с гидроксидами металлов. Если раствор сахарозы прилить к гидроксиду меди (II), образуется ярко-синий раствор сахарата меди. Альдегидной группы в сахарозе нет: при нагревании с аммиачным раствором оксида серебра (I) она не дает «серебряного зеркала», при нагревании с гидроксидом меди (II) не образует красного оксида меди (I). |
|
Лактоза – восстанавливающий дисахарид (восстанавливает реактив Феллинга). Наиболее характерная реакция дисахаридов – кислотный гидролиз на моносахариды. Образует простые и сложные эфиры.
|
|
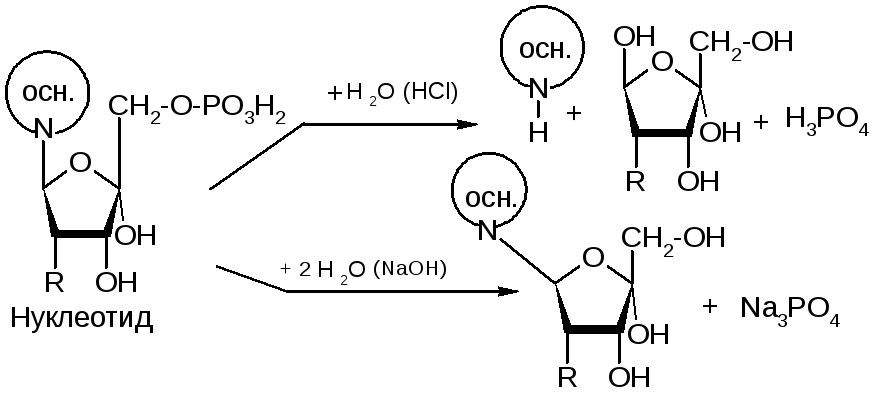
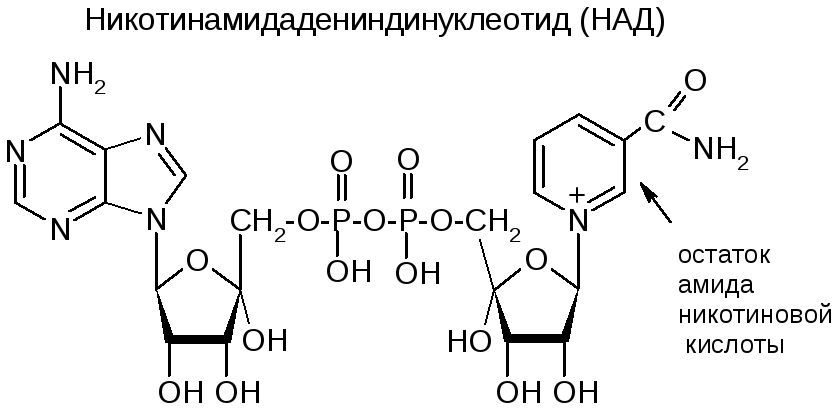
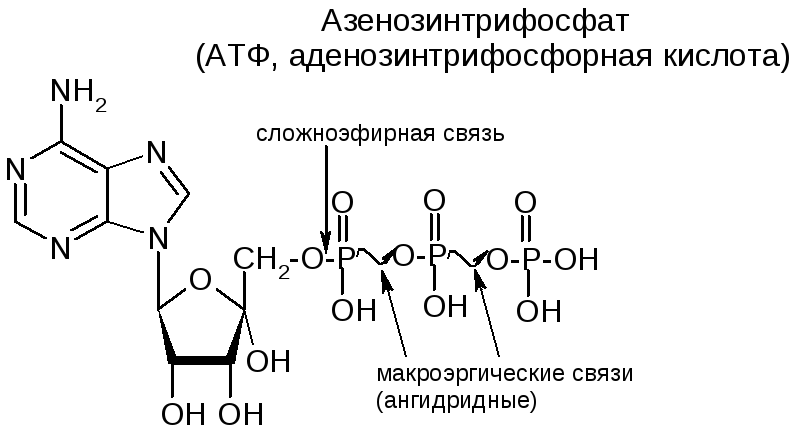
№35. Нуклеотиды – это соединения, сост. из остатков азотистого основания, углеводного остатка и фосфатной группы. Азотистые основания – это производные двух гетероциклов - пиримидина и пурина.
Нуклеозиды – это соединения, состоящие из остатков нуклеинового основания и углевода, связанных β-N-гликозидной связью.
Нуклеотиды – это нуклеозиды, содержащие фосфатную группу в 5'-положении).
|
|
Нуклеиновые кислоты – это полинуклеотиды – полимеры, состоящие из нуклеотидных остатков, связанных сахарофосфатными сложноэфирными связями. Виды НК: ДНК – содержат остатки 2’-дезоксирибозы, не содержат урацила; РНК – содержат остатки рибозы, не содержат тимина. Первичная структура ДНК – это определенный порядок последовательности нуклеотидов в цепи. Цепи НК содержат большое количество фосфатных остатков, обладающих высокой кислотностью и ионизированных в водной среде. Поэтому молекулы НК несут на себе большой отрицательный заряд, в выделяемых препаратах НК представляют собой натриевые соли. Сложноэфирные связи, соединяющие полинукл. цепи, неустойчивы в кислой и щелочной средах, и НК в этих условиях подвергаются гидролизу:
Вторичная стр-ра представляет собой спираль, состоящую из двух комплементарных друг другу и антипараллельных полинуклеотидных цепей ("двойная спираль"). |
|
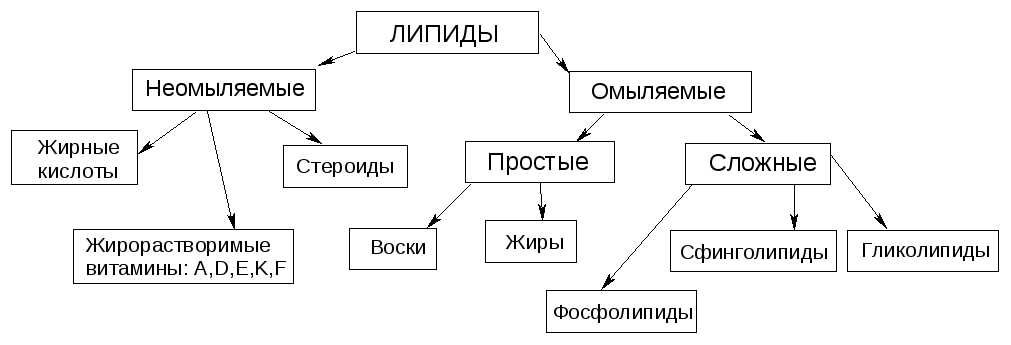
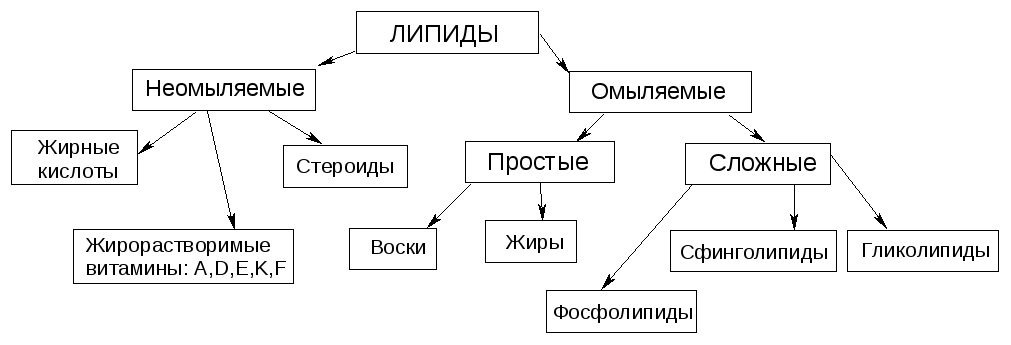
№3. Липиды – это группа природных веществ разнообразных по химическому строению и объединенных общим св-вом: хорошо растворимы в неполярных органических р-лях.
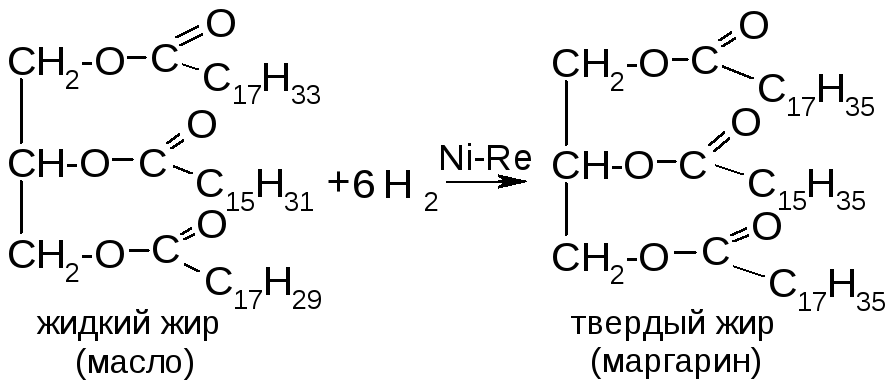
Жиры (триглицериды) – это сложные эфиры глицерина и высших жирных кислот. Консистенция жира зависит от насыщенности. Насыщенные триглицериды – твердые. Жирными кислотами называются монокарбоновые кислоты с длинной углеродной цепью и четным числом углеродных атомов. Хим. св-ва жиров:
Еще переэтерификация и галогенир-е (йодное число). |
|
№36. Липиды – это группа природных веществ разнообразных по химическому строению и объединенных общим св-вом: хорошо растворимы в неполярных органических р-лях.
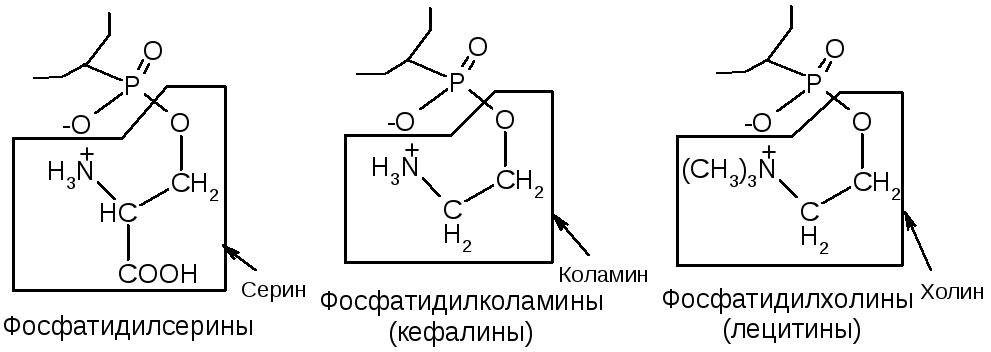
Фосфолипиды являются главным компонентом клеточных мембран, а также источником фосфата для организма. По химической структуре фосфолипиды – это производные фосфатидных кислот:
Хим. свойства – гидролиз. Кислотный – до глицерина, ЖК, аминоспирта и фосфорной к-ты. Щелочной – до глицерина, аминоспирта, солей ЖК и соли фосфорной к-ты. |
|
№2. Алкалоиды – большая группа природных соединений. Являются азотистыми основаниями и образуют соли с кислотами. Образуются в процессе биосинтеза из аминокислот. Различают истинные алкалоиды, протоалкалоиды (не содержат гетероцикла) и псевдоалкалоиды (образ. не из АК).
|
|
Химические реакции:
Общие химические реакции связаны с основностью. Исключение - те соединения, где N соседствует с С=О-группой или включен в ароматическую систему пиррола. Алкалоиды образуют растворимые соли с соляной кислотой, с орг. кислотами, это используется для извлечений растений. С комплекс. к-тами и к-тами Льюиса образуются мало растворимые и окрашенные комплексы, используются для качественного определения алкалоидов. |
|
№37. Изопреноиды – это обширная группа природных соединений. углеродный скелет изопреноидов состоит из звеньев изопрена. Изопреноиды подразделяются на терпены, каротиноиды и стероиды. В классе терпенов выделяются понятия собственно терпенов и терпеноидов. Терпенами называются углеводороды с углеродным скелетом, построенным из изопреновых звеньев, соединенных по принципу «голова к хвосту». Терпеноиды – это продукты, в которых терпеновая основа включает кислородсодержащие заместители. Терпены – вещества, не растворимые в воде и растворимые в неполярных органических растворителях. В зависимости от молекулярной массы и полярности это либо жидкости с различной Ткип, либо твердые вещества. Обладают запахом и широко применяются в парфюмерии. Терпены классифицируются: 1) по числу изопреновых звеньев: монотерпены – 2 изопреновых звена, сесквитерпены – 3 изопреновых звена, дитерпены – 4 изопреновых звена, тритерпены – 6 изопреновых звеньев, политерпены – высокомолекулярные полимеры (каучук) 2) по количеству циклов: ациклические, моноциклические, бициклические. Монотерпены:
|
|
Тетратерпены: Сесквитерпены:
|
|
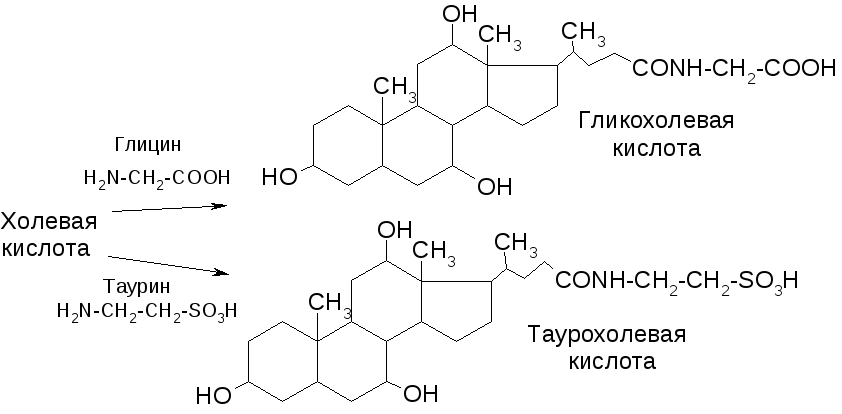
№1. Стероиды - группа биологически важных природных соединений, в основе структуры которых лежит скелет циклопентанопергидрофенантрена (стерана). Стероиды – это желчные кислоты, кортикостероиды, половые гормоны и др. Предшественником всех стероидов в организме является холестерин:
Желчные кислоты образуются в печени из холестерина. Наиболее распространенная из них – холевая кислота (остальные отличаются отсутствием одной или двух гидроксильных групп в положениях 7 и 12).
Кортикостероиды – это гормоны коркового вещества надпочечников. Делятся на две группы: глюкокортикоиды, регулирующие углеводный обмен и минералокортикоиды, регулирующие водно-солевой обмен. Структурной основой является прегнан.
|
|
Химические св-ва глюкокортикоидов: введение фтора в 9 положение (реакция с HF), окисление (вместо боковой цепи – карбокс. группа) и Минералокортикоиды:
Половые гормоны: женские (эстрогены – эстрадиол, эстрон и гестагены – прогестерон) и мужские (андрогены – андростерон и тестостерон).
|