
Лекция 08.Алкены, диены 21.08.09
.doc|
Лекция 8 |
Алкены. Алкадиены
Алкены
Углеводороды, содержащие двойную связь общей формулы – CnH2n. Гомологический ряд алкенов.
Изомерия алкенов

Физические свойства алкенов – см. учебник.
Способы получения алкенов
Алкены имеют большое практическое значение как промышленное сырьё для получения многих продуктов органического синтеза.
1. Промышленный способ получения – крекинг и дегидрирование алканов (см. ранее "Алканы").
2. Восстановление алкинов:
![]()

3.Дегидратация спиртов:
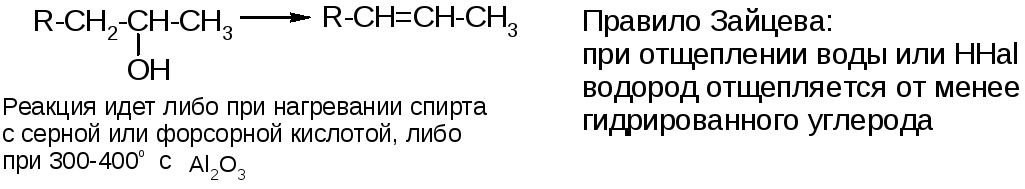
4. Дегидрогалогенирование галогеноуглеводородов:

5. Дегалогенирование вицинальных дигалогенопроизводных:

6. Расщепление четвертичных аммониевых оснований (р. Гофмана):

Химические свойства алкенов
Наиболее типичны для алкенов реакции присоединения (А) по схеме:

π-Связь легко поляризуется. Её атакуют электрофилы и радикалы (нуклеофилы - редко).
1. Реакции электрофильного присоединения (АЕ).
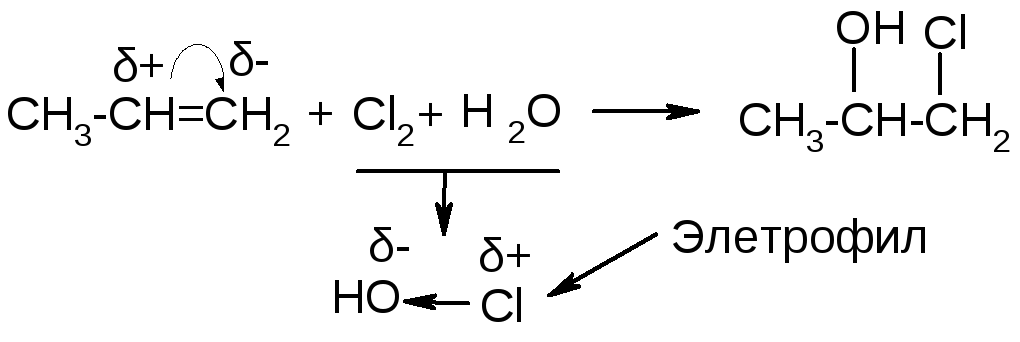
а) Наиболее часто используются реакции присоединения воды и галогеноводородов. В первом случае продуктами реакции являются спирты, во втором – галогенопроизводные.
Реакция проходит в сильно кислой среде, ион Н+ является атакующим электрофилом.
Механизм реакции:

Правило Марковникова:
При присоединении воды или галогеноводорода к алкенам водород присоединяется к наиболее гидрогенизированному атому углерода.
Правило Марковникова соблюдается для углеводородов и для тех производных, которые имеют у двойной связи электронодонорный заместитель. Например:

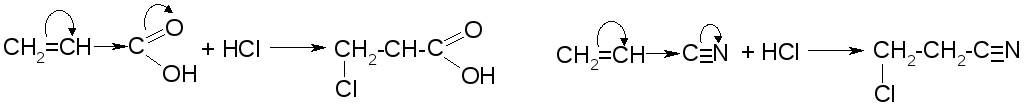
Для соединений, имеющих у двойной связи электроноакцепторный заместитель, реакция идет против правила Марковникова.
Например:
б) присоединение серной кислоты

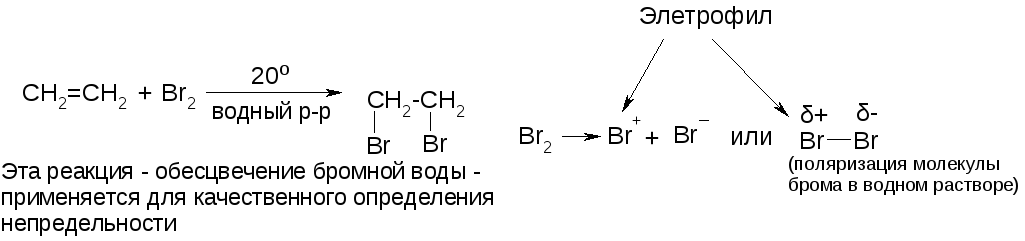
в) присоединение галогенов.
Реакция с фтором из-за слишком большой его активности проходит с разрывом С-С-связей и разрушением цепи. Лучше всего присоединяются хлор и бром. Реакция с иодом идет медленно и равновесно.
г) присоединение хлорноватистой кислоты.
Сравнительная реакционная способность алкенов в реакциях АЕ:

2. Реакции радикального присоединения (АR).
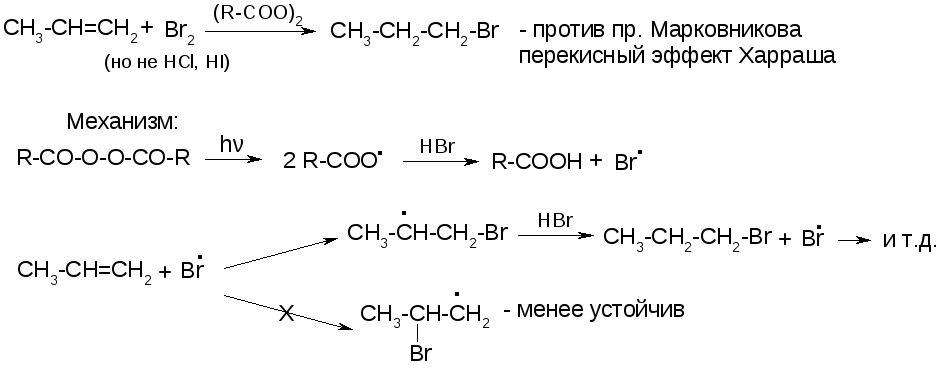
3. Реакции аллильного замещения

4. Окисление
а) эпоксидирование

б) гидроксилирование (реакция Вагнера)

в) озонолиз

г) жесткое окисление
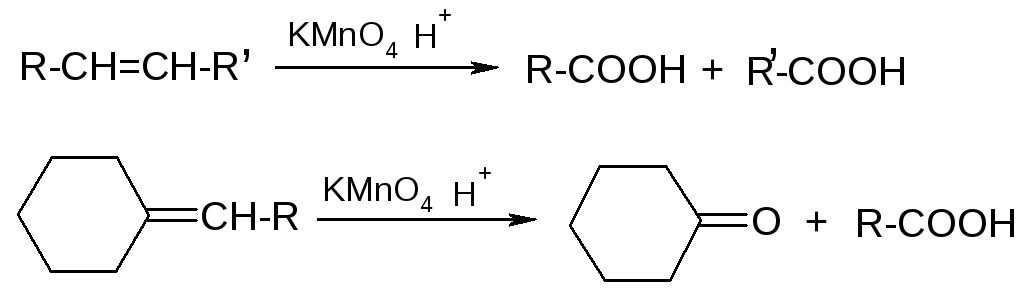
5. Восстановление

Отдельные представители алкенов – см. учебник.
Алкадиены
Изомерия алкадиенов:
- изолированные -СН=СН-СН2-СН=СН-
- кумулированные -СН=С=СН-
- сопряженные -СН=СН-СН=СН-
Свойства изолированных двойных связей не отличаются от свойств двойных связей в алкенах.
Кумулированные двойные связи имеют особую структуру:

Аллен неустойчив, при нагревании перегруппировывается в метилацетилен.
Наибольшее практическое значение имеют сопряженные диены.
Способы получения сопряженных алкадиенов
1. Широко применяются различные реакции элиминирования - дегидрирование, дегидрогалогенирование. Например:

2. Получение бутадиена по Лебедеву:
![]()
3. Бутадиен получают методом ступенчатого дегидрирования бутан-бутеновой фракции крекинга нефти. Аналогично из изопентан-изопентеновой фракции получают изопрен.
Бутадиен и изопрен широко используются для получения полимеров - каучуков.
Химические свойства сопряженных алкадиенов
1. Галогенирование
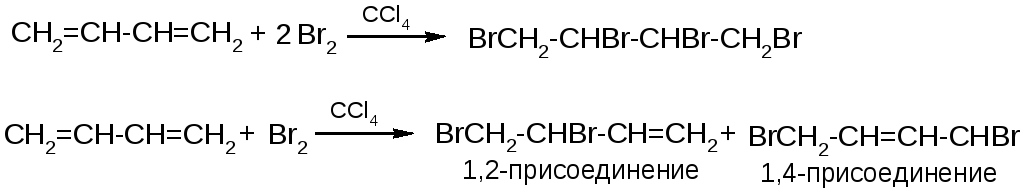

-
toC
1,2-изомер
1,4-изомер
+40
20%
80%
-80
80%
20%

При низких температурах преимущество имеет 1,2-изомер как более быстро образующийся (кинетический контроль), при высоких температурах преимущество переходит к 1,4 изомеру как более термодинамически устойчивому (термодинамический контроль).
2. Гидрогалогенирование

3. Циклоприсоединение (реакция Дильса-Альдера)

однако

Отдельные представители алкенов – см. учебник.
ЛИТЕРАТУРА:
1. Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. – Органическая химия (основной курс) – Дрофа, М., 2003 г., с. 182 – 214.
21.08.09
