
- •3 Основные электрохимические понятия
- •4. Контактное восстановление металлов. Причины. Качество контактно-осажденного Ме-ого покрытия.
- •6. Теория электрокристаллизации. Соотношение энергий образования зародыша Ме и его роста. Какие условия необходимо обеспечить для образования мелкокристаллических качественных покрытий?
- •7. Понятие рассеивающей способности электролитов для нанесения металлических покрытий. От каких факторов зависит рассеивающая способность электролита.
- •8.Теория блескообразования. Механизм действия блескообразующих добавок.
- •9.Явление питтинга, как дефекта гальванических покрытий. Причины питтинга и способы его устранения.
- •10 Закон фарадея. Расчет времени нанесения покрытий.
- •11 Механизм защиты от коррозии. Катодные и анодные покрытия. Требования к качеству покрытий анодного и катодного типа
- •12 Классификация условий эксплуатации изделий, буквенное и цифровое обозначение, выбор вида и толщины покрытия, совместимость металлов основы и покрытия.
- •14 Механическая подготовка поверхности.
- •17.Химический способ обезжиривания. Состав растворов химического обезжиривания и назначение компонентов.
- •18. Электрохимический способ обезжиривания. Состав растворов, назначение компонентов. Катодное и анодное обезжиривание. Достоинства и недостатки катодного и анодного способов обезжиривания.
- •20. Назначение травления. Травление в серной и соляной к-тах, достоинства и недостатки серной и соляной кислот. Ингибиторы травления, механизм их действия.
- •22 Назначение процесса активации. Растворы для активации
- •3. Слабокислые электролиты.
- •34 Свойства и назначение оловянных покрытий. Оловянная чума. Кислые и станнатные электролиты оловянирования. Электродные процессы. Особенности оловянирования латунных изделий
- •36. Серебрение. Назначение покрытий. Виды электролитов, цианистые и нецианистые электроли-ты. Катодные и анодные процессы. Влияние состава и режимов на качество покрытия.
- •38. Золочение.
- •40 Химическое никелирование
- •1.3. Свойства химических никелевых покрытий
3. Слабокислые электролиты.
КCl (калий хлоридные)
Аммиакатные
Аммиакатные электролиты
Zn образует с аммиаком комплексы.
[Zn(NH3)2]2+ Ку = 105
[Zn(NH3)3] Ку = 108
[Zn(NH3)4] Ку = 1010
Чем больше легантов, тем крепче комплекс. Прочность комплекса зависит от рН, чем щелочнее, тем прочнее!
В состав аммиакатных электролитов входят:
ZnCl2 – 100 г/л
NH4Cl – 200 г/л хлористый аммоний
БОД А (эмульгатор)
БОД Б (БОД)
рН = 5
iк = 0,8 …8 А/дм2
ВТ = 95…97%
К) [Zn(NH3)3] + 2е → Zn + 3NH3 ВТ = 97%
NH3 + Н2О → NH4ОН - нашатырный спирт
2Н+ + 2е → Н2 ВТ=3%
А) Zn – 2е + 3 NH3 → [Zn(NH3)3] 2+ ВТ = 100%
Благодаря высокой концентрации аммониевых солей (200-250 г/л), электропроводность аммиакатных электролитов на 30 - 40 % выше, чем у цианистых.
Максимальная константа устойчивости аммиакатных комплексов равна 3,5·1010, поэтому процесс осаждения цинка протекает с несколько меньшей поляризацией, чем в цианистых электролитах. Но благодаря высокой электропроводности рассеивающая способность этих электролитов достаточно велика.
Из-за высокой катодной поляризации на катоде помимо разряда цинка происходит достаточно интенсивный разряд водородных ионов, вследствие чего выход по току в цианистых электролитах значительно ниже, чем в кислых и колеблется в пределах 50-80 %.
Выход по току в аммиакатных электролитах достигает 98 %, поэтому наводораживание стальных деталей незначительно, что имеет большое значение припокрытии тонкостенных высоконапряжённых термообработанных деталей, особенно пружин.
Для аммиакатных электролитов разработаны высокоэффективные блескообразующие добавки, позволяющие получать качественные цинковые покрытия с очень высокой степенью блеска.
В аммиакатном электролите значительно легче покрывается чугун и стальные цементированные детали, тогда как в других электролитах при покрытии деталей с высоким содержанием углерода возникают проблемы, связанные с низким перенапряжением выделения водорода на углероде. В аммиакатных же электролитах оно значительно выше.
Несмотря на столь неоспоримые достоинства аммиакатных электролитов, в настоящее время наблюдается тенденция к их замене. Это связано с тем, что аммиакатные электролиты обладают рядом очень серьезных недостатков.
Достоинства:
достаточно высокая РС (обуслов. прочным комплексом)
зеркальные блеск (идеальный) (БОД)
высокий ВТ (обуслов.высоким перенапряжением выхода водорода, те выделение Н2 очень трудно, с большим энергетическим напряжением)
возможность покрывать чугун, высокоуглеродистые стали, цементированные и нитроцементир. (обусловлено высоким перенапряжением выделения Н2 на углероде)
широкий диапазон плотности тока iк = 1 …8 А/дм2 → выше скорость → выше производительность.
Высокая ПДК по загрязн.примесям (обусловл. более высокой пр-ть)
Недостатки:
очень высокая коррозионная агрессивность к оборудованию и упавшим на дно ванны деталям. Высокая агрессивность обусловлена высоким содержанием ионов аммония и ионов хлора;
трудность очистки СВ. добавляют щелочи до рН = 9,5 → все соединения Ме выпадают в осадок → верхний слой сливают, затем осадок выводят. Но при попадании в шлам NH3 все становится растворимым.
склонность к загрязнению примесями. Вследствие высокой коррозионной агрессивности, электролит быстро загрязняется примесями металлов. Большинство примесей не могут быть полностью удалены из ванны в процессе очистки из-за комплексообразования с аммиаком.
4. Цинкатные электролиты
Na2 [Zn(ОH)4], [Zn(ОH)4]2-
Состав:
оксид цинка, ZnO ≈10 г/л;
едкий натр, NaOH ≈100 г/л;
БОД
iк = 1 …10 А/дм2
ВТ = 60-90%
Т0 = 20-30 0С
Ку = 1016
В цинкатных электролитах цинк находится в виде комплексных анионов
[Zn(ОH)4]2-, образующихся при растворении оксида цинка в избытке NaOH:
ZnO + 2NaOH + H2О →Na2Zn(OH)4
Ку≈1016 , что близко к соответствующей величине для цианистого комплекса (≈1018), поэтому, казалось бы, на катоде должны получаться мелкокристаллические, плотные и качественные осадки. Но, к сожалению, этого не происходит. Несмотря на высокую катодную поляризацию цинк в отсутствии ПАВ на катоде выделяется в виде рыхлого губчатого осадка. Введение в электролит даже небольших количеств ПАВ позволяет получать очень качественные мелкокристаллические осадки.
К) [Zn(ОH)4]2- + 2е→Zn + 4OH-
Н2О +2е → Н2 +2ОН
А) Нормальное протекание анодного процесса (12) требует высокой концентрации свободной щелочи.
Zn + 4ОН – 2е → [Zn(ОH)4]2-
Как видно из реакции, на каждый ионизирующийся атом цинка должно приходиться как минимум четыре иона OH-. При недостатке гидроксильных ионов на поверхности анода образуется пленка нерастворимых гидроксидов.
Zn + 2ОН – 2е → Zn(ОH)4↓ (ведет к пассивации анода) – идет когда много Zn или мало ОН. Необходимо либо снижать анодную плотность тока, либо повышать концентрацию едкого натра.
Цинкатные электролиты, также как аммиакатные, отличаются высокой электропроводностью, это связано с тем, что концентрация NaOH в цинкатных электролитах, как правило, не ниже 100 г/л.
Выход по току в цинкатных электролитах зависит от плотности тока, причем с ростом плотности тока наблюдается очень сильное снижение выхода по току. Это обстоятельство обусловливает высокую рассеивающую способность, сопоставимую с рассеивающей способностью цианистых электролитов.
Достоинства цинкатных электролитов:
отсутствие коррозионной агрессивности по отношению к стали. Оборудование, трубопроводы, упавшие на дно ванны детали в щелочном электролите пассивны;
хороший блеск
высокая производительность
простота обезвреживания сточных вод. Ионы цинка легко гидролизуются, поэтому нейтрализация цинка в промывных водах происходит уже в ванне промывки;
высокая рассеивающая способность, обусловленная высокой прочностью комплекса; высокой электропроводностью;
мелкокристаллическая структура цинковых осадков, обусловленная высокой поляризацией;
электролит легко очищается от примесей. Примеси гидролизуются и выпадают в осадок непосредственно в ванне цинкования.
Недостатки цинкатных электролитов:
повышенная чувствительность к примесям. При появлении в электролите даже малых количеств Cr(VI), Pb2+, NO3- выход по току резко падает, на покрытии появляются черные пятна. Хром и нитраты попадают в ванну цинкования из ванны хроматирования. По этой причине ванны цинкования должны быть установлены так, чтобы исключить попадание в них хрома. Вследствие высокой концентрации щелочи электролит способен выщелачивать хром из нержавеющей стали, поэтому корпуса ванн, змеевики, насосы, фильтры, трубопроводы нужно изготавливать только из обычной углеродистой стали или чугуна. Свинец попадает в электролит либо из некачественных анодов, либо из низкосортного оксида цинка;
2. трудности при покрытии чугуна. Обусловлены пониженным перенапряжением выделения водорода на чугуне и высокоуглеродистых материалах. Для первоначального прокрытия чугуна используют либо толчок тока, либо анодную обработку в растворе NaOH с последующим цинкованием без промежуточной промывки;
3. водородная хрупкость. При работе на повышенных плотностях тока выход по току падает, поэтому при покрытии изделий из высокопрочных сталей и пружин возможно их наводороживание. С целью снятия водородного охрупчивания таких деталей, необходимо проводить операцию обезводороживания путем прогрева при температуре 180 - 200°С в течение 2 часов.
4. высокие требования к подготовке.
26 ПАССИВАЦИЯ ЦИНКОВЫХ ПОКРЫТИЙ, назначение пассивации, процессы протекающие при пассивации, влияние кислотности раствора на качество и толщину пас пленок, особенности ушки пас пленок. Разновидности пас пленок
Цинковые покрытия являются надежным средством защиты стали от коррозии, но при повышенной влажности цинковое покрытие подвергается коррозионному разрушению. Кроме того, свежеосажденное блестящее цинковое покрытие быстро тускнеет и очень сильно пачкается. Например, при захвате руками на нем остаются очень контрастные ничем не удаляемые отпечатки пальцев. Для повышения коррозионной стойкости и сохранения блеска цинковые покрытия всегда подвергают обработке в специальных пассивирующих растворах. С этой целью чаще всего используются растворы хромитирования, содержащие ионы Cr+3, азотную кислоту и различные добавки, позволяющие получать пассивные плёнки разных цветов и оттенков.
В результате взаимодействия с цинковым покрытием на его поверхности образуется беспористая прозрачная плёнка, содержащая в своём составе оксид трёхвалентного хрома (Cr2O3 × n H2O). Благодаря исключительно высокой твёрдости оксида хрома хромитная плёнка обладает очень высокой твёрдостью и износоустойчивостью.
До недавнего времени наиболее широко была распространена не хромитная, а хроматная пассивация в растворах, содержащих ионы Cr(Vl) и серную кислоту (рН раствора ≈ 1,8). Механизм образования пассивных плёнок в хроматных растворах изучен наиболее полно.
Первоначально при пассивации в хроматных растворах происходит окисление цинка ионами шестивалентного хрома по реакции
Na2Cr2O7 + 3Zn + 7H2SO4 → ZnSO4 + Сr2(SО4)3 + Na2SО4 + 7Н2О (14)
Одновременно происходит растворение цинка:
Zn + 2Н+ → Zn2+ + H2 (15)
Процесс сопровождается снижением кислотности в поверхностном слое до рН ≈ 4. Вследствие этого на поверхности происходит гидролиз Сг2(SО4)3 с образованием пленки с общей формулой Сr2О3·СrО3·nН2О. Толщина пассивной плёнки, как правило, составляет около 1 мкм.
Скорость образования пассивирующей пленки зависит от кислотности раствора. При пониженной концентрации кислоты скорость реакции (14) мала, и поэтому пленка получается слишком тонкой, либо вообще не образуется.
При слишком высокой кислотности происходит интенсивное растворение цинкового покрытия по реакциям (14) и (15), но гидролиза не происходит, и пленка также не образуется.
Таким образом, только при условии постоянной корректировки рН пассивирующего раствора возможно получение качественной пассивной пленки.
В настоящее время из-за повышенной токсичности шестивалентного хрома и трудностей при очистке сточных вод хроматную пассивацию стараются не применять, хотя качество хроматных плёнок выше, чем хромитных.
Свежие матовые и полублестящие цинковые покрытия имеют серый цвет, поэтому перед операцией пассивации проводят осветление в растворе HNO3. Из-за растворения цинка в растворе азотной кислоты операция осветления приводит к дополнительным потерям цинка. Для снижения количества операций осветление и пассивацию часто совмещают путем введения азотной кислоты в раствор пассивирования. Для блестящих покрытий процесс осветления не требуется. Растворы осветления и пассивирования очень чувствительны к примесям. Попадание в эти ванны даже малых количеств солей меди и других металлов приводит к потемнению цинкового покрытия.
Сушку хромитированных и хроматированных цинковых покрытий можно проводить при температуре не выше 55 °С. При более высоких температурах происходит интенсивная дегидратация пассивной пленки, и она разрушается. Кроме того, после сушки детали в течение нескольких часов рекомендуется не перетряхивать. За это время происходит отвердение пассивной пленки, и она становится более устойчивой к истиранию. Сцепление пассивной пленки проверяют с помощью мягкой карандашной резинки. Пленка не должна стираться.
Защитные свойства пленки определяют путем нанесения капли раствора уксуснокислого свинца (50 г/л). Время до почернения покрытия под каплей раствора пропорционально коррозионной устойчивости, оно не должно быть менее 60 с. Чёрное пятно появляется вследствие выделения контактного свинца на поверхности цинка.
28 НАЗНАЧЕНИЕ НИКЕЛЕВЫХ ПОКРЫТИЙ. Виды никелевых покрытий (многослойные, никель-сил). Электролиты никелирования их состав и назначение компонентов. Влияние различных факторов (состава электролитов, температуры, плотности тока, pH) на качество ник. покрытий. способы снижения внтр. напряж в гальванич. осадках путем использования различных БОД. Вредные примеси. Фильтрация, селективная очитска от мели и цинка, хим. очистка от железа, очистка от орган. примесей. Причины питтинга и способы его устранения.
Никелевые покрытия наносятся с целью защиты от коррозии и придания поверхности изделия декоративных качеств. Никелевые покрытия (особенно на черных металлах) отличаются высокой пористостью. С целью повышения сохранности блеска и придания голубого оттенка и на никелевое покрытие часто наносят очень тонкий слой (0,5 ¸ 1,0 мкм) хрома. Для обеспечения длительной сохранности декоративного вида на многие автомобильные детали наносятся многослойное покрытие (медь, никель, никель-сил, хром).
На Ni очень большая поляризация, поэтому используют сернокислый электролит:
NiSO4·7H2O-240 ¸ 340 г/л
NiCi2·6H2O-30 ¸ 60 г/л (депассиватор анодов)
H3BO3 - 30¸ 40 г/л (буферная добавка)
Блескообразователи (1,4бутиндиол, сахарин)
Антипиттинговые добавки (ПАВ улучшают смачивание)
Выравнивающие добавки (фталимид)
↓C(NiSO4)
→↓
 →↓
→↓
 →↓произвоительности
→↓произвоительности
↑ C(NiSO4) →солевая пассивация анодов
↓C(NiCl2) →пассивация анода
↑C(NiCl2) →↑корроз. агрессивности электролита (по отнош. к упавшим деталям, оборудованию)
к)

 , ВТ≈97%;
, ВТ≈97%;
 ,ВТ≈3%;
,ВТ≈3%;
↓C(H3BO3)→↑pH→гидролиз→дендриты
↑ C(H3BO3)→борная кислота более 40г/л не растворяется
Ni покрытия имеют напряжения растяжения, поэтому они склонны к растрескиванию
↓C(1,4бутиндиола) →↓блеска
↑C(1,4бутиндиола) →↓блеска и почернению осадка
1,4бутиндиол приводит к еще большему увеличению напряж.растяж.
Сахарин вводится для снижения внут.напряж.растяж, он дает внутр.напр.сжатия и поэтому компенсирует напр.раст от 1,4бутиндиола
↓C(сахарина)→внутр.напр.сжатия
↑C(сахарина)→внутр.напр.растяж
Фталимид вводят когда никелируют детали с ↑степенью шероховатости, когда нужно выравнивание
Режимы:

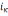 ≈
1-8 А/дм2
≈
1-8 А/дм2
pH≈4,5-5-слабокислое
t≈55-60°C
↓
 →↓производительности
→↓производительности
↑
 →дендриты,
пригар
→дендриты,
пригар
↓pH→↓ВТ(Ni) →больше выделяется водород
↑pH→гидратообразование
↓t°→↓
 →↓
производительности
→↓
производительности
↑ t°→↑испарение
Режимы работы электролитов и влияние различных факторов
рН электролита. Существенное значение для процесса никелирования имеет величина рН электролита. Из электролитов с рН < 3 никель практически не осаждается, а на катоде происходит разряд только ионов водорода.
Поскольку даже при рН > 6 восстановление никеля сопровождается выделением водорода, то вследствие подщелачивания на катоде образуются гидроксиды никеля, которые, включаясь в никелевые осадки, делают их шероховатыми, темными и хрупкими. Кроме того, образование в прикатодном слое гелеобразного гидроксида никеля затрудняет процессы диффузии и миграции ионов никеля к катоду, что вызывает резкое обеднение прикатодного слоя ионами никеля, снижается выход по току и происходит еще более сильное защелачивание прикатодного слоя. Таким образом, ситуация усугубляется.
Оптимальный интервал рН электролита никелирования находится в пределах 4,5 ¸ 5,0. Если рН электролита близко к 5,0, то работать можно только на малых плотностях токаю При высоких плотностях тока за счёт более интенсивного выделения водорода происходит подщелачивание прикатодного слоя, образующиеся гидроксиды никеля обволакивают осадок и покрытие становится хотя и блестящим, но с мутным беловатым налетом, а при очень высоких плотностях тока – вообще темным. При работе с электролитом с рН, близким к 5,0, в состав электролита необходимо включать 5 ¸ 6 г/л фторида калия (о его действии сказано выше).
Если же рН электролита близок к 4,5, то работать желательно при больших плотностях тока (4 ¸ 6 А/дм2), это позволяет интенсифицировать процесс и несколько увеличить выход по току. Особенностью электролитов с низким рН является пониженный катодный выход по току и повышенный анодный. Неравенство выходов по току, как правило, не приводит к увеличению концентрации ионов никеля в электролите, так как разница выходов по току компенсирует потери никеля за счёт уноса с деталями и подвесками в промывные воды.
Необходимо отметить, что использование более кислых электролитов за счёт увеличения доли выделяющегося водорода повышает вероятность возникновения питтинга. Поэтому более кислые электролиты нужно более тщательно чистить от органических загрязнений, вызывающих появление питтинга.
Температура электролита. Оптимальная температура электролита 50 ¸ 60 ºС. Увеличение температуры позволяет работать при более высоких плотностях тока, увеличить выход по току, снизить питтингообразование. Увеличение температуры выше 60ºС нежелательно из-за сильного испарения.
Плотность тока. Оптимальная плотность тока при никелировании находиться в интервале от 3 ¸ 5 А/дм2. Плотность тока сильно зависит от кислотности раствора. Чем выше кислотность электролита, тем выше допустимая плотность тока. Кроме того, плотность тока зависит от температуры электролита и перемешивания. Так, при рН электролита равном 4,6, температуре электролита 60ºС и при интенсивном перемешивании электролита можно получать осадки высокого качества при плотностях тока 5 А/дм2 и даже выше.
Следует помнить, что никель чрезвычайно склонен к пассивации. Пассивация никелевого покрытия наступает через несколько секунд после прерывания тока. По этой причине при никелировании не допустимы перерывы тока, а тем более – реверс. В случае перерыва тока никель, осажденный на запассивированную поверхность, имеет очень плохое сцепление и, как правило, неизбежно будет шелушиться.
Перемешивание электролита помимо интенсификации процесса облегчает отрыв пузырьков водорода от поверхности деталей и этим позволяет снизить вероятность питтинга.
Примеси. Никелевые электролиты очень чувствительны к примесям. Так, наличие железа в электролите приводит к отслаиванию и растрескиванию покрытия.
Органические примеси могут привести к образованию питтинга и, как следствие, к точечной пористости. Примесь меди и цинка вызывает образование пятнистости, полосчатых темно-серых и даже черных осадков никеля. При загрязнении электролита механическими примесями (частички шлама, пыль) образуются шероховатые покрытия
Примеси меди и цинка удаляются из раствора путем селективной очистки, т.е. проработкой постоянным током при ik = 0,1 ¸ 0,2 А/дм2. Для этого на катодные штанги завешиваются гофрированные стальные катоды, имеющие большую поверхность, чем плоские катоды. С целью снижения вероятности совместного выделения никеля электролит иногда подкисляют до рН=3. Проработку проводят до тех пор, пока на катоде не начнет выделяться светлый осадок никеля.
Очистка электролита. Примеси меди и цинка удаляются из раствора путем селективной очистки, т.е. проработкой постоянным током при ik = 0,1 ¸ 0,2 А/дм2. Для этого на катодные штанги завешиваются гофрированные стальные катоды, имеющие большую поверхность, чем плоские катоды. С целью снижения вероятности совместного выделения никеля электролит иногда подкисляют до рН=3. Проработку проводят до тех пор, пока на катоде не начнет выделяться светлый осадок никеля.
Для удаления железа в раствор при рабочем рН вводят перекись водорода(H2O2), которая окисляет ионы двухвалентного железа до трехвалентного, и при этом последние выпадают в осадок в виде Fe(OH)3. Выпавший гидроксид отфильтровывается. Процесс гидратообразования проходит довольно медленно, поэтому после введения окислителя (H2O, KMnO4) фильтрацию следует проводить не ранее, чем через сутки.
Органические примеси, вызывающие питтинг и пористость, удаляют путем окисления их перекисью водорода или перманганатом калия с последующей обработкой активированным углем.
Для удаления механических примесей электролит должен либо непрерывно, либо периодически фильтроваться.
Залогом качественного никелевого покрытия является кристальная прозрачность электролита и соответствие рН норме.
30 Назначение хромовых покрытий. Физико-химические свойства хромовых покрытий. Особенности выделения хрома на катоде. Типы электролитов. Катодные и анодные процессы. Влияние состава электролитов и режимов электролиза (температура, плотность тока) на свойства и структуру хромовых покрытий. Способы повышения равномерности толщины покрытий.
CrO3 = 100-150 г/л, H2SO4=1-5г/л, Соотношение 1:100, Cr^3+
К: Cr(VI) +6e = Сr ВТ=15% !
Cr(VI) +3e = Сr^+3 ВТ=10%
2H^+ +2e = H2 ВТ=75%
А: H2O-2e=1/2 O^2 + 2H^+ ВТ=90%
Сr^3+ - 3e =Cr (VI) Вт=10%
Влияние
режимов электролиза на качество Cr
осадков. Iк=30-100
А/дм^2 (50-60), Т=50-60 С +/- 3
Гексагональная структура, плотность 3 г/см^3
По рисунку:
Серый Cr– в области высоких плотностей тока и низких температур
Образуетсся молочный Cr, структура ОЦК, плотность = 7 г/см^3, мягкий, не блестящий, для специальных и декоративных целей.
Область блестящего Cr
Электролиты хромирования
Стандартный – сульфатный H2SO4 = 1-5 г/л, CrO3 = 100-500 г/л, Сr^3+ - в основных применяется на заводах
Саморегулирующийся CrO3 = 250-300 г/л, SrSO4 = 5-6г/л, Ca2SiF = 18-20 г/л. Применяется редко, т.к. разрушает свинец, разрушается катод, загрязняется свинцом.
Тетрахроматный – получаются матовые осадки, меньше блеска, Т=20 С.
Технологический процесс хромирования.
Шлифование
Обезжиривание
Предварительный прогрев детали в горячей воде или хромирование до необходимой температуры
Хромирование
32 Назначение медных покрытий. Простые кислые и комплексные электролиты меднения. Катодные и анодные процессы при меднении в кислых и цианистых электролитах. Причины необходимости введения избытка свободного циана. Способы меднения стальных деталей.
Главное назначение - подслой под никель. Е=+- 0,34 В
Электролиты меднения. Сернокислые. CuSО4*5H2O=150-250г/л, H2SО4=40-70г/л, БОД, Т=20-50 С, iк=2-6 А/дм^2, ВТ=100%.
Cu^2+ + Cu = 2Cu^+ вредна для электролита меднения, может проходить гидролиз.
CuSО4 + H2O = H2SO4 + Cu2O↓ в результате в растворе образуется закись меди (мутный). Необходимо повысить концентрацию H2SO4 – увеличит электропроводность, Н2 выделяться не будет, т.к. медь более электроположительна.
↑CuSO4 → ↓ iк → ↓производительность; ↓CuSO4 → пассивация анода, потери в промывку; ↑H2SO4 → ↓растворимости CuSО4 → солевая пассивация; ↓H2SO4 → образуется Cu2O↓ (дендриты), ↓электропроводимости; Произв.растворимости=[Сu^2+][SO4^2-]=const; ↑ iк→дендриты, ↓ iк→↓производительность; ↑Т →↓блеска,↑испарения; ↓Т→↓ iк→↓производительность.
Способы
меднения стальных деталей в сернокислом
электролите. Перед меднением наносят
слой матового Ni
без БОД (частично пассивируется, поэтому
на нем Cu
контактно не выделяется). Сначала
стальную деталь покрывают в CN
электролите медью – очень прочный
комплекс. Из CN
электролита делают затяжку, затем можно
сделать слой в сернокислом электролите.
Cu
может образовывать комплексы в CN
электролите, в нем она всегда одновалентна.

[Cu(CN)2]^- К..уст=10^24 , [Cu(CN)3]^2- К..уст=10^29 , [Cu(CN)4]^3- К..уст=10^31 ВТ ниже. Чем больше NaCN, тем прочнее комплекс.
CuCN =20-70 г/л, NaCN =5-25 г/л, NaOH=5-15 г/л, Iк=1-5 А/дм^2, T=20-50 С, pH=10-11, ВТ=40-90%
К: [Cu(CN)3]^2- +e = Cu + 3CN^-
У катода [Cu(CN)2]^- + CN^- = [Cu(CN)3]^2- разряжается
A: Cu +2CN^- - e = [Cu(CN)2]^-
Если свободных NaCN мало, то на аноде пассивация
Cu+CN^- - e = CuCN ↓
