
- •2.23. Уравнение Ван-дер-Ваальса
- •2.24. Внутренняя энергия реального газа
- •2.25. Метастабильные состояния
- •2.26. Тройная точка
- •2.27. Фазовые переходы I и II рода
- •2.28. Эффект Джоуля – Томсона
- •При этом над системой совершается работа
- •2.29. Поверхностное натяжение.
- •2.30. Термодинамика поверхности раздела фаз
- •2.31. Сверхтекучесть гелия
2.26. Тройная точка
В однокомпонентном веществе кривая испарение –конденсация имеет конец в виде критической точки. Кривая «плавление –кристаллизация», а также кривые перехода между кристаллическими состояниями, различной структуры, могут либо уходить в бесконечность, либо заканчиваться тройной точкой.
Тройной, на диаграмме Р –Т, называют точку, в которой возможно равновесие трех фаз однокомпонентного вещества.
Правило фаз Гиббса: в веществе, состоящем из k компонентов, одновременно могут существовать не более k + 2 равновесных фаз , т. е.
k + 2.
Из правила фаз Гиббса следует, что однокомпонентное вещество в равновесии не может иметь более трех фаз.
Например, пар, вода и лед могут находиться в равновесии при давлении 6,09103 бар при температуре t = + 0,01 оС (рис. 2.13).
Рис.
2.13

Так как тройным точкам соответ-ствует вполне определенная температура, то их используют в качестве стандартных (реперных) точек температурной шкалы.Из фазовой Р –Т диаграммы (рис. 13.13) видно, что вещество при нагревании не обязательно должно проходить стадию жидкого состояния для того, чтобы превратиться в газ. При нагревании до давления ниже тройной точки, твердое тело непосредственно переходит в газ (сублимация, или возгонка). Кривая равновесия фаз «жидкость –газ» заканчивается критической точкой К.
Рис. 2.14
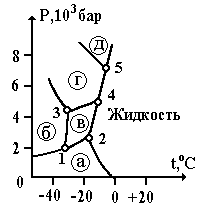
Фазовые диаграммы могут иметь несколько тройных точек, что связано с наличием нескольких модификаций вещества в твердом состоянии (полиморфизм).
На рис. 2.14 приведена фазовая диаграмма воды в координатах Р –t.
Буквами а, б, в, г, д обозначены различные модификации льда, а цифрами 1, 2, 3, 4, 5 –тройные точки. Область (а) соответствует обычному льду. Область пара не указана из-за малого масштаба рисунка. Переходы между различными кристаллическими модификациями сопровождаются образованием метастабильных состояний. Но в отличие от газовых и жидких состояний, которые возникают в достаточно чистых системах, метастабильные кристаллические состояния часто встречаются и оказываются практически устойчивыми. Это объясняется особенностями кристаллических структур из-за малой подвижности частиц в кристаллах.
2.27. Фазовые переходы I и II рода
Существуют фазовые переходы первого и второго рода.
Фазовый переход I рода
Фазовым переходом первого рода называют процесс, при котором скачком изменяются внутренняя энергия, плотность, энтропия и другие свойства физической системы.
Процесс перехода I рода сопровождается поглощением или выделением тепла (теплота фазового перехода).
Примерами фазового перехода I рода являются:
Изменения агрегатного состояния вещества: превращение жидкости в газ (испарение) и обратный процесс превращение газа в жидкость (конденсация).
Переход вещества из твердого состояния в жидкое (плавление) и обратный переход из жидкого в твердое состояние (кристаллизация).
Превращение твердого тела непосредственно в газ (сублимация или возгонка).
Например, для превращения 1 кг воды в пар нужна энергия Q = 2,3106 Дж. Эта энергия необходима для преодоления сил притяжения, действующих между молекулами воды.
Полиморфные превращения из одной кристаллической модификации в другую также относятся к фазовым переходам I рода, например, полиморфное превращение алмаза в графит и обратно.
Фазовый переход II рода
Фазовым переходом второго рода называют процесс, при котором скачком изменяется зависимость свойств вещества от температуры и давления.
При фазовых переходах второго рода энтропия, плотность, внутренняя энергия скачка не испытывают.
Поэтому фазовые превращения II рода не сопровождаются поглощением или выделением тепла.
К фазовым переходам II рода относят:
Переход жидкого гелия в сверхтекучее состояние.
Переход некоторых металлов и сплавов из нормального состояния в сверхпроводящее состояние.
Переход магнитного вещества из ферромагнитного состояния в парамагнитное состояние при нагревании магнетика до определенной температуры, называемой точкой Кюри.
