
Квантовая физика
___________________________________________________________________________________________________________________________________________________________
Лекция 11
5. Уравнение шредингера
5.1. Временное и стационарное уравнения Шредингера
Любое состояние микрочастицы в квантовой механике определяется волновой функцией (амплитудой вероятности).
В нерелятивистском случае уравнением движения микрочастицы является временное уравнение Шредингера
![]() (5.1)
(5.1)
где
![]()
оператор
Лапласа;
i
=![]()
мнимая единица; h
постоянная Планка; Wp(x,
y,
z,
t)
потенциальная энергия частицы в силовом
поле; m
масса частицы;
= (х,
у, z,
t)
= (r,
t)
волновая функция частицы; r
= (х, у, z)
пространственная координата и время
t.
мнимая единица; h
постоянная Планка; Wp(x,
y,
z,
t)
потенциальная энергия частицы в силовом
поле; m
масса частицы;
= (х,
у, z,
t)
= (r,
t)
волновая функция частицы; r
= (х, у, z)
пространственная координата и время
t.
Справедливость уравнения Шредингера (оно постулируется, а не выводится) доказывается тем, что выводы квантовой механики, полученные на основании этого уравнения в атомной и ядерной физике, находятся в полном согласии с экспериментальными данными.
Стационарное уравнение Шредингера имеет вид
![]() ,
(5.2)
,
(5.2)
где W = const полная энергия частицы.
Уравнение (5.2) справедливо для любой квантовой частицы движущейся со скоростью v < c и характеризуется следующими свойствами:
функция должна быть однозначной, непрерывной, конечной;
производные

непрерывны;
непрерывны;функция 2 должна иметь конечный интеграл.
Волновое уравнение Шредингера (волн де Бройля) имеет аналогичный вид, как и все волновые уравнения любой физической природы.
Таким образом, электрон в атоме существует не в виде частицы, а в виде волны де Бройля (волны вероятности).
Движение электрона (любой другой микрочастицы) должно подчиняться волновому уравнению Шредингера.
В случае движения частицы вдоль оси Х волна де Бройля имеет вид плоской волны:
![]() ,
(5.3)
,
(5.3)
где Wp(x) потенциальная энергия взаимодействия электрона и ядра, удаленные на расстояние х.
Из классической физики следует, что уравнение колебаний, например, струны, описывается формулой
![]()
или
![]() ,
(5.4)
,
(5.4)
где
![]()
волновое число; 0 собственная циклическая частота колеблющейся системы.
Некоторые решения уравнения (5.4) [функции s(x)] приведены на рис. 5.1, а. Графики имеют вид синусоид, и смысл их очевиден: они изображают форму струны в какой-то момент времени, т. е. моментальную фотографию процесса ее колебаний.
Форма колебаний струны определяется числом узлов k, т. е. числом точек, остающихся неподвижными в процессе колебания.
Им соответствует бесконечный набор решений s(x), которые различаются только числом узлов.
Уравнение Шредингера (5.3) можно представить в виде
![]() ,
(5.5)
,
(5.5)
где
![]() .
(5.6)
.
(5.6)
Следовательно, по форме уравнение (5.5) мало отличается от уравнения струны (5.3).
Если электрон движется свободно, то Wp(x) = 0, поэтому его полная энергия W = Wk, и следовательно, длина волны электрона постоянна:
![]()
и равняется длине волны де Бройля.
В этом случае уравнение Шредингера в точности совпадает с уравнением струны.
а
б


Рис. 5.1
При движении электрона в атоме он взаимодействует с ядром (например, с протоном в атоме водорода) по закону Кулона и его потенциальная энергия
![]() ,
(5.7)
,
(5.7)
где е элементарный заряд, равный заряду протона и электрона (по модулю).
В этом случае длина волны де Бройля
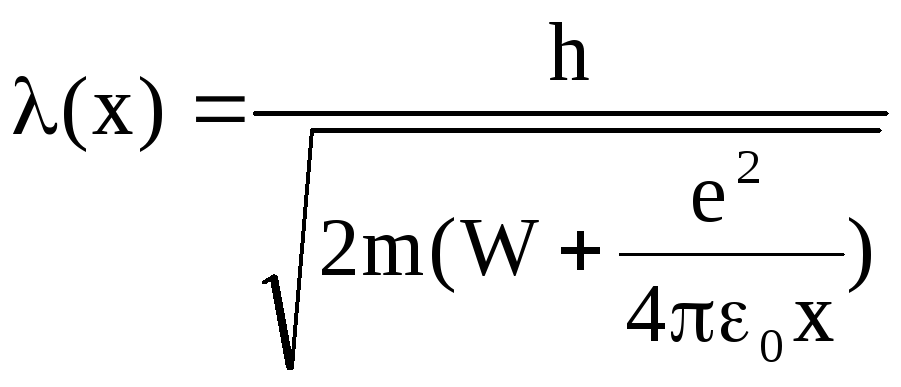 (5.8)
(5.8)
не имеет определенного значения и меняется от точки к точке.
Несколько решений уравнения (5.5), т. е. функции n(x), изображено на рис. 5.1, б, где n = 1, 2, 3, ... главное квантовое число, характеризующее энергию электрона в атоме.
В теории колебаний струны возникает такой случай: если колеблется струна со всевозможными грузами и утолщениями на ней, то ее колебания описываются аналогичным волновым уравнением.
Таким образом, уравнение Шредингера имеет решение не всегда, а только при определенных значениях энергии Wn, которым соответствуют собственные функции n(x), зависящие от n.
Дискретные значения энергии Wn стационарных состояний электрона в атоме, характеризуются квантовым числом n, т. е.
![]() ,
,
где 0 электрическая постоянная; Z порядковый номер элемента в периодической системе Д.И. Менделеева; m масса электрона; е заряд электрона.
Согласно квантовой механике атом не имеет определенных размеров, который определяется состоянием электронов в атоме.
Положение электрона в атоме подчиняется вероятностным законам.
Электрон в атоме представляется в виде электронного облака, и где он находится, в данный момент времени точно указать нельзя, т. е. понятие орбиты в квантовой механике не имеет смысла.
Причина устойчивости атома заключается в его движении и неизменности квантовомеханических законов, управляющих этим движением.
Причем квантовая устойчивость атома значительно надежнее, чем динамическая устойчивость классической механики, так как разрушенный атом восстанавливает свою структуру.
Вывод: Каждая квантовомеханическая система характеризуется своим энергетическим спектром.
В зависимости от вида потенциальной энергии (т. е. от характера взаимодействия в системе) энергетический спектр может быть либо дискретным (как у свободной частицы), либо смешанным (например, энергетические уровни атома при энергиях возбуждения, меньших энергий ионизации, дискретны, а при больших энергиях непрерывны).
Характер квантовомеханического движения можно понять на примере одномерного движение частицы (например, вдоль оси X) в случае, когда потенциальная энергия Wp зависит только от координаты х.
Уравнение Шредингера (5.5) сводится к уравнению
![]() ,
(5.9)
,
(5.9)
где выражение
р2(х) = 2m[W Wp(x)]
совпадает с формулой квадрата классического импульса частицы в точке с координатой х.
Таким образом, волновая функция и является той величиной, которая позволяет отыскать все вероятности.
Из всех квантовых вероятностей в учебном пособии используется только одна, которая описывает распределение координат частиц.
Для одномерного движения:
вероятность нахождения частицы в интервале (х, х + dx) в момент времени t равна
(х, t)2dx,
где
(х, t)2 = * (х, t) (х, t)
квадрат модуля волновой функции
[* (х, t) комплексное сопряжение волновой функции (х, t)].
С помощью волновой функции (х, t) среднее значение координаты определяется по формуле
![]() .
.
