
Конспект лекций по физике 3 части / Лекция 14 2007 опт
.doc
Квантовая механика
___________________________________________________________________________________________________________________________________________________________
Лекция 14
![]() МОЛЕКУЛЫ И МОЛЕКУЛЯРНЫЕ СПЕКТРЫ
МОЛЕКУЛЫ И МОЛЕКУЛЯРНЫЕ СПЕКТРЫ
8.1. Физическая природа химической связи
Молекула – устойчивая структура, состоящая из атомов. При сближении атомов и образования молекул волновые функции сильно изменяются, что и приводит к возникновению между ними химической связи.
Существуют четыре вида химических связей атомов и молекул: ван–дерваальсова; ионная; ковалентная; металлическая.
-
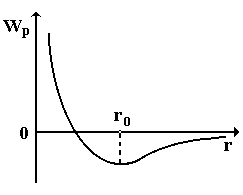
Рис. 8.1
Ван – дер – Ваальсова химическая связь характерна для электрически нейтральных атомов, не имеющих электрического дипольного момента.
Силу притяжения называют дисперсионной.
Для полярных систем с постоянным дипольным моментом, преобладает ориентационный механизм химической связи Ван – дер – Ваальса.
Для молекул с высокой поляризацией характерен индуцированный электрический момент при сближении молекул на достаточно близкое расстояние. В общем случае могут возникать все три вида механизма химической связи Ван – дер – Ваальса, которая слабее всех остальных видов химической связи на два – три порядка.
Полная энергия взаимодействия молекул с химической связью Ван – дер – Ваальса, равна сумме энергий дисперсионного, ориентационного и индуцированного взаимодействий.
-
Ионная (гетерополярная) химическая связь возникает, если один атом способен передавать другому атому один или несколько электронов.
В результате возникают положительно и отрицательно заряженные ионы, между которыми устанавливается динамическое равновесие. Такая связь характерна для галоидов и щелочных металлов. Зависимость Wp(r) для молекул с ионной связью приведена на рис. 8.1. Расстояние r0 соответствует минимуму потенциальной энергии.
-
Ковалентная (гомеополярная) химическая связь или атомная связь возникает, когда взаимодействуют атомы с близкими свойствами.
При взаимодействии появляются состояния с повышенной плотностью электронного облака и появления обменной энергии.
В квантовой теории показано, что обменная энергия является следствием тождественности близко расположенных частиц.
Характерной особенностью атомной связи является ее насыщаемость, т. е. каждый атом способен образовать ограниченное число связей.
-
В металлической химической связи участвуют все атомы кристалла, и обобществленные электроны свободно перемещаются внутри всей решетки кристалла.
8.2. Молекула водорода
Молекулу водорода связывают силы, приводящие к этой связи, являются обменными, т. е. для рассмотрения требуется квантовый подход.
Используя теорию возмущений Гейтлер и Ф. Лондон в 1927 г. решили в приближенном варианте.
В квантовой механике задача о молекуле водорода сводится к решению уравнения Шредингера для стационарного состояния.
Используя адиабатическое приближение, т. е. рассмотрим волновую функцию как функцию только координат электронов, а не атомных ядер.
Полная волновая функция зависит не только от пространственных координат электронов, но и от их спинов и является антисимметричной.
Если учитывать только волновую функцию электрона задачу можно решить, если учесть 2 случая:
-
Спиновая волновая функция антисимметрична, а пространственная волновая функция – симметрична и суммарный спин двух электронов равен нулю (синглетное состояние).
-
Спиновая волновая функция симметрична, а пространственная волновая функция – антисимметрична и суммарный спин двух электронов равен единице и может ориентироваться тремя различными способами (триплетное состояние).
В симметричном состоянии, когда спиновая волновая функция антисимметрична и в нулевом приближении получается симметричная пространственная волновая функция с разделяющимися переменными.
В триплетном состоянии, когда спиновая волновая функция симметрична, получается антисимметричная пространственная волновая функция.
Из-за тождественности электронов, возникает обменное взаимодействие, которое проявляется в вычислениях из-за использования симметричной и антисимметричной пространственных волновых функций.
При сближении атомов в синглетном спиновом состоянии (спины антипараллельны) энергия взаимодействия сначала убывает, а затем быстро растет. В триплетном спиновом состоянии (спины параллельны) минимум энергии не возникает.
Равновесное положение атома существует только в синглетном спиновом состоянии, когда энергия обращается в минимум. Только в этом состоянии и возможно образование атома водорода.
8.3. Молекулярные спектры
Молекулярные спектры возникают в результате квантовых переходов между уровнями энергий W* и W** молекул согласно соотношению
h = W* W**, (8.1)
где h энергия испущенного или поглощаемого кванта частоты .
Молекулярные спектры сложнее атомных спектров, что определяется внутренним движением в молекулах.
Так как, кроме движения электронов относительно двух и более ядер в молекуле, происходят колебательные движения ядер (вместе с окружающими их внутренними электронами) около положений равновесия и вращательных движений молекул.
Электронному, колебательному и вращательному движениям молекул соответствуют три типа уровней энергии:
We, Wкол и Wвр,
и три типа молекулярных спектров.
Согласно квантовой механике энергии всех видов движений молекулы могут принимать только определенные значения (кроме энергии поступательного движения).
Энергия молекулы W, изменение которой определяет молекулярный спектр, может быть представлена в виде суммы квантовых значений энергий:
W = We + Wкол + Wвр, (8.2)
причем по порядку величины:
We
: Wкол
: Wвр
= 1 :
![]() .
.
Следовательно,
We >> Wкол >> Wвр.
или
W = W* W**= We+ Wкол + Wвр. (8.3)
Энергия электронов We имеет порядок нескольких электронвольт:
Wкол 102 101 эВ, Wвр 105 103 эВ.
Система уровней энергии молекул характеризуется совокупностью далеко отстоящих друг от друга электронных уровней энергии.
Колебательные уровни расположены значительно ближе друг к другу, а вращательные уровни энергии располагаются еще ближе друг к другу.
Типичные молекулярные спектры совокупности узких полос (состоящие из большого числа отдельных линий) различной ширины в УФ, видимой и ИК области спектра, четкие с одного края и размытые с другого.
Энергетические уровни а и б соответствуют равновесным конфигурациям 2х молекул (рис. 8.2).
Каждому электронному состоянию соответствует определенное значение энергии We наименьшее значение, основного электронного состояния (основной электронный уровень энергии молекулы).
Набор электронных состояний молекулы определяется свойствами ее электронной оболочки.

Рис. 8.2
8.2.1. Колебательные уровни энергии
Колебательные уровни энергии можно найти квантованием колебательного движения, которое приближенно считают гармоническим.
Двухатомную молекулу (одна колебательная степень свободы, соответствующая изменению межъядерного расстояния r) можно рассматривать как гармонический осциллятор, квантование которого дает равноотстоящие уровни энергии:
![]() ,
(8.4)
,
(8.4)
где основная частота гармонических колебаний молекулы;
vкол = 0, 1, 2, ... колебательное квантовое число.
8.2.2. Вращательные уровни энергии
Вращательные уровни энергии можно найти квантованием вращательного движения молекулы, рассматривая ее как твердое тело с определенным моментом инерции I.
В случае двухатомной или линейной трехатомной молекулы ее энергия вращения
![]() ,
(8.5)
,
(8.5)
где I момент инерции молекулы относительно оси, перпендикулярной оси молекулы; L момент импульса.
Согласно правилам квантования
![]() ,
(8.6)
,
(8.6)
где J = 0, 1, 2, 3, ... вращательное квантовое число.
Для вращательной энергии получаем
![]() ,
(8.7)
,
(8.7)
где
![]()
вращательная постоянная, определяет масштаб расстояния между уровнями энергии.
Многообразие молекулярных спектров обусловлено различием типов переходов между уровнями энергии молекул.
