
7_Teoreticheskie_osnovy_protsessy_gorenia
.pdf
152
CO + O → CO2
O + H2 → OH + H
OH + H2 → H2 O + H
 О + СО
О + СО
Н + О2
 ОН + СО
ОН + СО
 СО2
СО2
 Н
Н  СО2
СО2
 СО2
СО2
ОН + СО |
|
Н |
|
О + Н2 |
|
|
|
СО2 |
|
|
|
||
Н + О2 |
|
|
СО2 |
|
|
|
|
|
|
ОН + СО |
|
|
Н |
|
|
|
|||
|
|
|
|
|
Рис. 7.3. Пример смешанной реакции
7.4. Горение углерода
Химический механизм горения углерода в достаточной мере еще не раскрыт. Однако в последнее время установлено, что в результате реагирова-
ния углерода с кислородом одновременно образуются оба окисла углерода CO и CO2 , но в разных соотношениях. При t = 1200 °C образуются оба окис-
ла и в одинаковом количестве. При t = 1600 °C CO образуется вдвое больше, чем CO2 .
Горение твердого углерода является гетерогенной реакцией, происхо- дящей на поверхности.
Прямая реакция горения углерода:
C + O2 → CO2 (основная),
но протекают и побочные эндо- и экзотермические реакции:
C + CO2 → 2CO ; 2CO + O2 → 2CO2 ; 2C + O2 → 2CO.
153
Кроме того, в присутствии водяных паров на раскаленной поверхности углерода происходит газификация углерода нелетучего остатка по реакциям:
C + H2 O → CO + H2 (высокотемпературная область);
C + 2H2 O → CO2 + 2H2 (низкотемпературная область).
Так как реакция горения углерода является гетерогенной, то скорость ее протекания зависит от организации подвода кислорода к поверхности углеро- да и скорости химической реакции. Подвод O2 осуществляется за счет турбу-
лентной и молекулярной диффузии. Происходящие побочные реакции (обра- зование CO за счет восстановления CO2 и догорания CO в CO2 ) оказывают
влияние на итоговую скорость горения углерода. Наиболее вероятна такая схема: на поверхности углерода образуется CO2 , затем C + CO2 → 2CO ; да-
лее в зоне с большим содержанием кислорода 2CO + O2 → 2CO2 .
Скорость гетерогенного горения, выраженная через количество кисло- рода, потребляемого единицей поверхности частицы, описывается следую- щим выражением:
ω = |
|
|
CO2 |
|
, |
(7.15) |
|
1 |
+ |
1 |
|
||||
|
|
k |
αд |
|
|
|
|
|
|
|
|
|
|
||
где k – константа скорости химической реакции; αд – константа скорости
диффузии.
Интенсификация процесса горения может быть осуществлена улучше- нием газообмена у поверхности углерода (рис. 7.4).
7.4.1. Диффузная и кинетическая области гетерогенного горения
При низких температурах скорость химического взаимодействия горючего и окислителя мала. Она намного меньше скорости их взаимной диффузии, которая поэтому почти не влияет на ход процесса. Считается, что процесс горения протекает в кинетической области (αд >> k , поэтому в фор-
муле 7.15 величиной 1 αд можно пренебречь по сравнению с 1
αд можно пренебречь по сравнению с 1 k ) и его сле-
k ) и его сле-
дует рассматривать как чисто химический процесс.
При высоких температурах или ухудшенных условиях массообмена скорость реакции намного опережает скорость диффузии, которая в данном случае определяет ход процесса. Можно считать, что процесс горения разви- вается в диффузионной области (1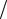 k << 1
k << 1 αд ) и его следует рассматривать
αд ) и его следует рассматривать
с чисто физической стороны.

|
|
|
|
|
|
|
|
154 |
|
|
|
|
|
|
Область |
|
Область избытка |
|
|
|
Наиболее подробно исследова- |
||||||
|
недостатка |
|
|
воздуха (α >1) |
|
|
|
||||||
|
|
|
|
|
ния |
горения |
углерода |
проведены |
|||||
поверхность |
воздуха(α <1) |
|
|
|
|
|
|||||||
СО |
|
|
|
|
|
|
школой профессора А.С. Предводите- |
||||||
|
СО2 |
СО2 |
|
О2 |
21 |
|
лева. |
Дальнейшее развитие |
исследо- |
||||
СО |
2 |
|
|
|
20 |
|
вания |
гетерогенных |
процессов |
||||
углеродная |
|
|
|
СО |
|
|
|||||||
|
|
|
|
15 |
Газ, % |
в натуральном |
топливе |
получили в |
|||||
|
|
|
|
2 |
|||||||||
|
|
|
|
|
|||||||||
|
СО |
|
|
|
10 |
работах профессора Г.Ф. Кнорре. |
|||||||
|
=α1 |
|
О |
2 |
|||||||||
Раскаленная |
|
|
|
|
|
|
|
В начальный период |
реакции, |
||||
|
|
|
|
|
5 |
|
|
||||||
|
|
|
|
|
|
когда температура низка, скорость ре- |
|||||||
|
|
|
|
|
0 |
|
|||||||
|
|
|
|
|
|
акции незначительна, а концентрация |
|||||||
|
|
|
|
|
|
|
|||||||
|
|
Поток воздуха, омывающий |
|
|
кислорода |
у |
поверхности |
горящей |
|||||
|
|
|
|
частицы топлива велика. При этом |
|||||||||
|
|
углеродную поверхность |
|
|
|||||||||
Рис. 7.4. Изменение концентрации газов у |
скорость горения лимитируется ско- |
||||||||||||
поверхности частицы горящего углерода |
|
ростью протекания химической реак- |
|||||||||||
ции окисления, т. е. кинетикой горения. Горение проходит в кинетической |
|||||||||||||
области (рис. 7.5). |
|
|
|
|
|
|
|
|
|
||||
|
|
По мере расходования ки- |
|
|
слорода его концентрация у по- |
г |
|
верхности частицы уменьшается. |
W |
d3,W1 |
Одновременно с этим возрастает |
|
||
|
d2 ,W2 |
температура, а вместе с ней и ско- |
|
d1,W3 |
рость химической реакции. Ки- |
|
слорода начинает не хватать. Ско- |
|
|
d1 > d2 > d3 |
|
|
рость горения начинает лимити- |
|
|
W1 > W2 > W3 |
роваться скоростью диффузии ки- |
|
|
слорода. Так горение переходит в |
Рис. 7.5. Изменение скорости химической ре- |
диффузную область. В диффузной |
|
акции в зависимости от температуры: d – раз- |
области скорость горения не зави- |
|
мер частицы |
|
сит от температуры. Между этими |
областями находится промежуточная переходная область, где влияние кине- |
||
тики и диффузии соизмеримы. При увеличении интенсивности газообмена у |
||
поверхности горящей частицы кривая сдвигается в область больших |
||
скоростей химической реакции. |
|
|
7.5.Горение натуральных топлив
7.5.1.Горение газового топлива
Газовое топливо сжигают методом струйного ввода в топочную камеру горючей смеси его с воздухом, образованной в горелке. Зажигание осуществ-
ляют по периферии струи за счет эжектирования горячих топочных газов из окружающей среды. В потоке воспламенение происходит в тонком слое га-
155
зов. От воспламенившегося слоя посредством турбулентного обмена тепло передается прилегающим слоям, вызывая их последовательное воспламене- ние. В каждый момент химическое реагирование протекает в тонком слое, на- зываемом пламенем. Таким образом, горение происходит путем распростра- нения пламени в турбулентной струе горючей смеси, поступающей в топоч- ную камеру.
Для интенсификации сжигания газового топлива необходимо ускорить смешение его с воздухом и создать условия для увеличения скорости турбу- лентного распространения пламени и поверхности фронта пламени. Поверх- ность фронта пламени может быть увеличена организацией развитого зажи- гания по сечению горелки. Скорость турбулентного распространения пламе- ни определяется скоростью химического реагирования, которая увеличивает- ся с ростом температуры и концентрации реагирующих веществ. С целью по- вышения температуры смеси применяют предварительный подогрев воздуха, используемого для горения. Однако основной нагрев горючей смеси до ее воспламенения происходит в топочной камере за счет диффузии в нее высо- конагретых продуктов сгорания. Для ускорения тепло-и массообмена сжига- ние должно быть организовано в высокотурбулизированном потоке и, следо- вательно, в потоке с повышенной скоростью. При этом должно быть органи- зовано устойчивое зажигание, обеспечивающее воспламенение у устья горел- ки при высокой скорости истечения смеси из горелок.
7.5.2. Горение жидкого топлива
Температура воспламенения жидкого топлива (нефти, мазута) выше, чем температура кипения его. Поэтому при поступлении в зону высоких тем-
ператур капля мазута вначале испаряется с поверхности за счет подводимой теплоты, а затем пары топлива смешиваются с воздухом из окружающей сре- ды, подогреваются до температуры воспламенения и горят в газообразном со- стоянии. В результате на некотором расстоянии от капли rстех в зоне реакции
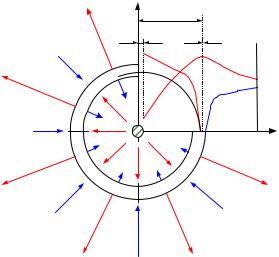
устанавливается стехиометрическое соотношение между горючими газами и кислородом и здесь устанавливается фронт горения (рис. 7.6), который для
случая горения капли жидкого топлива в неподвижной окружающей среде представляет сферу вокруг капли. Расстояние rстех составляет обычно 4–10
радиусов капли. Между каплей и фронтом горения идет интенсивное движе- ние паров топлива. Здесь практически нет кислорода и коэффициент избытка кислорода по отношению к парам топлива α <<1.
В зоне реакции имеет место химическое равновесие между количества- ми топлива и окислителя (α =1), а за ней идет догорание остатков топлива и отвод продуктов сгорания. Навстречу им к зоне реакции диффундирует окис- литель. Здесь он в избытке, и α > 1. Концентрации паров топлива Cт и окисли-
теля (кислорода) Cок резко уменьшаются в пределах зоны горения в результа-
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
156 |
те интенсивной реакции окисления, а температура среды вокруг капли T |
||||||||||||||||||||||||
здесь достигает максимума. Горение паров топлива протекает по законам |
||||||||||||||||||||||||
цепной реакции (см. 7.3). Поскольку горение паров топлива протекает при |
||||||||||||||||||||||||
высокой температуре с активным потреблением кислорода, а его доставка |
||||||||||||||||||||||||
диффузией ограничена, то скорость процесса горения будет лимитироваться |
||||||||||||||||||||||||
диффузией кислорода. Отсюда следует, что горение паров жидкого топлива |
||||||||||||||||||||||||
протекает в диффузионной области. |
Количество кислорода, посту- |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Т,°C |
|
|
|
rстех |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пающего в зону горения через шаро- |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
rк |
|
|
|
|
|
|
α < 1 |
α >1 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
вую поверхность, пропорционально |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ст |
Т |
квадрату ее диаметра, и поэтому не- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
большое удаление зоны горения от |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ап |
|
|
|
|
|
|
Сок |
поверхности капли (что имеет место |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
К |
|
л |
|
|
|
|
|
при интенсивном испарении) заметно |
||
|
|
|
|
|
|
|
|
|
З |
|
|
|
|
|
я |
|
|
|
а |
|
||||
|
|
|
|
|
|
|
ы |
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
увеличивает поверхность зоны и мас- |
|
|
|
|
|
|
|
|
|
|
н |
Пар |
|
|
|
|
|
|
|
в |
|
|||||
|
|
|
|
т |
|
|
а |
|
|
|
|
|
|
и |
|
|
||||||||
|
одук |
|
|
|
|
|
|
|
|
|
л |
|
|
|
||||||||||
р |
|
|
|
|
|
я |
|
|
|
|
ы |
|
|
п |
|
|
|
|
|
|||||
П |
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
н |
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
совый подвод кислорода к ней. Но |
|||
|
|
|
а |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
р |
|
|
|
|
|
|
ре |
|
|
|
|
|
Т |
|
|
|
|
1 |
|
|||
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
г |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
с |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
||||
|
|
|
|
|
|
|
|
|
|
|
а |
|
|
|
|
|
|
α |
|
|
||||
|
|
|
|
|
|
|
|
|
д |
|
|
к |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
ц |
|
|
|
|
|
|
|
|
|
|
более существенное влияние на обес- |
||
|
|
|
|
|
|
|
|
|
о |
|
|
|
и |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
р |
|
|
|
|
я |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
с |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
печение горящего топлива кислоро- |
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
дом оказывает увеличение суммарной |
Рис. 7.6. Механизм и характеристики горе- |
поверхности испарения капель, что |
|||||||||||||||||||||||
достигается тонким распылом струи |
||||||||||||||||||||||||
ния капли жидкого топлива |
|
поступающего на горение топлива с |
||||||||||||||||||||||
образованием мельчайших капель (тумана). Так, при дроблении капли мазута |
||||||||||||||||||||||||
диаметром 2 мм до размера 200 мкм (0,2 мм) образуется 1000 таких капель, |
||||||||||||||||||||||||
суммарная поверхность которых будет в 10 раз больше поверхности исходной |
||||||||||||||||||||||||
капли. В процессе испарения капель размеры их уменьшаются, сокращается |
||||||||||||||||||||||||
также и зона горения, которая при полном испарении капли исчезает. Если |
||||||||||||||||||||||||
начальный процесс горения паров жидкого топлива будет протекать в усло- |
||||||||||||||||||||||||
виях значительного недостатка кислорода, то образуется много тяжелых |
||||||||||||||||||||||||
твердых углеводородов и мельчайших частиц углерода (сажи). Такой процесс |
||||||||||||||||||||||||
– термический крекинг – затрудняет дальнейшее быстрое и полное выгорание |
||||||||||||||||||||||||
топлива, т. к. дальнейшее горение твердой частицы с поверхности происходит |
||||||||||||||||||||||||
медленно. Если же начальный процесс горения совершается при необходи- |
||||||||||||||||||||||||
мом количестве кислорода, то такой процесс – окислительный крекинг – со- |
||||||||||||||||||||||||
провождается малым сажеобразованием и облегчает дальнейшее быстрое и |
||||||||||||||||||||||||
полное выгорание топлива. |
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
Основными условиями интенсификации горения жидкого топлива яв- |
|||||||||||||||||
ляются предварительный подогрев и тонкое распыление топлива, подогрев и |
||||||||||||||||||||||||
подача всего необходимого для горения воздуха в зону поступления топлива, |
||||||||||||||||||||||||
энергичное смесеобразование, что обеспечивает поддержание температуры в |
||||||||||||||||||||||||
ядре горения на достаточно высоком уровне – более 1500 °С. |
||||||||||||||||||||||||
157 |
|
|
|
|
|
|
7.5.3. Горение твердого топлива |
|
|
|
|
||
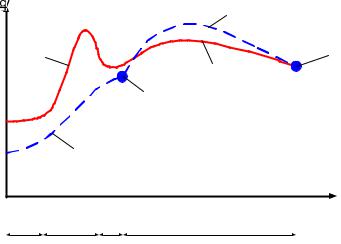
Горение твердого топлива (угольной пыли) включает два периода: теп- |
||||||
ловую подготовку и собственно горение (рис. 7.7). В процессе тепловой под- |
||||||
готовки (рис. 7.7, зона I) частица топлива прогревается, высушивается и при |
||||||
температуре выше 110 °С начинается тепловое разложение исходного веще- |
||||||
ства топлива с выделением газообразных летучих веществ. Длительности это- |
||||||
го периода зависит главным образом от влажности топлива, размера его час- |
||||||
тиц, условий теплообмена и составляет обычно десятые доли секунды. Про- |
||||||
текание процессов в период тепловой подготовки связано с поглощением те- |
||||||
пла, главным образом, на подогрев, подсушку топлива и термическое разло- |
||||||
жение сложных молекулярных соединений, поэтому нагрев частицы в это |
||||||
время идет замедленно. |
|
|
|
|
|
|
Собственно горение начинается с воспламенения летучих веществ (рис. |
||||||
7.7, зона II) при температуре 400–600 °С, а выделяющаяся в процессе их го- |
||||||
рения теплота обеспечивает ускоренный прогрев и воспламенение твердого |
||||||
коксового остатка. Горение летучих веществ занимает 0,2–0,5 с. При большом |
||||||
выходе летучих (бурые и молодые каменные угли, сланцы, торф) выделяю- |
||||||
щейся теплоты их горения достаточно для воспламенения коксовой частицы, |
||||||
а при малом выходе летучих возникает необходимость дополнительного про- |
||||||
грева коксовой частицы от окружающих раскаленных газов (зона III). |
|
|||||
Горение кокса (рис. 7.7, зона IV) начинается при температуре около |
||||||
1000 °С и является наиболее длительным процессом. Это определяется тем, |
||||||
что часть кислорода в зоне у поверхности частицы уже израсходована на |
||||||
Т |
сжигание |
горючих |
летучих |
|||
веществ и оставшаяся кон- |
||||||
|
центрация |
его |
снизилась, |
|||
|
кроме того, гетерогенные ре- |
|||||
|
акции всегда уступают |
по |
||||
|
скорости |
гомогенным |
для |
|||
|
однородных по химической |
|||||
|
активности веществ. |
|
||||
|
В итоге общая дли- |
|||||
τ |
тельность |
горения |
твердой |
|||
частицы (1,0–2,5 с) в основ- |
||||||
|
||||||
Рис. 7.7. Температурный режим при горении отдель- |
ном определяется |
|
горением |
|||
коксового остатка (около 2/3 |
||||||
ной частицы твердого топлива: 1 – температура газо- |
общего времени горения). У |
|||||
вой среды вокруг частицы; 2 – температура частицы; |
молодых |
топлив, |
имеющих |
|||
3 – воспламенение коксового остатка; 4 – завершение |
||||||
горения коксового остатка; I – зона термической под- |
большой выход летучих ве- |
|||||
готовки; II – зона горения летучих веществ; III – зона |
ществ, коксовый остаток со- |
|||||
прогрева коксового остатка; IV – зона горения коксо- |
ставляет |
менее |
половины |
|||
вого остатка |
начальной |
массы |
|
частицы, |
||
158
поэтому иx сжигание (при равных начальных размерах) происходит доста- точно быстро и возможность недожога снижается. Старые по возрасту топли- ва имеют плотную коксовую частицy, горение которой занимает почти все время пребывания в топочной камере.
Коксовый остаток большинства твердых топлив в основном, а для ряда твердых топлив почти целиком состоит из углерода (от 60 до 97% массы час- тицы). Учитывая, что углерод обеспечивает основное тепловыделение при сжигании топлива, рассмотрим динамику горения углеродной частицы с по- верхности. Кислород подводится из окружающей среды к частице углерода за счет турбулентной диффузии (турбулентного массопереноса), имеющего дос- таточно высокую интенсивность, однако непосредственно у поверхности час- тицы сохраняется тонкий газовый слой (пограничный слой), перенос окисли- теля через который осуществляется по законам молекулярной диффузии (рис. 7.7). Этот слой в значительной мере тормозит подвод кислорода к поверхно- сти. В нем происходит догорание горючих газовых компонент, выделяющих- ся из частицы в ходе термического разложения. Подвод кислорода к реаги-
рующей поверхности твердого топлива определяется константой скорости диффузии и разностью концентраций кислорода в потоке и на реагирующей поверхности.
В установившемся процессе горения количество кислорода, подводи- мого диффузией к поверхности реагирования, равно его количеству, про- реагировавшему на поверхности в результате химической реакции.
При этом приведенная константа скорости горения kг учитывающая как условие диффузии, т.е. значение αд , так и интенсивность химической реак- ции k определяется по уравнению:
kг = |
kαд |
, |
(7.16) |
|
|||
|
k + αд |
|
|
Величина, обратная константе скорости горения, 1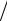 kд представляет со- бой общее сопротивление процессу горения.
kд представляет со- бой общее сопротивление процессу горения.
7.6.Примеры и контрольные вопросы
7.6.1.Примеры
1.Определить во сколько возрастет скорость горения коксовой частицы антрацита по уравнению C+ O2 = CO2 при его сжигании в котельном агрегате с
жидким шлакоудалением, чем при его сжигании в котельном агрегате с твер- дым шлакоудалением, если средние адиабатные температуры горения топли- ва соответственно равны: t1 = 1800 °С, t2 = 1600 °С, значение энергии актива-

159
ции реакции E = 147 МДж/моль. Универсальная газовая постоянная R = 8,31 Дж/(моль×К).
Решение: в первом приближении константы k0 = const . Отношение ско- ростей реакций находим по формуле:
|
|
- |
E |
|
|
- |
147000 |
|
|
|
|
|
|
|
RT |
|
|
|
|
-8,53 |
|
||||
k |
|
e |
|
|
e |
× |
|
|
e |
|
||
= |
1 |
|
= |
8,31 2073 |
= |
|
= 2, 49. |
|||||
1 |
|
|
|
|
|
|
|
|
||||
k2 |
- |
E |
|
- |
147000 |
|
e |
-9,44 |
||||
|
|
|
|
|
|
|||||||
|
|
e RT2 |
|
|
e |
8,311873× |
|
|
|
|
|
|
При увеличении температуры возрастают скорости движения молекул и частота соударения молекул. Соотношение констант k0 находим по формуле:
|
æ |
2073 |
ö0,5 |
||
k01 |
= k02 ç |
|
÷ |
= 1, 052× k02. |
|
1873 |
|||||
|
è |
ø |
|
||
Общее увеличение скорости реакции находим по формуле:
k1 = 2,49 ×1,052 = 2,62. k2
2. Определить энергию активации реакции горения коксовой частицы бурого угля по уравнению C+ O2 = CO2 , если известно, что при снижении тем-
пературы протекания реакции с t1 = 1500 °С до t2 = 1400 °С, скорость реак- ции снижается в 1,5 раза. В первом приближении константы k0 = const . Уни-
версальная газовая постоянная R = 8,31 Дж/(моль×К). Решение: отношение скоростей реакций имеет вид:
|
|
|
- |
E |
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
= |
e |
|
RT1 |
|
= |
e-8,311773× |
= e4,057×10 |
−6 |
×E |
= 1,5. |
||
1 |
|
|
|
|
|
|
|
|
|||||
k2 |
|
- |
E |
|
- |
E |
|
|
|
||||
|
|
|
|
|
|
|
|
||||||
|
|
e RT2 |
|
|
e |
8,311673× |
|
|
|
|
|
||
Выражаем энергию активации и находим ее значение:
E = |
ln1,5 |
= 100,0 МДж/моль. |
4,057 ×10-6 |
7.6.2.Контрольные вопросы
1.Что такое гомогенные и гетерогенные химические реакции?
2.По каким показателям определяют скорость горения в гомогенной и гетерогенной химических реакциях?
160
3.Какие основные факторы влияют на скорость химической реакции?
4.Почему скорости горения обычно выше расчетных, полученных на основе молекулярных балансов?
5.Ограничен ли диапазон концентраций, в пределах которых возможна реакция?
6.Как происходит горение газового топлива? Что такое активные цен- тры реакций горения?
7.Что такое разветвленная цепная реакция? При каких условиях цепная разветвленная реакция может развиваться?
6.Назовите стадии сгорания частиц твердого топлива. Какова роль влажности топлива и летучих веществ при сжигании твердого топлива?
8.Дайте характеристику областям горения топлива. В каких областях начинается и заканчивается горение топлива? Чем определяется перемеще-
ние температурной границы между кинетической и диффузионной областью горения?
9.За счет чего мазутная капля сгорает быстрее твердой частицы топли- ва эквивалентного размера?
10.Почему зона горения испаряющейся капли мазута находится на уда- лении от ее поверхности?
11.Почему необходимо тонкое распыление поступающего на горение
мазута?
12.В чем выражается процесс диссоциации газов? При каких темпера- турах он происходит?
