
- •11) Фотоэлектрический эффект (внешний, внутренний). Законы Столетова для фотоэффекта. Уравнение Эйнштейна.
- •12) Корпускулярные свойства излучения. Фотоны. Энергия, импульс, масса фотона.
- •13) Модель атома Бора. Постулаты Бора. Опыт Франка - Герца. . Модель Бора
- •14) Состав ядра: протоны и нейтроны. Основные характеристики нуклонов и ядер. Изотопы.
- •15) Понятие о ядерных силах. Масса и энергия связи в ядре.
- •16) Сущность явления радиоактивности. Типы радиоактивного распада.
- •17) Закон радиоактивного распада. Период полураспада.
13) Модель атома Бора. Постулаты Бора. Опыт Франка - Герца. . Модель Бора
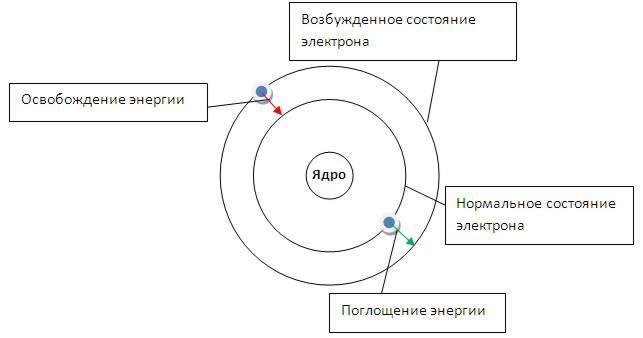
Представьте,
что электроны в атоме движутся по
определенным электронным орбитам - по
аналогии с движениями планет Солнечной
системы. Каждая планета движется по
своей орбите, так и электроны вращаются
вокруг ядра атома. Каждая такая орбита
для электрона получила название "уровень
энергии". Энергия электронов в атоме
может изменяться только скачкообразно.
Т.е. электрон может перескакивать с
одной орбиты на другую и обратно (но не
может занимать положение между орбитами).
Говорят, что энергетические состояния
электронов в атоме квантованы.
Энергия
электрона зависит от радиуса его орбиты.
Минимальная энергия у электрона, который
находится на ближайшей к ядру орбите.
При поглощении кванта энергии электрон
переходит на орбиту с более высокой
энергией (возбужденное состояние). И
наоборот, при переходе с высокого
энергетического уровня на более низкий
- электрон отдает (излучает) квант
энергии.
 Кроме
того, Бор указал, что разные энергетические
уровни содержат разное количество
электронов: первый уровень - до 2
электронов; второй уровень - до 8
электронов…
К
сожалению, описать атомы со сложной
структурой, опираясь на модель Бора, не
представляется возможным. Поэтому, в
20-х годах прошлого века получила широкое
распространение квантово-механическая
модель (КММ) атома.
Кроме
того, Бор указал, что разные энергетические
уровни содержат разное количество
электронов: первый уровень - до 2
электронов; второй уровень - до 8
электронов…
К
сожалению, описать атомы со сложной
структурой, опираясь на модель Бора, не
представляется возможным. Поэтому, в
20-х годах прошлого века получила широкое
распространение квантово-механическая
модель (КММ) атома.
Постулаты Бора
Первый шаг на пути разрешения противоречий между теорией и результатами эксперимента в физике атома был сделан датским физиком Нильсом Бором (1885-1962). Свои представления об особых свойствах атомов Бор сформулировал в виде постулатов следующего содержания:
Атомная система может находиться только в особых стационарных или квантовыхсостояниях, каждому из которых соответствует определенная энергия En. В стационарном состояние атом не излучает.
При переходе атома из одного стационарного состояния в другое испускается или поглощается квант электромагнитного излучения. Энергия фотона равна разности энергий атома в двух стационарных состояниях. hv = E m - E n, где h — постоянная Планка.
Все стационарные состояния, кроме одного, являются стационарными лишь условно. Бесконечно долго каждый атом может находиться лишь в стационарном состоянии с минимальным запасом энергии. Это состояние атома называется основным. Все остальные стационарные состояния атома называются возбужденными.
В результате соударения с другим атомом, с заряженной частицей или при поглощении фотона атом может перейти из стационарного состояния с меньшим запасом энергии в стационарное состояние с большим запасом энергии. Из любого возбужденного состояния атом самопроизвольно может переходить в основное состояние; этот переход сопровождается излучением фотонов. Время жизни атомов в возбужденных состояниях обычно не превышает 10-8 — 10-7 с.
Основное изменение, внесенное в физику атома постулатами Бора, заключалось в отказе от представлений о непрерывности изменения всех физических величин и в принятии идеиквантования физических величин, которыми описывается внутреннее состояние атома. Вместо непрерывного изменения расстояний между ядром и электроном в атоме оказывается возможным только дискретный ряд значений таких расстояний. Дискретными оказываются возможные значения кинетической и потенциальной энергии электрона в атоме, скорости его движения по круговой орбите.
Опыт Франка и Герца
Существование дискретных энергетических уровней атома подтверждается опытом Франка и Герца. Немецкие ученые Джеймс Франк и Густав Герц за экспериментальные исследования дискретности энергетических уровней получили Нобелевскую премию в 1925 г.
В опытах использовалась трубка (рис. 6.9), заполненная парами ртути при давлении р ≈ 1 мм рт. ст. и три электрода: катод, сетка и анод.
Электроны ускорялись разностью потенциалов U между катодом и сеткой. Эту разность потенциалов можно было изменять с помощью потенциометра П. Между сеткой и анодом тормозящее поле 0,5 В (метод задерживающих потенциалов).

Рис. 1
Определялась зависимость тока через гальванометр Г от разности потенциалов между катодом и сеткой U. В эксперименте была получена зависимость, изображенная на рис. 6.10. ЗдесьU = 4,86 В – соответствует первому потенциалу возбуждения.
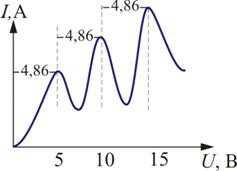
Рис. 2
Согласно боровской теории, каждый из атомов ртути может получить лишь вполне определенную энергию, переходя в одно из возбужденных состояний. Поэтому если в атомах действительно существуют стационарные состояния, то электроны, сталкиваясь с атомами ртути, должны терять энергию дискретно, определенными порциями, равными разности энергии соответствующих стационарных состояний атома.
Из опыта следует, что при увеличении ускоряющего потенциала вплоть до 4,86 В анодный ток возрастает монотонно, его значение проходит через максимум (4,86 В), затем резко уменьшается и возрастает вновь.
Ближайшим к основному, невозбужденному состоянию атома ртути является возбужденное состояние, отстоящее по шкале энергий на 4,86 В. Пока разность потенциалов между катодом и сеткой меньше 4,86 В, электроны, встречая на своем пути атомы ртути, испытывают с ними только упругие соударения. При = 4,86 эВ энергия электрона становится достаточной, чтобы вызвать неупругий удар, при котором электрон отдает атому ртути всю кинетическую энергию, возбуждая переход одного из электронов атома из нормального состояния в возбужденное. Электроны, потерявшие свою кинетическую энергию, уже не смогут преодолеть тормозящий потенциал и достигнуть анода. Этим и объясняется резкое падение анодного тока при = 4,86 эВ. При значениях энергии, кратных 4,86, электроны могут испытывать с атомами ртути 2, 3, … неупругих соударения. При этом они полностью теряют свою энергию и не достигают анода, т.е. наблюдается резкое падение анодного тока.
Таким образом, опыт показал, что электроны передают свою энергию атомам ртути порциями, причем 4,86 эВ – наименьшая возможная порция, которая может быть поглощена атомом ртути в основном энергетическом состоянии. Следовательно, идея Бора о существовании в атомах стационарных состояний блестяще выдержала проверку экспериментом.
Атомы ртути, получившие при соударении с электронами энергию , переходят в возбужденное состояние и должны вернуться в основное, излучая при этом, согласно второму постулату Бора, квант света с частотой . По известному значению можно вычислить длину волны светового кванта: . Таким образом, если теория верна, то атомы ртути, бомбардируемые электронами с энергией 4,86 эВ, должны являться источником ультрафиолетового излучения с , что действительно обнаружилось в опытах.
Таким образом, опыты Франка и Герца экспериментально подтвердили не только первый, но и второй постулат Бора и сделали большой вклад в развитие атомной физики.
