
- •Уровень в
- •2. Эквивалент. Закон эквивалентов уровень в
- •3. Способы выражения состава раствора уровень b
- •1. Плотность 6% водного раствора ортофосфорной кислоты равна 1,031 г/см3. Рассчитать:
- •2. Определить объем 16%-ного раствора карбоната калия плотностью 1,149 г/см3, необходимого для приготовления 3 л 0,2 м водного раствора данного вещества. Пояснить процесс приготовления раствора.
- •4. Энергетика химических реакций уровень b
- •3. Рассчитать теплотворную способность каменного угля, если известно, что в нем содержится 80% углерода, а в отходящих газах после сгорания угля содержится 14% со2 и 2% со по объему.
- •5. Скорость химических реакций и химическое равновесие уровень в
- •6. Физико-химические свойства растворов уровень в
- •3. Определить кажущуюся степень диссоциации соли, если водный раствор хлорида алюминия с массовой долей 1,5% кристаллизуется (замерзает) при температуре (-0,690с).
- •7. Растворы сильных и слабых электролитов. Уровень в
- •2. Определить, образуется ли осадок, если смешали 100 см0,01м водного раствора хлорида кальция и 200 см0,02м водного раствора карбоната натрия.
- •3.Вычислить рН 0,0im водного раствора hno2, содержащего, кроме того, 0,02 моль/л kno2.
- •8. Гидролиз солей уровень в
- •9. Окислительно - восстановительные реакции (овр) уровень в
- •1. Уравнять реакцию. Указать окислитель и восстановитель.
- •4 Г брома.
- •2. Уравнять реакцию. Указать окислитель и восстановитель:
- •3. Определить направление протекания реакции:
- •10. Гальванические элементы коррозия металлов. Уровень в
- •11. Электролиз растворов
- •Уровень в
- •12. Получение и химические свойства металлов уровень в
9. Окислительно - восстановительные реакции (овр) уровень в
1. Уравнять реакцию. Указать окислитель и восстановитель.
KCrO2 + Br2 + KOH → KBr + K2Cr2O7 + H2O
Определить массу KCrO2, необходимую для взаимодействия с
4 Г брома.
|
Дано:
Уравнять реакцию
и указать окислитель и восстановитель.
|
РЕШЕНИЕ:
|
КCr+3O2
+ Br20
+ KOH
= KBr![]() + K2Cr2+6O7
+ H2O
+ K2Cr2+6O7
+ H2O
восст. окисл. среда
 НОК
ДМ
НОК
ДМ
о кисл-льBr20
+ 2ē = 2Br
-
3
кисл-льBr20
+ 2ē = 2Br
-
3
6
в осст-льCr+3
- 3ē = Cr+6
2
осст-льCr+3
- 3ē = Cr+6
2
3Br20
+ 2Cr+3
= 6Br![]() + 2Cr+6
+ 2Cr+6
2KCrO2 + 3Br2 + 6KOH → 6KBr + K2Cr2O7 + 3H2O
Согласно уравнению реакции 2 моль KCrO2 реагирует с 3 моль Br2, т.е.
2М![]() – 3М
– 3М![]() 2·123 г/моль - 3·160 г/моль
2·123 г/моль - 3·160 г/моль
![]() -
-
![]()
![]() - 4 г.
- 4 г.
![]() =
=
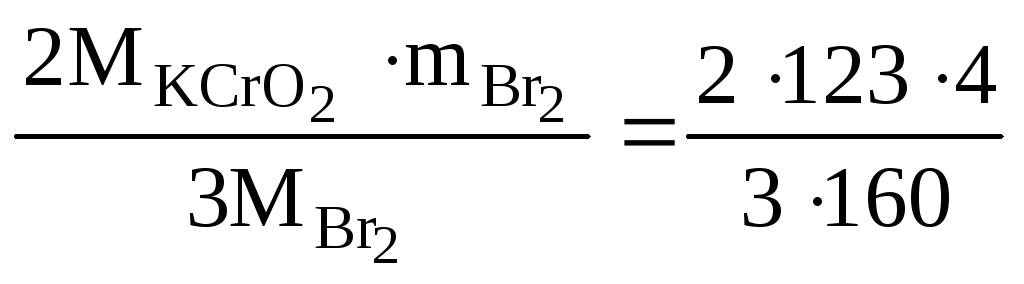 =
2,05 г
=
2,05 г
Ответ:
окислитель – Br2,
восстановитель – KCrO2,
![]() = 2,05г.
= 2,05г.
2. Уравнять реакцию. Указать окислитель и восстановитель:
H2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O
Определить cэк(Н2S), если на взаимодействие с 3,16 г KMnO4 израсходовано 200 см3 раствора H2S.
|
Дано:
|
|
Уравнять
реакцию, указать окислитель и
восстановитель, определить
|
H2S-2 + KMn+7O4 + H2SO4 = S0 + Mn+2SO4 + K2SO4 + H2O
восст. окисл. cреда
НОК ДМ
в
 осст-льS-2
- 2ē = S0
5
осст-льS-2
- 2ē = S0
5
10
окисл-ль Mn+7 + 5ē = Mn+2 2

5S-2 + 2Mn+7 = 5S0 + 2Mn+2
Переносим полученные коэффициенты в молекулярное уравнение:
5H2S + 2KMnO4 + H2SO4 = 5S + 2MnSO4 + K2SO4 + H2O
Подсчитываем количество H2SO4 необходимое для получения 2 моль MnSO4 и 1 моль K2SO4. Для этого необходимо 3 моль H2SO4:
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + H2O
Уравниваем количество водорода и кислорода (8Н2О):
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
По закону эквивалентов nэк(H2S) = nэк(KMnO4)
![]()
![]() =
=
![]() ,
г/моль
,
г/моль
где
![]() -
число электронов, принятых одной
молекулой KMnO4.
-
число электронов, принятых одной
молекулой KMnO4.
![]() =
=
![]() г/моль
г/моль
![]() ·0,2
=
·0,2
=
![]() = 0,1
= 0,1
![]() =
=
![]() = 0,5 моль/л
= 0,5 моль/л
Ответ:
окислитель - KMnO4,
восстановитель - Н2S,
![]()
3. Определить направление протекания реакции:
а) KI-1 + Cu+2Cl2 <=> Cu+Cl + KCl + I20
б) KI-1 + Fe+3Cl3 <=> Fe+2Cl2 + KCl + I20
Расставить коэффициенты, указать окислитель и восстановитель.
Вычислить константу равновесия реакции при стандартных условиях.
|
Дано: Уравнение реакции |
|
Уравнять реакцию и указать окислитель и восстановитель. Определить направление протекания реакции. Кс - ? |
а) Для того, чтобы определить направление протекания окислительно-восстановительной реакции, надо сопоставить силу окислителей для следующих полуреакций (см. таблицу)
Cu2+
+ e-
= Cu+
φ![]() =
+0,15 B
=
+0,15 B
I2
+ 2e-
= 2I-
φ![]() =
+0,54 B
=
+0,54 B
Из
двух приведенных окислителей более
сильным окислителем будет I2
, поскольку φ![]() >
φ
>
φ![]() .
.
I2 находится в продуктах реакции, следовательно, реакция будет протекать справа налево т.е. реально протекающей будет реакция:
CuCl + KCl + I2 <=> KI + CuCl2
Расставляем коэффициенты методом электронного баланса:
Cu+1Cl + KCl + I20 = Cu+2Cl2 + KI-1

 НОК
ДМ
НОК
ДМ
Cu+1 - e- = Cu+2 2
2
 I
I![]() + 2e- = 2I-1
1
+ 2e- = 2I-1
1
I20
+ 2Cu+1
= 2Cu+2
+ 2I![]()
2CuCl + 2KCl + I2 <=> 2KI + 2CuCl2
ΔrG0(298K) = -z·F·ε˚ (9.1)
где z - число отданных или принятых электронов (НОК = 2); F = 96500 Кл/моль; ε˚ - стандартное напряжение ОВР, В
ε˚ = φ˚ок - φ˚восст (9.2)
ε˚
=
![]() =
0,54-0,15 = 0,39В
=
0,54-0,15 = 0,39В
ΔrG0(298K) = -2·96500·0,39 = -75270 Дж,
![]() =
1,66·1013.
=
1,66·1013.
Ответ: окислитель - I2; восстановитель – CuCl, приведенная в условии задачи реакция (а) протекает справа налево, КС =1,66·1013.
б) Из таблицы определяем стандартные электродные потенциалы окислителей для реакции
KI + FeCl3 <=> FeCl2 + KCl + I2
Fe3+
+ e-
= Fe+2
φ![]() =
+0,77 B
=
+0,77 B
I2
- 2e-
= 2I-
φ![]() =
+0,54 B
=
+0,54 B
Из
двух приведенных окислителей более
сильным окислителем будет Fe+3
, поскольку φ![]() >
φ
>
φ![]() .
.
Fe+3 находится в исходных веществах, следовательно, реакция будет протекать слева направо т.е. реально протекающей будет реакция (б), приведенная в условии задачи:
KI + FeCl3 <=> FeCl2 + KCl + I2
Расставляем коэффициенты методом электронного баланса:
KI-1 + Fe+3Cl3 = Fe+2Cl2 + KCl + I20
НОК ДМ



 I-1
- e- = I0
1 2
I-1
- e- = I0
1 2
1 2
Fe+3 + e- = Fe+2 1 2
 I-1
+ Fe+3
= Fe+2
+ I0
I-1
+ Fe+3
= Fe+2
+ I0
Поскольку после реакции образуется четное число атомов иода, значения НОК и ДМ удваиваем.
2KI + 2FeCl3 <=> 2FeCl2 + 2KCl + I2
ΔrG0(298K) = -z·F·ε˚ (9.1)
где z - число отданных или принятых электронов (НОК = 2); F = 96500 Кл/моль; ε˚ - стандартное напряжение ОВР, В
ε˚ = φ˚ок - φ˚восст (9.2)
ε˚ = 0,77-0,54 = 0,23В
ΔrG0(298K) = -2·96500·0,23 = -44390 Дж,
![]() =
6,3·107.
=
6,3·107.
Ответ: окислитель – FeCl3 ; восстановитель – KI, реакция протекает слева направа, Кс =6,3·107.


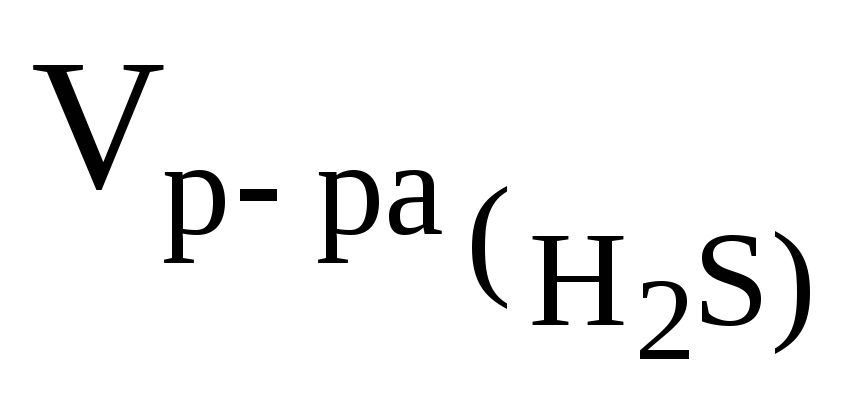 =
200 см3
=
200 см3