
- •Уровень в
- •2. Эквивалент. Закон эквивалентов уровень в
- •3. Способы выражения состава раствора уровень b
- •1. Плотность 6% водного раствора ортофосфорной кислоты равна 1,031 г/см3. Рассчитать:
- •2. Определить объем 16%-ного раствора карбоната калия плотностью 1,149 г/см3, необходимого для приготовления 3 л 0,2 м водного раствора данного вещества. Пояснить процесс приготовления раствора.
- •4. Энергетика химических реакций уровень b
- •3. Рассчитать теплотворную способность каменного угля, если известно, что в нем содержится 80% углерода, а в отходящих газах после сгорания угля содержится 14% со2 и 2% со по объему.
- •5. Скорость химических реакций и химическое равновесие уровень в
- •6. Физико-химические свойства растворов уровень в
- •3. Определить кажущуюся степень диссоциации соли, если водный раствор хлорида алюминия с массовой долей 1,5% кристаллизуется (замерзает) при температуре (-0,690с).
- •7. Растворы сильных и слабых электролитов. Уровень в
- •2. Определить, образуется ли осадок, если смешали 100 см0,01м водного раствора хлорида кальция и 200 см0,02м водного раствора карбоната натрия.
- •3.Вычислить рН 0,0im водного раствора hno2, содержащего, кроме того, 0,02 моль/л kno2.
- •8. Гидролиз солей уровень в
- •9. Окислительно - восстановительные реакции (овр) уровень в
- •1. Уравнять реакцию. Указать окислитель и восстановитель.
- •4 Г брома.
- •2. Уравнять реакцию. Указать окислитель и восстановитель:
- •3. Определить направление протекания реакции:
- •10. Гальванические элементы коррозия металлов. Уровень в
- •11. Электролиз растворов
- •Уровень в
- •12. Получение и химические свойства металлов уровень в
2. Определить, образуется ли осадок, если смешали 100 см0,01м водного раствора хлорида кальция и 200 см0,02м водного раствора карбоната натрия.
|
Дано:
с
с
V
V |
|
Образуется ли осадок? |
При смешении растворов протекает следующая реакция:
СaCl2+Na2CO3=CaCO3↓+NaCl(7.6)
Осадок CaCO![]() образуется только в случае, если
образуется только в случае, если
с![]() ·с
·с![]() >ПР
>ПР![]() =5·10
=5·10![]() (табл.)
(табл.)
Поскольку смешали 100 cм![]() раствораCaCl
раствораCaCl![]()
![]() и
200cм
и
200cм![]() Na
Na![]() CO
CO![]() ,
то объем раствора после смешения
составляет 300cм
,
то объем раствора после смешения
составляет 300cм![]() .
После смешения с учетом разбавления
растворов концентрации ионовCa2+иCO
.
После смешения с учетом разбавления
растворов концентрации ионовCa2+иCO![]() 2-будут равны:
2-будут равны:
с![]() =
=
![]() с
с![]() ·
·![]() ·n
·n![]() ;
с
;
с![]() =
=
![]() с
с![]() ·
·![]() ·n
·n![]()
CaCl![]() иNa
иNa![]() CO
CO![]() -
сильные электролиты,
-
сильные электролиты,![]() =
1.
=
1.
Процессы диссоциации CaCl![]() иNa
иNa![]() CO
CO![]() протекают по следующим уравнениям:
протекают по следующим уравнениям:
CaCl![]() =
Ca
=
Ca![]() +2Cl
+2Cl![]()
Na![]() CO
CO![]() =
2Na
=
2Na![]() +CO
+CO![]()
следовательно, n![]() =
1 иn
=
1 иn![]() = 1.
= 1.
с![]() =
=
![]() 0,01·1·1 = 3,3·10
0,01·1·1 = 3,3·10![]() моль/л,
моль/л,
с![]() =
=
![]() 0,02·1·1 = 1,3·10
0,02·1·1 = 1,3·10![]() моль/л.
моль/л.
с![]() ·с
·с![]() = 3,3·10
= 3,3·10![]() ·1,3·10
·1,3·10![]() = 4,29·10
= 4,29·10![]()
Так как 4,29·10-5 > 5·10-9(ПР![]() ),
то осадокCaCO
),
то осадокCaCO![]() образуется.
образуется.
Ответ: осадок CaCO![]() образуется.
образуется.
3.Вычислить рН 0,0im водного раствора hno2, содержащего, кроме того, 0,02 моль/л kno2.
|
Дано:
с
с |
|
рН - ? |
рН
= - lg
с![]()
HNO2
<=> H+
+ NO![]() (7.7)
(7.7)
KNO2
= K+
+ NO![]() (7.8)
(7.8)
![]()
Прибавление
KNO2
к раствору HNO2
смещает равновесие диссоциации HNO2
влево за счет увеличения концентрации
иона NO2-.
В результате, в системе
устанавливается равновесие при новых
концентрациях Н+
и NO![]() ,
но значение константы диссоциации HNO2
при этом остается прежним.
,
но значение константы диссоциации HNO2
при этом остается прежним.
Тогда обозначим равновесную концентрацию ионов [Н+] в новых условиях через х:
[H+] = х моль/л.
Общая
равновесная концентрация иона [NO![]() ]
равна сумме концентраций
иона NO
]
равна сумме концентраций
иона NO![]() ,
образовавшегося при диссоциации HNO2
и при диссоциации KNO2:
,
образовавшегося при диссоциации HNO2
и при диссоциации KNO2:
[NO![]() ]
= с
]
= с![]() + с
+ с![]() .
.
из HNO2 из KNO2
Концентрация
ионов NO![]() ,
образовавшихся при диссоциации HNO2,
равна х моль/л, так как при диссоциации
1 моль HNO2
образуется 1 ион Н+
и 1 ион NO
,
образовавшихся при диссоциации HNO2,
равна х моль/л, так как при диссоциации
1 моль HNO2
образуется 1 ион Н+
и 1 ион NO![]() (из уравнения 7.7).
(из уравнения 7.7).
Концентрация
ионов NO![]() ,
образовавшихся при диссоциации КNO2
равна: с
,
образовавшихся при диссоциации КNO2
равна: с![]() = с
= с![]() ·α·n
·α·n![]() = 0,2·1·1 = 0,2 моль/л (из уравнения 7.8.),
= 0,2·1·1 = 0,2 моль/л (из уравнения 7.8.),
КNO2
- сильный электролит, α = 1, n![]() = 1.
= 1.
тогда
[NO![]() ]
= (х + 0,02) моль/л
]
= (х + 0,02) моль/л
Равновесная концентрация недиссоциированных молекул
[HNO2] = (0,01 – х) моль/л.
![]() =
4·10-4,
(табл.)
=
4·10-4,
(табл.)
так как, х << 0,01 моль/л, то значением х, ввиду его малого значения, в выражениях (х+0,02) и (0,01- х) можно пренебречь, и данное выражение записать в виде:
![]() ;
откуда х = [H+] = 2·10-4 моль/л
;
откуда х = [H+] = 2·10-4 моль/л
рН = -lg(2·10-4) = 3,7
Ответ: рН = 3,7
8. Гидролиз солей уровень в
Составить ионно-молекулярное и молекулярное уравнения гидролиза карбоната калия (K2CO3). Вычислить константу, степень и рН гидролиза соли в 0,01М растворе.
|
Дано:
Kг
- ?
h - ? pH- ? |
РЕШЕНИЕ: |

K2CO3 + H2O <=> KHCO3 + KOH

 KOH
+ H2CO3
KOH
+ H2CO3
HCO3-
K+
OH-
K+

 СО32-
+ НОН
<=> + , рН>7,
среда
СО32-
+ НОН
<=> + , рН>7,
среда
 щелочная
щелочная
Kг
= ![]() ,
,
![]() (табл.).
(табл.).
Kг =![]() ,
,
![]() ,
,
![]() =0,14,
=0,14,
pH+ рОН=14.
Так как среда щелочная, то определяем
![]() :
:
pОН= -1/2∙lgKг
-1/2∙lg![]() =
=
=
=![]() 2,84
2,84
рН = 14-рОН, рН = 14-2,84=11,16,
Ответ:
![]()
Рассчитать при температуре 300К константу, степень и рН гидролиза нитрат аммония (NH4NO3) в 1М растворе, используя значения термодинамических характеристик реакции гидролиза соли. Написать ионно-молекулярное и молекулярное уравнение гидролиза этой соли.
∆гНо(298 К) = 51,14 кДж;
∆гSo(298 K) = - 4,67 Дж/К.
|
Дано:
∆гНо(298К)=51,14
кДж
∆гSo(298K)=
- 4,67Дж/К
T=300K
Kг-?
h-? pH-?
|
РЕШЕНИЕ:
|
NH4NO3+H2O<=>NH4OH+HNO3
N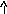
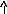 H4OH+HNO3
H4OH+HNO3
с
Н+
NO3-
NH4++HOH<=>NH4OH+ ,pH<7, среда


 кислая
кислая
![]() (8.1)
(8.1)

![]() ,
,
![]() =2,67·10-5
=2,67·10-5
Т.к. среда кислая, то определяем рН:
![]()
![]()
![]()
![]() ,
,
рН = -1/2∙(-9,15)-1/2∙lg1= 4,60.
Ответ:
![]()
Какая из двух солей хлорид цинка (ZnCl2) или хлорид меди (СuCl2), при равных концентрациях в большей степени подвергается гидролизу? Ответ мотивировать расчетом отношения степеней гидролиза обеих солей. Составить ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
|
Дано:
|
РЕШЕНИЕ:
|
|
|
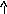
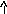 ZnCl2+H2O<=>ZnOHCl+HCl
ZnCl2+H2O<=>ZnOHCl+HCl
Zn(OH)2+HCl
с
H+
Cl-
ZnOH+
Cl-

 Zn2+ +HOH< = > + , рН <
7 - среда
Zn2+ +HOH< = > + , рН <
7 - среда
 кислая
кислая
CuCl2+H2O< = >CuOHCl+HCl
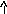
 Cu(OH)2+HCl
Cu(OH)2+HCl
л
CuOH+
Cl-
H+
Cl-
Cu2+ +HOH< = > + , рН < 7 - среда


 кислая
кислая
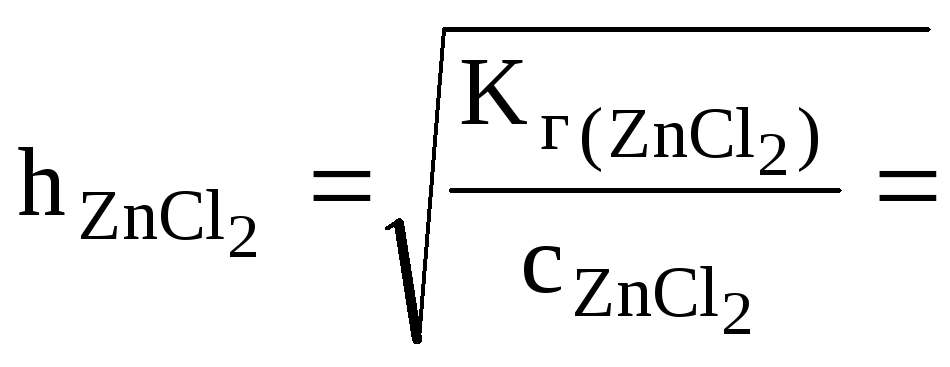
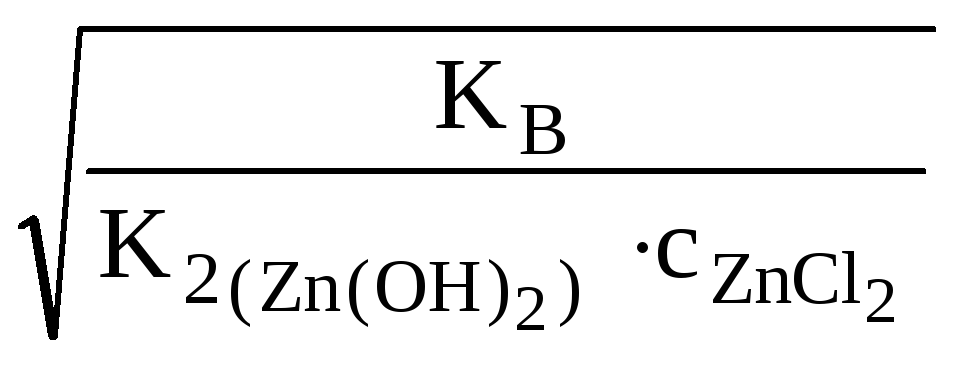 ,
,
![]() (табл.
).
(табл.
).
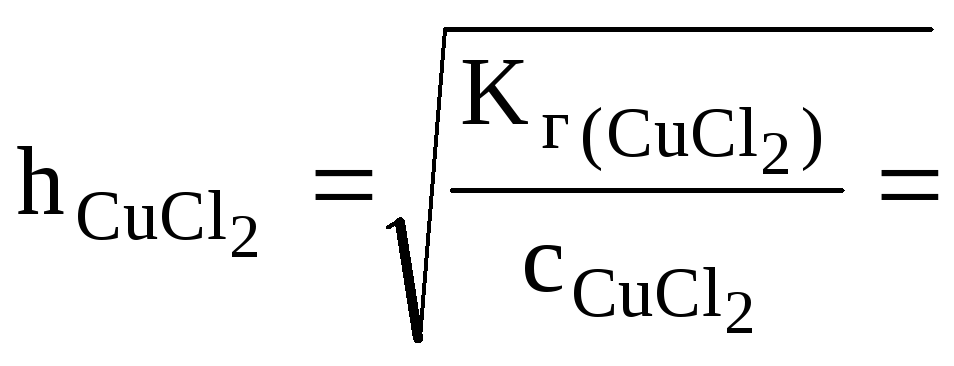
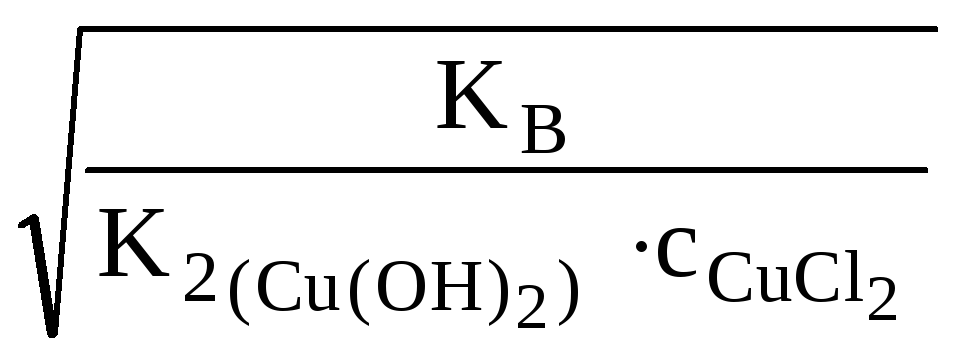
![]() (табл.)
(табл.)
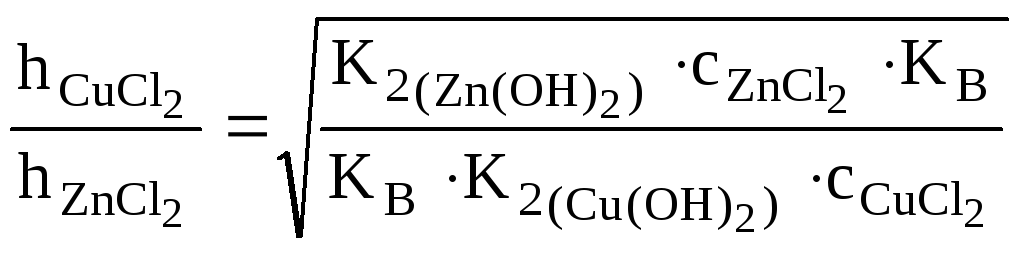 =
=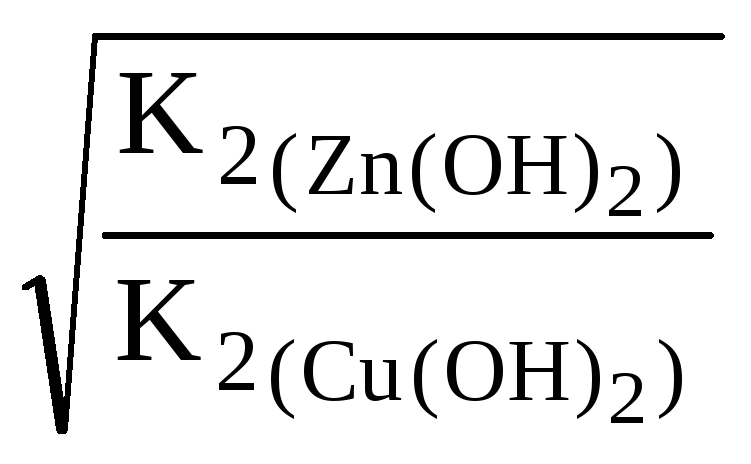 =
=
=
![]() =
10,85.
=
10,85.
Ответ: Степень гидролиза CuCl2в 10,85 раз больше степени гидролизаZnCl2, поэтомуCuCl2в большей степени подвергается гидролизу, чемZnCl2.

