
- •Радиометрические методы анализа
- •Содержание
- •Введение
- •1. Теоретические основы радиометрических методов
- •1.1. Типы радиоактивного распада и радиоактивного излучения
- •1.2. Закон радиоактивного распада
- •1.3. Взаимодействие радиоактивного излучения с веществом и счетчики излучения
- •1.4. Классификация источников радиоактивного излучения и радиоактивных изотопов
- •2. Методы определения содержания химических элементов по излучению их естественных радиоактивных изотопов
- •3. Метод изотопного разбавления
- •4. Радиоактивационный анализ
- •5. Радиометрическое титрование
- •6. Фотонейтронный метод
- •7. Практическое применение метода осаждения
- •Заключение
5. Радиометрическое титрование
При радиометрическом титровании индикаторами являются радиоактивные изотопы элементов. Например, при титровании фосфата магнием в анализируемый раствор вводят небольшое количество фосфата, содержащего радиоактивный Р*.
При титровании протекает реакция
Изменение
активности в ходе этого титрования
можно видеть на рис.1, а. Здесь же показано
графическое определение точки
эквивалентности (т.э.). До т.э. активность
раствора будет резко убывать, так как
радиоактивный
из
раствора будет переходить в осадок.
После т.э. активность раствора будет
оставаться практически постоянной и
очень небольшой.
Реакции радиометрического титрования должны удовлетворять требованиям, обычно предъявляемым к реакциям титриметрического анализа (скорость и полнота протекания реакции, постоянство состава продукта реакции и т. д.). Очевидным условием применимости реакции в данном методе является также переход продукта реакции из анализируемого раствора в другую фазу, с тем чтобы устранить помехи при определении активности раствора. Этой второй фазой часто является образующийся осадок. Известны методики, где продукт реакции экстрагируется органическим растворителем. Например, при титровании многих катионов дитизоном в качестве экстрагента применяют хлороформ или тетрахлорид углерода. Применение экстракции позволяет более точно установить точку эквивалентности, так как в этом случае для ее определения можно измерять активность обеих фаз.
Рис.1. Типы кривых радиометрического титрования:
а – изменение активности раствора фосфата, содержащего Р* при титровании раствором Mg2+; б – изменение активности раствора Mg2+ при титровании фосфатом, содержащим Р*.
6. Фотонейтронный метод
Метод основан на образовании нейтронов под действием фотонов высокой энергии на ядра химических элементов:
Для осуществления этой реакции необходимы фотоны, энергия которых больше энергии связи нуклонов в ядре. Энергия связи нуклонов в ядре большинства химических элементов составляет около 8 МэВ.
Для получения фотонов такой энергии необходимы специальные установки, которые затрудняют измерение интенсивности потока нейтронов. Энергия γ-квантов радиоактивного распада не превышает З МэВ.
С помощью γ-квантов радиоактивных источников возможны лишь реакции с дейтерием (энергия связи нуклонов – 2,226 МэВ) и бериллием (энергия связи нуклонов – 1,666 МэВ).
В настоящее время фотонейтронный метод применяется только для определения бериллия: 9Ве (γ, n) 8Ве.
7. Практическое применение метода осаждения
В качестве иллюстрации метода осаждения в присутствии радиоактивного элемента приведём метод соосаждения протактиния (V) в виде солей анионных комплексов и комплексов с реагентами группы арсеназо.
Применение органических соосадителей для изучения форм состояния и комплексообразования элементов при высоких разбавлениях является новым приемом, для которого полезны подтверждения его надежности.
Ниже описаны способы соосаждепия протактиния с органическими соосадителями.
Этот элемент представляет интерес в том отношении, что образование им комплексных соединений исследовалось приемами ионного обмена, экстракции, спектрофотометрии, и, следовательно, результаты, вытекающие из соосаждения, могут быть сопоставлены с другими данными.
Изучение новых способов соосаждения протактиния представляет также и прямой интерес, так как метод соосаждения с органическими соосадителями иногда может иметь преимущества перед способами концентрирования соосаждением с неорганическими соосадителями, экстракцией или ионным обменом. И во всяком случае новые способы концентрирования могут явиться полезным дополнением к другим уже известным способам.
Для концентрирования протактиния из разбавленных растворов предложен ряд неорганических коллекторов. Концентрирование протактиния производят с гидроксидом марганца, фторидами различных металлов, с фениларсенатом циркония и другими солями органических кислот. Имеются данные по соосаждению протактиния с избытком органического осадителя N-бензоилфенилгидроксиламина.
Химию водных растворов протактиния в общих чертах можно представить следующим образом.
По данным Старика с сотрудниками, в сильнокислых средах в области 8–12 М HNO3 доминируют анионные комплексы [Pa(OH)(NO3)5]–, [Pa(NO3)6]–, [Pa(NO3)7]2– и др.; в 1–4 М HNO3 протактиний существует в виде катионов Ра(ОН)32+, Ра(ОН)23+, Ра(ОН)4+ и др.
Подтверждением данных о существовании протактиния в форме анионных комплексов при высокой концентрации соляной кислоты может служить способность протактиния соосаждаться из растворов с осадком хлорида органического катиона. В условиях высокой кислотности пригодным соосадителем оказался хлорид индулина, применявшийся ранее для соосаждения галлия в виде соли его хлоридного аниона.
Для констатации присутствия протактиния в гидролизованной форме был применен коллоидно-химический механизм соосаждения. Coосаждение осуществлялось с осадком танната индулина.
Соосаждение элементов, образующих легко гидролизующие катионы, всегда осложняется наличием части элемента в виде так называемых радио-коллоидов, т. е. в адсорбированном состоянии на совершенно посторонних суспендированных частичках. Это обстоятельство затрудняет и изучение соосаждения протактиния с органическими комплексообразующими реагентами. Для устранения этой помехи исследование по соосаждению протактиния с органическими комплексообразующими реагентами проводилось в растворах с подобранной минимальной концентрацией винной кислоты, достаточной для практически полного предотвращения такого захвата протактиния. Применение винной кислоты удобно при изучении влияния различных факторов на полноту соосаждения. Но вследствие связывания протактиния винной кислотой его соосаждение даже при оптимальных условиях не совсем полное.
Техника эксперимента
Для работы использовали препарат протактиния Ра233 с периодом полураспада 27,4 дня, являющийся β- и γ-излучателем. Радиохимическая чистота контролировалась на γ-анализатое. Препарат содержал менее 0,1% посторонних радиоактивных примесей.
Для работы применяли раствор хлорида протактиния, предварительно очищенный от радиоколлоидов. Для проведения этой очистки к солянокислому раствору протактиния добавляли мацерированную бумагу и производили фильтрование раствора на полиэтиленовой воронке через бумажный фильтр марки «синяя лента» в полиэтиленовый сосуд. Раствор пропускали 3–4 раза через тот же самый фильтр до получения постоянной активности фильтрата. Винная кислота при приготовлении раствора не добавлялась. Растворы протактиния хранились в полиэтиленовых сосудах. Для работы использовали раствор протактиния в 10 M НСl с концентрацией 2∙10-6 γ Ра/мл.
Соосаждение протактиния в виде солей его комплексных анионов
Производилось изучение влияния концентрации соляной кислоты и других кислот на полноту соосаждения протактиния. Для этого к 100 мл разбавленной соляной или другой кислоты изучавшейся концентрации добавляли раствор протактиния. Растворы выдерживали в течение 10–15 мин. и далее при перемешивании добавляли спиртовой раствор хлорида индулина. После 30-минутного выстаивания осадки отфильтровывали, подсушивали, переносили в фарфоровые тигли (высотой 20 мм и верхним диаметром 25 мм) и озоляли в муфельной печи при постепенном повышении температуры до 500°С. Зольные остатки смачивали, смывая стенки тигля несколькими каплями 6 М НСl, которую выпаривали на водяной бане. В остатках определяли количество соосажденного протактиния на β-счётчике.
Соосаждение протактиния при применении реагентов группы арсеназо и соосаждение гидролизованных форм протактиния
При работе с реагентами группы арсеназо к 2 мл раствора протактиния в 3 М НС1 добавляли 25 мл 10%-й винной кислоты, далее прибавляли реагент комплексообразователь группы арсеназо. Затем вводили добавочное количество разбавленной кислоты или раствор уротропина, аммиака или щелочи до требуемого рН. В последнюю очередь вводился кристаллвиолет или родамин В.
При работе с таннином к 2 мл раствора протактиния в 3 М НС1 добавляли добавочное количество разбавленной кислоты, воды или раствора уротропина до требуемого рН. Далее добавлялось 5 мл 1%-го раствора таннина и 10 мл 1%-го спиртового раствора индулина. После 30-минутного стояния осадки отфильтровывались. Дальнейшая обработка остатка проводилась по описанному выше способу.
Ha рисунке 2 представлена общая картина по соосаждению протактиния, присутствующего в растворах в различных состояниях.
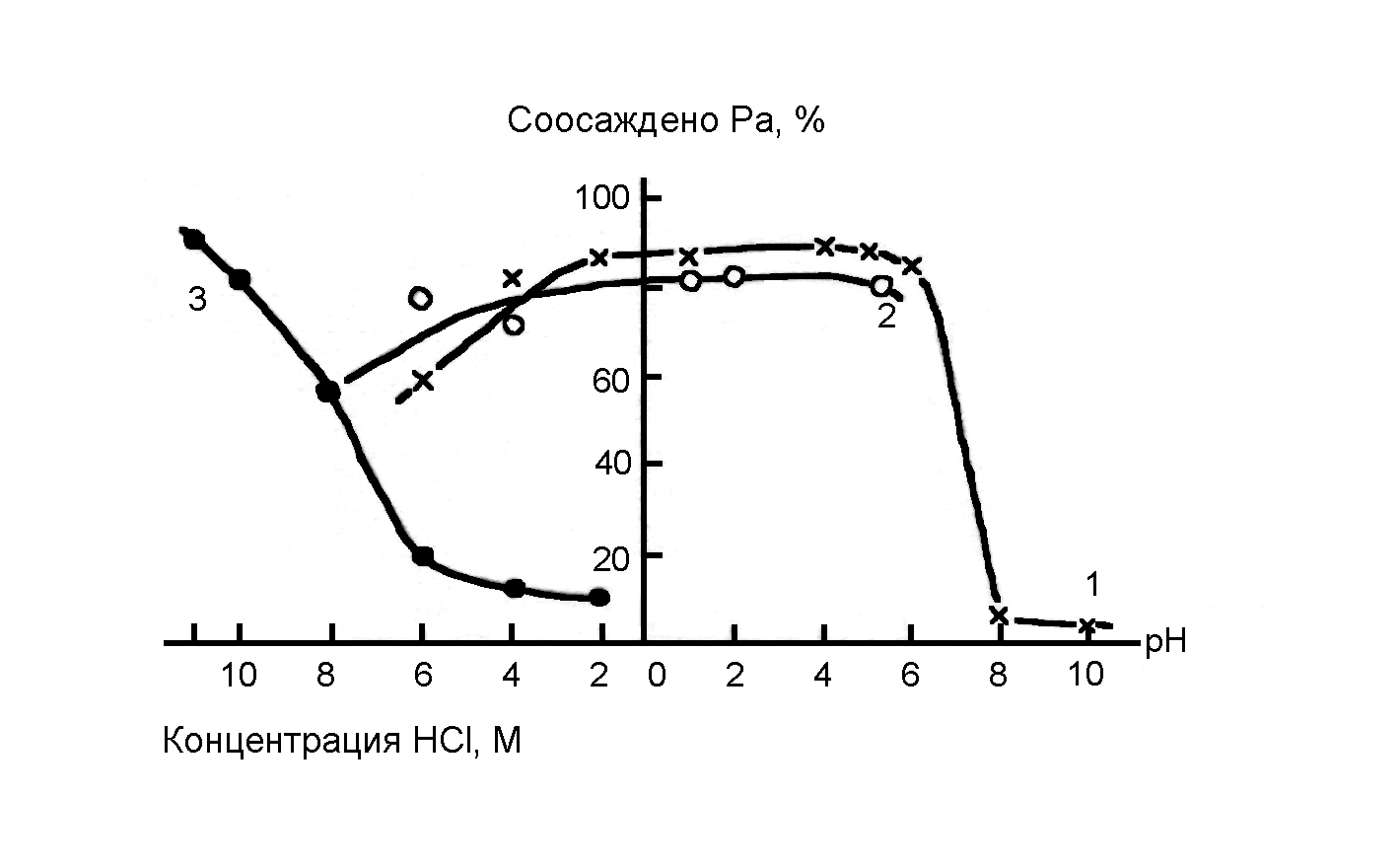
Рис.2. Соосаждение протактиния в виде солей хлоридных анионов, хелатных соединений и гидролизованных форм. Концентрации: протактиний 6∙10-5 М, арсеназо II 0,4∙10-3, кристаллвиолет, родамин В 0,9∙10-3 М, индулин солянокислый 0,1%, таннин 0,05%.
1 – арсеназо II + кристаллвиолет (рН = 0–10), арсеназо II + родамин (2– 6 М HCl); 2 – таннин + индулин солянокислый; 3 – индулин солянокислый.
На полноту соосаждения протактиния с осадком танната индулина оказывает влияние степень гидролиза катионов протактиния. При концентрации соляной кислоты нише 3 М возможно практически полное соосаждение протактиния не только с комплексообразующими реагентами, но и с реагентами, соосаждающими протактиний по коллоидно-химическому механизму. Отчетливо видно, что в зависимости от формы состояния протактиния в растворе наиболее полное соосаждение обеспечивают тот механизм соосаждения, который наиболее подходит для имеющейся формы. Из сильнокислого раствора, где протактинии присутствует в виде аниона, он соосаждается в виде солей его хлоридных анионов. В тех областях, где протактиний способен образовывать хелатные соединения, пригодным является соосаждение с осадками, образованными арсеназо и его аналогами в комбинации с основным красителем. При этих же условиях практически полного соосаждения протактиния можно достигнуть по коллоидно-химическому механизму.
Выводы
Из растворов протактиния с концентрацией до 6∙10-15 M протактиний может быть практически количественно соосажден с органическими соосадителями. Для соосаждения протактиния из сильнокислых растворов ( >10 М НС1) в виде соли анионного комплекса пригоден хлорид индулина. В комбинации с основными красителями протактиний соосаждается в виде хелатных соединений: с арсеназо I ( рН = 1,5–5,5), с арсеназо II (3 М НCl до рН = 6,5), с арсеназо III (3 М НС1 до рН = 4). При кислотности 3 М НС1 до рН = 5,5 для соосаждения протактиния пригодна комбинация таннина с хлоридом индулина.
