
- •Сегодня: Thursday, July 4, 2019
- •1. Основные понятия и определения молекулярной физики и термодинамики
- •Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о
- •Атомная единица массы (а.е.м.) – (mед) – единица массы, равная 1/12 массы изотопа
- •Моль – это стандартизированное количество любого вещества, находящегося в газообразном, жидком или твердом
- •Число частиц в киломоле любого вещества постоянно и равно величине, названной, в последствии,
- •При одинаковых температурах и давлениях все газы содержат в единице объёма одинаковое число
- •Идеальным газом называется газ, для которого:
- •Под скоростью 2 понимают
- •Иногда за основное уравнение принимают
- •Внутреннее давление является одним и тем же во всех направлениях и во всем
- •Величину T называют абсолютной температурой и
- •Тогда
- •Основное уравнение молекулярно-
- •Единицы измерения температуры
- •В физике и технике за абсолютную шкалу температур принята шкала Кельвина, названная в
- •Законы идеальных газов
- •График изохорического процесса на РV диаграмме называется изохорой. Графики изохорического процесса на РТ
- •График изобарического процесса на VT диаграмме называется изобарой. Графики изобарического процесса на РV
- •График изотермического процесса на РV –
- •4. Адиабатический процесс
- •6. Закон Авогадро
- •7. Закон Дальтона
- •8. Объединённый газовый закон (Закон Клапейрона).
- •Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
- •Если обозначим Vm ρ – плотность газа, то
- •Согласно закону Дальтона: полное давление смеси газа равно сумме парциальных давлений всех газов,
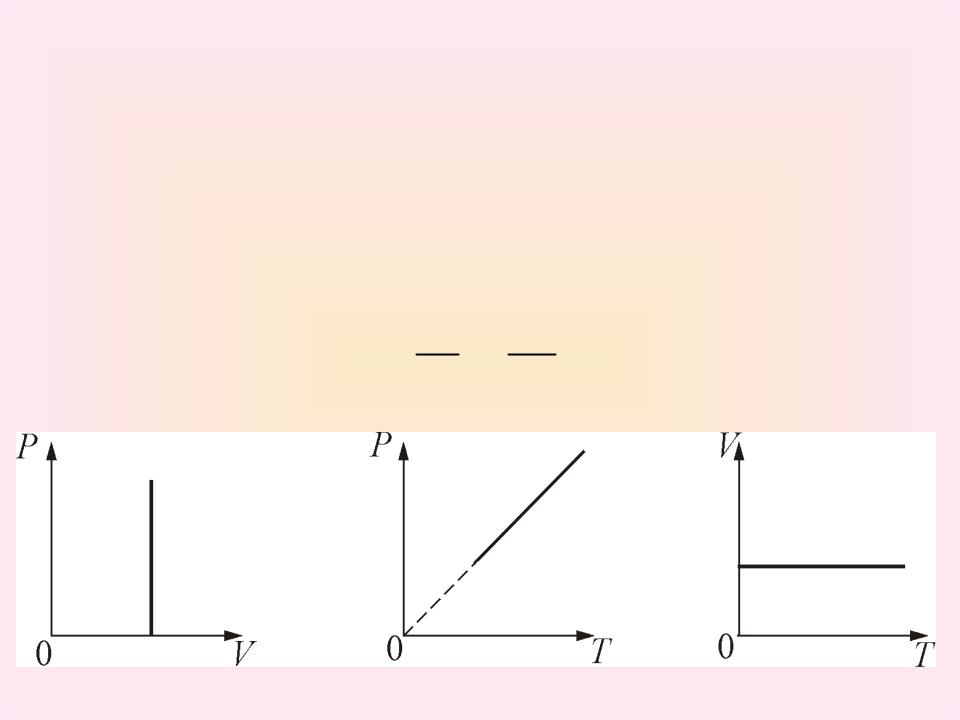
График изохорического процесса на РV диаграмме называется изохорой. Графики изохорического процесса на РТ и VT диаграммах представлены на рисунке
Уравнение изохоры:
P1 P2 .
T1 T2
21

2. Изобарический процесс. Р = const.
Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака:
V/T = const
«При постоянном давлении и неизменных значениях массы газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным».
22

График изобарического процесса на VT диаграмме называется изобарой. Графики изобарического процесса на РV и РT диаграммах приведены на рисунке.
Уравнение изобары:
V1 V2
T1 T2
23

3. Изотермический процесс. T = const.
Изотермическим процессом называется процесс, протекающий при постоянной температуре Т.
Поведение идеального газа при изотермическом процессе подчиняется закону Бойля-Мариотта:
РV = const
«При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным».
24
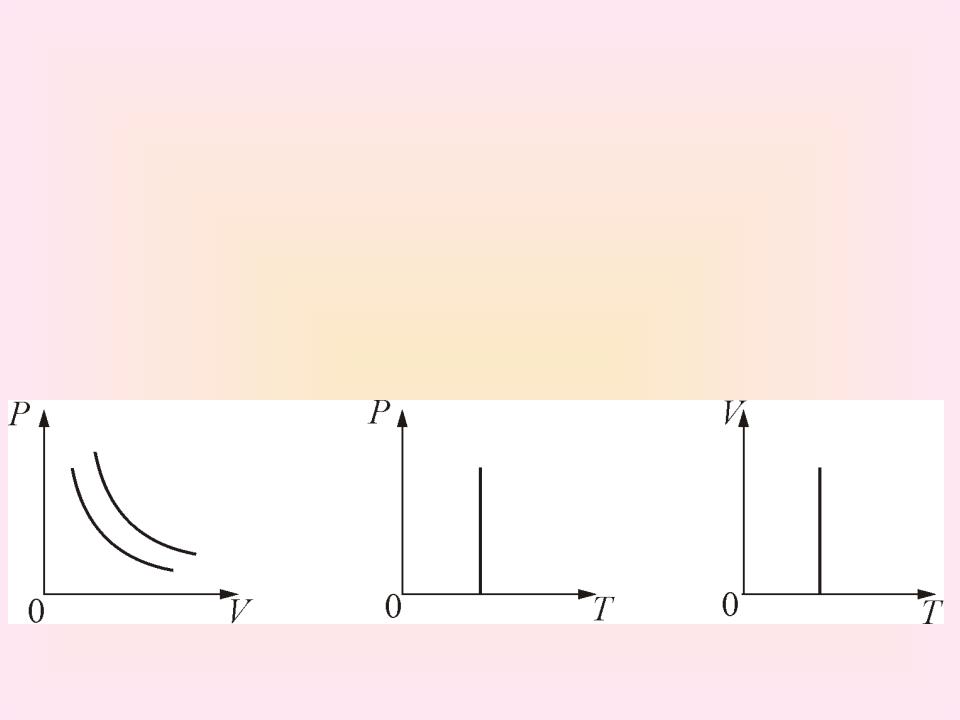
График изотермического процесса на РV –
диаграмме |
называется |
|
изотермой. |
|
На |
рисунке |
приведены |
графики |
|
изотермического процесса на VT и РT |
||||
диаграммах. |
|
|
|
|
Уравнение изотермы |
P1V1 = P2V2 |
|||
25

4. Адиабатический процесс
(изоэнтропийный).
Процесс, происходящий без теплообмена с окружающей средой.
5. Политропический процесс.
Процесс, при котором теплоёмкость газа остаётся постоянной.
Политропический процесс – общий случай всех перечисленных выше процессов.
26

6. Закон Авогадро
При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул.
В одном моле различных веществ содержится
NA = 6,02 1023
молекул (число Авогадро).
27

7. Закон Дальтона
Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов
Pсм = Р1 + Р2 + … + Рn
(Р1 – давление, которое оказывал бы
определённый газ из смеси, если бы он занимал весь объём).
28

8. Объединённый газовый закон (Закон Клапейрона).
В соответствии с законами Бойля-Мариотта и Гей-Люссака можно сделать заключение, что для данной массы газа
P1V1 |
|
P2V2 |
или |
PV |
const. |
|
T |
T |
T |
||||
|
|
|
||||
1 |
2 |
|
|
|
||
Это объединённый газовый закон Клапейрона.
29

Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
Менделеев объединил законы Бойля-Мариотта, Гей-Люссака и Шарля с законом Авогадро:
|
PV m RT |
здесь m |
|
– число молей. |
|
|
|
Для одного моля можно записать
PV RT
30
