
- •Лекция 2. ВВЕДЕНИЕ В ХИМИЧЕСКУЮ КИНЕТИКУ
- •Плазмохимия изучает кинетику и механизм химических превращений
- •Основные понятия химической кинетики
- •Закон действия масс:
- •Кинетическая кривая—график зависимости концентрации реагента или продукта реакции от времени.
- •Элементарный химический акт - превращение одной или нескольких
- •Распределение Максвелла.
- •Типы химических реакций:
- •7.Мономолекулярная реакция - простая реакция, в каждом элементарном акте которой участвует только одна
- •Кинетическая схема реакции - совокупность предполагаемых элементарных стадий, из которых складывается суммарный химический
- •Увеличение скорости реакции в плазме
- •Увеличение скорости реакции в плазме
- •Увеличение скорости реакции в плазме
- •Внутренняя энергия молекулы
- •Энергозапас различных форм движения молекул в основном электронном состоянии
- •Распределение энергии электрона при возбуждении молекулы H2O:
- •Время существования избыточной внутренней энергии
- •Рекомендуемая литература:
- •Темы семинарских занятий.

Лекция 2. ВВЕДЕНИЕ В ХИМИЧЕСКУЮ КИНЕТИКУ
Основные понятия химической кинетики Типы химических реакций Кинетическая схема реакции Увеличение скорости реакции в плазме Внутренняя энергия молекулы Рекомендуемая литература
1
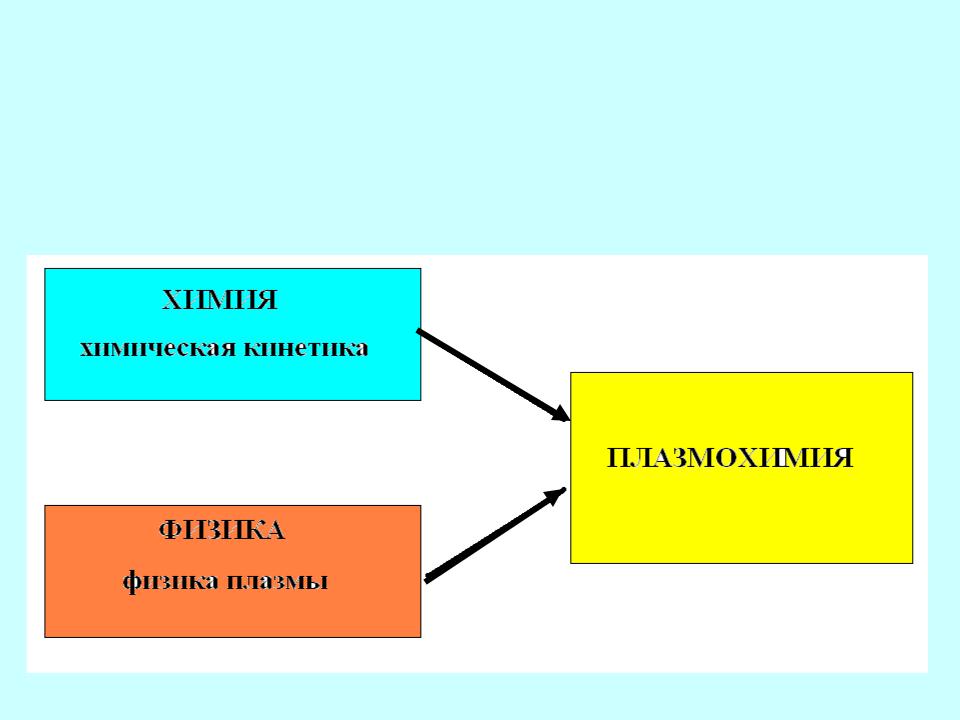
Плазмохимия изучает кинетику и механизм химических превращений
и физико-химических процессов в низкотемпературной плазме.

Основные понятия химической кинетики
Химическая кинетика рассматривает превращение одних веществ в другие как процесс, протекающий во времени по определенному механизму.
Предмет исследования химической кинетики — химические реакции.
A + B → C + D
Скорость химической реакции.
Скорость химической реакции определяется как изменение концентрации одного из реагирующих веществ за единицу времени.
Например, для реакции A + 2B → C
v dCA 0.5 dCB dCC |
||
dt |
dt |
dt |
3

Закон действия масс:
Скорость элементарной химической реакции в каждый момент времени пропорциональна концентрациям реагентов.
v = k·CA·CB
k - константа скорости реакции
Константа скорости реакции зависит только от природы реагирующих веществ и от температуры, но не зависит от их концентраций.
Уравнение, связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции.
Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислять скорости реакции при других концентрациях тех же реагирующих веществ.
4

Кинетическая кривая—график зависимости концентрации реагента или продукта реакции от времени.
C(t) = C0·exp(-kt)
v dCdt(t) k CA (t) CB (t)
при CA << CB
v dCdt k CA
dCС k dt

6

v = k·CA·CB F2 + NO = NOF + F
k - константа скорости реакции
Уравнение Аррениуса:
k Aexp( Ea / kT )
Это выражение справедливо для квазиравновесных условий:
-сохранение равновесных условий при протекании химической реакции - для адиабатических (медленных) столкновений
-при возможности рассмотрения соударений молекул
в модели твердых шаров.

Элементарный химический акт - превращение одной или нескольких
находящихся в контакте частиц (молекул, радикалов, ионов) в другие |
|||||
частицы за время порядка 10-13 с. |
|
|
|||
Его характеристикой является уровневый коэффициент |
|||||
скорости |
|
|
|
|
|
ki |
f ( )d |
||||
|
порi i ( ) |
||||
элементарной реакции k |
|
|
|||
где σi(ε) - сечение реакции с молекулой в i-м энергетическом
состоянии,
f(ε) - функция распределения частиц по энергиям, ε - энергия частицы, εпор - пороговая энергия процесса.
Суммарная константа скорости химической реакции k∑ равна |
|
k |
iki |
|
i |
где αi - относительные заселенности соответствующих |
|
квантовых уровней. |
8 |

Распределение Максвелла.
2 |
|
m |
|
3/ 2 |
mv2 |
|||
F(v) 4 v |
|
|
0 |
|
|
e 2kT |
||
|
|
|
||||||
|
|
|
2 kT |
|
||||
|
mVср2 |
|
|
|
3 |
kT |
|
|
2 |
|
|
2 |
|
||||
|
|
|
|
|
|
|||
График распределения молекул метана по скоростям (функция Максвелла) при температуре 300 (1) и 400 К (2).
9

Типы химических реакций:
1. Простая (элементарная) реакция
состоит из одних и тех же элементарных актов.
2. Сложная реакция
складывается из нескольких разнотипных элементарных актов.
3.Гомогенная химическая реакция
протекает в одной фазе.
4.Гетерогенная химическая реакция
протекает на границе раздела фаз.
5.Гемолитическая химическая реакция (реакция диссоциации) сопровождается разрывом одной (или нескольких) двухэлектронной связи с образованием частиц с нечетным числом электронов (атомов, радикалов)
6.Каталитическая реакция
Реакция с участием катализатора |
10 |
|
