
лекции_1 / Лекция 2_Структура твердого тела
.pdf
Лекция 2. Структура твердого тела
Строение твердого тела. С физической точки зрения твердыми телами считаются только кристаллы. Их атомы располагаются в узлах регулярной пространственной структуры - кристаллической решетки, структурной единицей которой является элементарная ячейка. Примеры ряда структурных схем кристаллов приведены на рис. 2.1.
а |
б- ГЦК решетка (Cu) |
в - ОЦК решетка (Fe) |
|
д- Рутил ( |
|
|
г |
ТіО2 |
) |
||||
|
Рис. 2.1. Схемы элементарных ячеек
В общем случае элементарная ячейка имеет вид косоугольного параллелепипеда (рис. 2.1,а), характеризуемого разными значениями сторон а, б, с и углов α, β, γ. По соотношению сторон и углов выделяют 7 кристаллических систем. Наиболее распространенными являются решетки кубические (рис. 2.1,б,в) и гексагональные (рис.2.1,г). Если в центрах граней куба располагаются дополнительные атомы, то решетка называется гранецентрированной (ГЦК) (рис.2.1,б), если атом внедряется в центр куба - решетка объемноцентрированная (ОЦК) (рис. 2.1,в). Гексагональная плотноупакованная решетка (рис. 2.1,г) имеет ячейку с основанием в виде правильного шестиугольника. Кубические решетки типа ГЦК и
ОЦК характерны для сталей. Между атомами в решетке возможны связи 3-х типов: ионная, ковалентная, металлическая. В первом случае в узлах находятся положительные и отрицательные ионы, во втором - нейтральные атомы, валентные электроны которых образуют пары, движущиеся в поле соседних ядер. Связь имеет квантовомеханическую природу. Металлическая связь возникает между атомами металлов. Валентные электроны в этом случае обобществляются, покидают свои атомы и совершают хаотическое тепловое движение в общем поле атомных остатков, находящихся в узлах решетки (свободные электроны). В таблице 2.1. представлены величины энергии перечисленных видов связей и указаны характерные свойства кристаллов.
Тип кристаллической структуры материала и совокупность его свойств определяются взаимодействием атомов, основой которого является электростатическое взаимодействие. Кроме электростатических сил между атомами действуют электродинамические, магнитные и обменные силы. В общем случае взаимодействия двух изолированных атомов потенциальная энергия (U) одного атома в поле другого атома может быть представлена в виде ряда:
U = |
c1 |
+ c22 |
+ ...+ |
cn |
. |
(2.1) |
r |
n |
|||||
|
r |
|
r |
|
||
Значения коэффициентов с1, с2 и т.д. зависят от величин зарядов и координат, которые указывают на положение зарядов в пространстве. Так как между атомами действуют силы притяжения и отталкивания, то коэффициенты имеют разные знаки.
В простейших случаях ограничиваются двумя слагаемыми, один из которых определяет притяжение, другой – отталкивание:
U = − |
A |
+ |
B |
, |
(2.2) |
m |
n |
||||
|
r |
r |
|
||
где А, В, m, n - коэффициенты. Формула взаимодействия между двумя атомами получается дифференцированием выражения (3.2):
∂U |
= f = |
mAm +1 − |
nB |
. |
(2.3) |
∂r |
n+1 |
||||
|
r |
r |
|
||
На рис. 2.2 показаны потенциальная энергия и сила взаимодействия двух атомов в зависимости от расстояния между атомами.
Отметим, что сила взаимодействия между атомами в зависимости от их природы может быть ковалентной, ионной, молекулярной, металлической, водородной. Тип связи, возникающий между атомами в кристалле, определяется их электронным строением. Атомы сближаются на определенное расстояние, которое обеспечивает кристаллу термодинамическую стабильность. В таблице 2.2 приведены значения энергии связи, необходимой для разделения твердого тела на отдельные нейтральные атомы, для некоторых металлов. Видно, что имеет место существенное отличие в значениях энергии связи для разных элементов. Для большинства случаев с увеличением энергии связи растут температура плавления, модуль упругости, энергия активации самодиффузии, а, например, коэффициент линейного расширения уменьшается. Характерным для кристаллов является анизотропия их свойств, которая обусловлена разным взаимодействием атомов в различных кристаллографических направлениях.

Рис. 2.2. Потенциальная энергия и сила взаимодействия Na и Cl в зависимости от расстояния между ними
(http://dssp.petrsu.ru/files/tutorial/ftt/Part2/part2_2.htm)

Таблица 2.1. Энергия связи и некоторые свойства кристаллов
|
Тип |
|
|
Примеры |
Энергия связи, |
|
|
Некоторые свойства |
|
|
||||||||
|
связи |
|
|
кристаллов |
|
кДж/моль |
|
|
|
|
кристаллов |
|
|
|
||||
|
Ионная |
|
|
|
NaCl |
~ 1000 |
|
Малая электропроводность при низких и хорошая |
|
|||||||||
|
|
|
|
|
|
LiF |
|
|
|
|
ионная проводимость при высоких температурах. |
|
||||||
|
|
|
|
|
|
MgO |
|
|
|
|
Высокие прочность, твердость и температура |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
плавления, хрупкое разрушение |
|
|
|
||||
|
Ковалентная |
|
C(алмаз), |
~ 700 |
|
|
Высокая твердость, низкая электропроводность при |
|
||||||||||
|
|
|
|
|
Si, Ge, TiN, |
|
|
|
|
малых температурах, хрупкость. Некоторые материалы |
|
|||||||
|
|
|
|
|
WC, SiC |
|
|
|
|
являются полупроводниками |
|
|
|
|||||
|
Металлическая |
|
Fe, Cu, Al, |
~ 400 |
|
|
Высокая электропроводность и пластичность |
|
|
|||||||||
|
Молекулярная |
Молекулы в |
~ 10 |
|
|
Низкая температура плавления, сильная сжимаемость, |
|
|||||||||||
|
|
|
|
|
полимерах |
|
|
|
|
пластичность, ползучесть, вязкая упругость |
|
|
||||||
|
|
|
|
|
Ar, CH4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Водородная |
|
H2O, HF |
~ 50 |
|
|
Склонность |
к |
образованию |
разветвленных |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
многомолекулярных структур |
|
|
|
||||
|
Таблица 2.2. Значения энергий химической связи для некоторых элементов, эВ/ат |
|
|
|
||||||||||||||
|
Sc |
|
Ti |
|
V |
|
Cr |
|
Mn |
Fe |
Co |
|
Ni |
Cu |
Zn |
|
||
|
3,93 |
|
4,855 |
|
5,30 |
|
4,10 |
|
2,98 |
2,29 |
4,387 |
|
4,435 |
3,50 |
1,35 |
|
||
|
Y |
|
Zr |
|
Nb |
|
Mo |
|
Tc |
Ru |
Rh |
|
Pd |
Ag |
Cd |
|
||
|
4,387 |
|
6,316 |
|
7,47 |
|
6,81 |
|
− |
6,615 |
5,752 |
|
3,936 |
2,96 |
1,16 |
|
||
|
La |
|
Hf |
|
Ta |
|
W |
|
Re |
Os |
Ir |
|
Pt |
Au |
Hg |
|
||
|
4,491 |
|
6,35 |
|
8,089 |
|
8,66 |
|
8,10 |
− |
6,93 |
|
5,852 |
3,78 |
0,694 |
|
||

Когда атомы объединяются в кристалл, то потенциальные кривые накладываются и у расположившихся в цепочку атомов (рис. 2.3) результирующая кривая имеет периодический характер. Периодический характер имеет и зависимость силы от координаты, график которой изображен тонкой линией.
Рис.2.3. Силовые и энергетические характеристики межатомного взаимодействия
Исходя из этого, напряжение, вызывающее сдвиг одной части кристалла относительно другой вдоль плоскости параллельной оси Х, так же, как и сила, препятствующая смещению атома А в положение А1, может быть представлено в виде
τ = Ksin |
2π x |
|
|
|
b |
. |
(2.3) |
||
|
||||
|
|
|
С другой стороны, по закону Гука τ =Gx/h. Здесь G - модуль сдвига, b и h - параметры решетки. Поскольку сдвиговые деформации начинаются при х << b (в алюминии при х/b 0,002), то
sin(2π x/b) 2π x/b.
Тогда K 2πx/b Gx/h, следовательно, K≤Gb/2πh, а сдвиговое напряжение
τ = |
Gb |
sin |
2π x |
|
|
|
2π h |
b . |
(2.4) |
||||
|
|
|||||
Максимального значения сила сопротивления достигает при сдвиге, равном b/4 (рис. 2.3), поэтому
τmax = |
Gb |
|
2π |
|
b |
|
|
2πh |
b |
|
|
||||
|
|
4 . |
(2.5) |
||||
Считая h b, получаем, что теоретическое значение сопротивления сдвигу τmax G/4. Это
весьма большая величина. В частности, для стали G 80 ГПа, следовательно, τmax 20 ГПа. В действительности сопротивление сдвигу конструкционной стали, по крайней мере, на 2 порядка ниже.
Причиной столь большого расхождения между теоретической и истинной прочностью являются дефекты кристаллической решетки. Из-за дефектов сдвиг происходит не одновременно по всей атомной плоскости, а скольжение начинается на одном или нескольких участках, а затем распространяется по всей плоскости с конечной скоростью, как это происходит при разрыве бумаги, ткани. Наименьшее сопротивление сдвигу наблюдается при скольжении вдоль наиболее плотно заселенных атомами плоскостей.
Структурные дефекты кристаллов. Строение реальных кристаллов отличается от идеальных наличием дефектов, которые нарушают правильное расположение атомов в пространстве. Дефекты могут быть точечными (рис. 2.4), линейными (рис. 2.5), поверхностными (рис. 2.6) и объемными (рис. 2.7). Размеры точечных дефектов близки к размерам атомов.
Точечные дефекты образуются в процессе кристаллизации под воздействием тепловых, механических, электрических воздействий, а также при облучении нейтронами, электронами, рентгеновскими лучами. Особую роль в поведении твердых тел играют вакансии, которые, в первую очередь, образуются в результате теплового движения атомов. При комнатной температуре концентрация вакансий сравнительно невелика, но резко повышается при нагреве, особенно вблизи температуры плавления (С ~ 10-5 – 10-4). Точечные дефекты не закреплены в определенных объемах металла, они непрерывно перемещаются в кристаллической решетке в результате диффузии. Присутствие вакансий объясняет возможность диффузии - перемещения атомов на расстояния, превышающие средние межатомные расстояния для данного металла. Перемещение атомов осуществляется путем обмена местами с вакансиями.
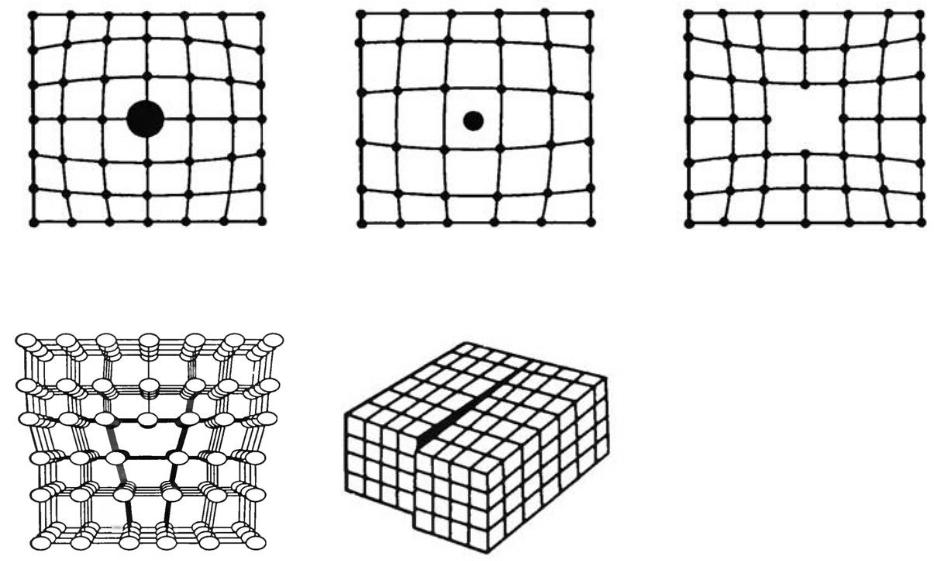
а |
б |
в |
Рис. 2.4. Точечные дефекты: а – примесь замещения, б - примесь внедрения, в – вакансия
(http://www.physbook.ru/images/3/35/Img_T-55-001.jpg)
Рис. 2.5. Линейные дефекты:
а – краевая дислокация
(http://www.physbook.ru/images/f/f 5/Img_T-55-002.jpg),
б – винтовая дислокация
(http://www.physbook.ru/images/a/ a7/Img_T-55-003.jpg)
а |
б |

Рис. 2.6. Поверхностные дефекты (границы кристаллитов) |
Рис. 2.7. Объемные дефекты (поры) |
|
(http://solidbase.karelia.ru/edu/X-ays/Элучебник/Структура/) |
||
|
Линейные дефекты представляют собой нарушения регулярности решетки вдоль линии. Поперечные размеры линейного дефекта не превышают одного или нескольких межатомных расстояний, а длина достигает размеров кристалла. Дислокации образуются при кристаллизации металлов, а также в ходе
пластической деформации и фазовых превращений. Плотность дислокаций ( ρ = ∑V l ) может достигать
большой величины. Для отожженных металлов плотность дислокаций составляет величину 106–103 см–2, после холодной деформации она увеличивается до 1011–1012 см–2. Наличие дислокаций в кристаллах приводит к тому, что их реальная прочность оказывается значительно ниже теоретически рассчитанной.
