
- •«Национальный исследовательский
- •1.1. Цели преподаваемой дисциплины
- •1.2. Задачи изложения и изучения дисциплины
- •2. Содержание теоретического раздела дисциплины
- •2.1. Введение. Основные понятия и законы химии
- •2.2. Строение вещества
- •2.2.1. Строение атомов
- •2.2.2. Периодическая система элементов и изменение свойств элементов
- •2.3.2. Химическая кинетика
- •3. Содержание практического раздела дисциплины
- •3.1. Тематика практических занятий
- •3.2. Перечень лабораторных работ
- •4. Элементы теории и вопросы для самопроверки по темам курса. Предисловие
- •1. Химические формулы. Валентность
- •2. Номенклатура
- •3. Классификация неорганических соединений
- •Гидроксиды
- •4. Структурные формулы
- •Тема 1. Атомно-молекулярное учение
- •1.2. Газовые законы
- •1.3. Определение молекулярных масс веществ
- •1.4. Эквивалент. Эквивалентные массы.
- •Тема 1. Атомно-молекулярное учение и стехиометрия
- •Тема 2. Строение атома
- •2.1. Корпускулярно-волновое описание движения электрона в атоме
- •2.2 Волновая теория строения атома.
- •2.3. Квантовые числа
- •2.5. Периодическая система и изменение свойств элементов
- •1) При заполнении уровня и подуровня устойчивость электронной конфигурации возрастает и
- •2) Особой устойчивостью обладают заполненные (s2, p6, d10, f14) и наполовину заполненные (p3, d5, f7) конфигурации.
- •Тема 2. Строение атома
- •Тема 3. Химическая связь
- •3.1. Метод валентных связей (вс)
- •Приведённым схемам вс соответствуют структурные формулы (сф) (рис. 3.3), на которых связывающие электронные пары изображают чёрточками (валентная черта), а несвязывающие электроны – точками.
- •3.2. Метод молекулярных орбиталей (мо)
- •3.3. Теории металлической связи
- •3.4. Межмолекулярные взаимодействия
- •3.5. Кристаллические решетки
- •Тема 3. Химическая связь
- •3.6. Комплексные соединения
- •3.6.1. Определения, составные части и классификация
- •3.6.2. Равновесие в растворах комплексных соединений
- •3.6.3. Изомерия комплексных соединений
- •3.6.4. Химическая связь в комплексных соединениях
- •Тема 4. Элементы термодинамики
- •4.1. Основные понятия и определения
- •4.2. Тепловые эффекты химических реакций
- •4.2.2. Термохимические расчеты.
- •4.3. Направление химических реакций
- •4.3.1. Энтропия
- •4.3.2 Энтальпийный и энтропийный факторы.
- •Тема 4. Химическая термодинамика
- •Тема 5. Химическое равновесие
- •5.1. Химическое равновесие
- •5.2. Константа равновесия
- •Например, для обратимой реакции
- •5.3. Свободная энергия и константа равновесия
- •5.4. Смещение химического равновесия. Принцип Ле Шателье
- •Напоминаем, что в выражение константы равновесия гетерогенной реакции входят только концентрации газообразных веществ, так как концентрации твердых веществ остаются, как правило, постоянными.
- •Тема 5. Химическое равновесие
- •Тема 6. Химическая кинетика
- •6.1. Основные понятия и представления
- •6.2. Зависимость скорости химической реакции
- •6.3. Зависимость скорости от температуры
- •6.4. Катализ
- •Тема 6. Химическая кинетика
- •Тема 7. Концентрация растворов
- •7.1. Способы выражения концентрации растворов
- •Тема 7. Концентрация растворов
- •Тема8. Растворы
- •8.1. Свойства разбавленных растворов неэлектролитов
- •8.2. Растворы электролитов
- •8.2.1. Диссоциация кислот, оснований и солей
- •8.2.2. Свойства разбавленных растворов электролитов
- •8.2.3. Ионные реакции
- •8.2.4. Электролитическая диссоциация воды.
- •8.2.5. Гидролиз солей
- •Тема 8. Свойства растворов
- •Реакции в растворах электролитов
- •Тема 9. Окислительно-восстановительные реакции
- •9.1. Уравнивание овр
- •9.2. Типы окислительно-восстановительных реакций
- •9.3. Эквиваленты окислителя и восстановителя
- •Тема 9. Окислительно-восстановительные реакции
- •Тема 10 .Электрохимические процессы
- •10.1. Химические источники электрической энергии
- •10.2. Электролиз
- •10.3. Количественные законы электролиза
- •2. При прохождении одного и того же количества электричества через раствор или расплав электролита массы (объемы) веществ, выделившихся на электродах, прямо пропорциональны их химическим эквивалентам.
- •10.4. Коррозия металлов
- •Тема 10. Электрохимические процессы
- •Контрольные задания
- •1. Закон эквивалентов. Газовые законы
- •2. Строение атома
- •Периодическое изменение свойств элементов
- •3. Химическая связь
- •4. Энергетика химических реакций
- •Свободная энергия, энтропия. Направление химических реакций
- •Химическое равновесие. Смещение химического равновесия
- •6. Химическая кинетика
- •7. Концентрация растворов
- •8. Свойства разбавленных растворов неэлектролитов
- •Обменные реакции в растворах электролитов
- •Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •10. Электрохимические процессы
- •Электролиз
- •Коррозия металлов
- •Комплексные соединения
- •Жесткость воды
- •Химия элементов
- •1. Цели и задачи учебной дисциплины. . . . . . . . . . . . . . . . . . . 3
- •Тема 2. Строение атома. . . . . . . . . . . . . . . . . . . . . . . . .. . . . . . . . . . . .37
- •Тема 3. Химическая связь. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
- •Тема 4. Элементы термодинамики . . . . . . . . . . . . . . . . . . . . . . .75
- •Тема 5. Химическое равновесие. . . . . . . . . . . . . . . . . . . .. . . . . . . 89
- •Тема 6. Химическая кинетика . . . . . . . . . . . . . . . . . . .. . . . . . . . . .97
- •Тема 7. Концентрация растворов . . . . . . . . . . . . . . . . . . . . . . .. . . 104
- •Тема8. Растворы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .108
- •Тема 9. Окислительно-восстановительные реакции. . . . .126
- •Тема 10. Электрохимические процессы. . . . . .. . . . . . . . . . . . . .132
Жесткость воды
Жесткость воды обусловлена наличием в ней ионов двухвалентных металлов (Ca2+, Mg2+, Fe2+). Различают временную и постоянную жесткость.
Временная (или карбонатная)жесткость обусловлена наличием бикарбонатов Ме(НСО3)2, которые разлагаются в процессе кипячения:
Ca(HCO3)2 = CaCО3 + CO2 + H2O
Fe(HCO3)2 = Fe(OH)2 + 2СO2 .
Твердый осадок покрывает поверхность водонагревательных систем, что снижает их нагревательную способность, эффективность теплопередачи.
Постоянная (или некарбонатная)жесткость обусловлена наличием растворимых хлоридов и сульфатов, которые при кипячении не разлагаются.
Сумма временной и постоянной жесткости дает общую жесткость:
Жобщ. = Жврем. + Жпост.
По ГОСТу жесткость воды оценивается в мг-экв/л (ммоль/л).
Одним из методов определения жесткости воды является титрование определенного объема воды раствором соляной кислоты известной концентрации. Применяются и весовые методы определения жесткости. Устранение жесткости сводится к удалению из воды ионов кальция и магния обычно путем перевода их в осадок в виде нерастворимых солей.
Пример 1. Вычислить временную жесткость, если в 2 л воды содержится 60,12 мг ионов Ca2+ и 28,37 мг ионов Mg2+.
Решение.Число ммоль эквивалентов Ca2+ вычисляем из соотношения:
1 ммоль Ca2+ – 20,04 мг Ca2+
Х
– 60,12 мг Ca2+,
![]() .
.
Число ммоль эквивалентов Mg2+определяем аналогично:
1 ммоль Mg – 12,15 мг Mg2+
Х
– 28,37 мг,
![]() .
.
Общее число ммоль эквивалентов ионов Ca2+ и Mg2+ составит в расчете на 1 л воды:
Ж = 3 + 2,5 = 5,5 ммоль/л.
Следовательно, согласно ГОСТу, вода умеренно жесткая.
Пример 2.Определить временную жесткость воды, если на титрование 100 мл образца воды, содержащей гидрокарбонат магния, израсходовано 8.10–3 л 0,1Н раствора соляной кислоты.
Решение.При титровании жесткой воды соляной кислотой происходит следующая реакция:
Mg(HCO3)2 + 2HCl = MgCl2 + 2CO2 + 2H2O.
В соответствии с законом эквивалентов количество эквивалентов всех участвующих в химической реакции веществ должно быть одинаковым:
Нр · Vр = Нк ·Vк,
где Нк и Нр – эквивалентные (нормальные) концентрации кислоты и раствора, Vк и Vр– объемы кислоты и раствора (л).
Откуда
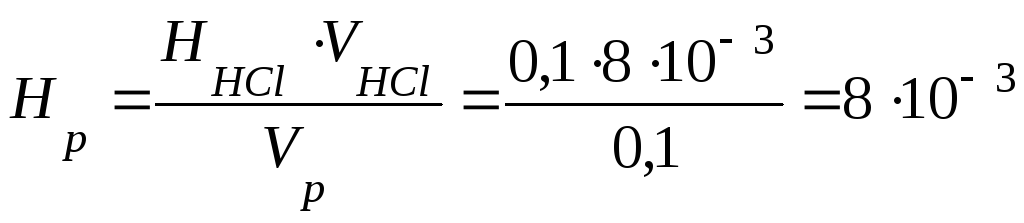 моль/л.
моль/л.
Так как жесткость измеряется в ммоль/л, то Ж = Нр ·1000 = 8·103 ·1000 = 8 ммоль/л, т.е. вода жесткая.
Пример 3.Вычислить постоянную жесткость воды, зная, что для удаления ионов кальция, содержащихся в 50 л этой воды, потребовалось прибавить к воде 10,8 г безводной буры.
Решение.При действии буры на воду, содержащую сернокислый кальций, ионы кальция переходят в осадок вследствие реакции:
CaSO4 + Na2B4O7 = CaB4O7 + Na2SO4.
Из уравнения реакции следует, что для осаждения ионов кальция в виде CaB4O7 на 1 эквивалент сернокислого кальция, т.е. на 1 г-экв ионов кальция надо взять 1 эквивалент буры или на 1 мг-экв ионов кальция 1 мг-экв буры. Молярная масса эквивалента буры 202.1/2 = 101 г, следовательно, 1 мг-экв ее равен 101 мг. На осаждение ионов кальция, содержащихся в 50 л воды, израсходовано 10,8 г или 10800 мг буры, что составляет:
![]() мг-экв.
мг-экв.
Поскольку, согласно закону эквивалентов, вещества взаимодействуют в эквивалентных соотношениях, столько же мг-экв ионов кальция будет содержаться в 50 л воды.
Отсюда
жесткость воды равняется
![]() ммоль-экв/л.
ммоль-экв/л.
Присутствие каких солей в природной воде обуславливает ее жесткость? Почему употребление жесткой воды при стирке белья вызывает большой расход мыла? Отразится ли на расходе мыла присутствие в воде хлористого кальция?
Почему жесткость, обусловленная присутствием в воде гидрокарбонатов кальция или магния, называется временной? Какие химические реакции будут происходить: а) при кипячении жесткой воды, содержащей Ca(HCO3)2; б) при добавлении к ней соды; в) при добавлении к ней едкого натра?
Какую массу Na2CO3надо прибавить к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 5 ммоль-экв?
Как временная, так и постоянная жесткость воды может быть устранена прибавлением к воде соды. Можно ли заменить соду: а) карбонатом калия; б) гидроксидом бария, который хорошо растворим в воде? Ответ подтвердите уравнениями реакций.
Вычислите карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащимся в 200 см3воды, требуется 15 см3раствора HCl с эквивалентной концентрацией, равной 0,08.
Чему равняется жесткость воды, если для устранения ее к 100 мл воды потребовалось прибавить 15,9 г соды?
Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 4 ммоль-экв. Какой объем 0,1н раствора HCl потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 см3этой воды?
Введением каких ионов в природную воду можно устранить: а) временную жесткость воды; б) постоянную ее жесткость?
В 1 м3воды содержится 140 г сульфата магния. Вычислите жесткость воды.
Сколько граммов гашеной извести надо прибавить к 1000 л воды, чтобы устранить ее временную жесткость, равную 2,86 ммоль-экв/л?
Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21,2 г карбоната натрия?
Вычислите временную жесткость воды, зная, что на реакцию с гидрокарбонатом, содержащимся в 100 мл этой воды, израсходовано 5 мл 0,1н раствора НСl.
Какие ионы надо удалить из природной воды, чтобы сделать ее мягкой? Введением каких ионов можно умягчить воду? Составьте уравнения реакций. Какую массу Ca(OH)2надо прибавить к 2,5л воды, чтобы устранить ее жесткость, равную 4,43 ммоль-экв?
Жесткость воды, содержащей только гидрокарбонат кальция, равна 1,78 ммоль-экв. Определите количество гидрокарбоната в литре этой воды.
Какую массу карбоната натрия надо прибавить к 0,1 м3воды, чтобы устранить жесткость, равную 4 ммоль-экв/л?
Какова временная жесткость воды, в литре которой содержится 0,146 г гидрокарбоната магния?
К 100 л жесткой воды прибавили 12,95 г гидроксида кальция. Насколько понизилась карбонатная жесткость?
Вычислите постоянную жесткость воды, зная, что для удаления ионов кальция, содержащихся в 50 л этой воды, потребовалось прибавить к воде 10,8 г безводной буры.
Чему равна карбонатная жесткость воды, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция?
Путем анализа было установлено, что в одном литре исследуемой воды содержится 42 мг ионов магния и 112 мг ионов кальция. Вычислите общую жесткость воды.
