
- •Лекция 1
- •Основные понятия и законы химии
- •Глава 1. Атомно-молекулярное учение и стехиометрия
- •1.1. Основные понятия и определения
- •1.2. Атомно-молекулярное учение
- •1.3. Стехиометрические законы
- •1.4. Относительные атомные и молекулярные массы
- •1.5. Моль и молярная масса
- •1.6. Газовые законы в химии
- •1.7. Эквиваленты и эквивалентные массы
- •1.8. Химические формулы.
- •1.9. Валентность
- •1.10. Структурные формулы
- •1.11. Уравнения химических реакций
- •1.12. Классификация химических реакций
1.10. Структурные формулы
В веществах атомы связаны друг с другом в определённой последовательности, а между парами атомов (между химическими связями) имеются определённые углы. Всё это необходимо для характеристики веществ, так как от этого зависят их физические и химические свойства. Сведения о геометрии связей в веществах частично (иногда полностью) отражаются в структурных формулах.
В структурных формулах связь между атомами изображается чертой. Например:
- химическая формула воды H2O, а структурная HOH,
- химическая формула пероксида натрия Na2O2, а структурная NaOO–Na,
- химическая формула азотистой кислоты HNO2, а структурная HONO.
При изображении структурных формул чёрточками обычно показывают стехиометрическую валентность элементов. Структурные формулы, построенные по стехиометрическим валентностям, иногда называются графическими. Такие структурные формулы несут информацию о составе и порядке расположения атомов, но не содержат правильных сведений о химических связях между атомами.
Например, химическая формула азотной кислоты HNO3, а структурная, построенная по стехиометрическим валентностям, изображается так:

 O
O

 HON
HON
O
Из этой формулы видно, что стехиометрическая валентность азота в азотной кислоте равна 5. и это правильно. Но, как показывают исследования, электронная валентность азота в азотной кислоте рана 4, так как между атомами азота и кислорода образуется не четыре, а три связи, причём, одна их них распределяется поровну между двумя атомами кислорода (такие связи называются делокализованными). Поэтому структурная формула азотной кислоты, отражающая электронную валентность элементов, такова:
Большинство оксидов, оснований и солей существуют в виде твердых соединений с ионными или частично ионными связями. Для таких соединений структурные формулы не соответствуют реальному строению веществ, а носят формальный, условный характер, показывая, как могли бы соединяться атомы, если бы вещество состояло из молекул, соответствующих формуле.
Истинную структурную формулу можно изобразить лишь на основании исследования реальной структуры вещества – экспериментально или теоретически. Эти вопросы рассматриваютя в данном пособии и в других учебных пособиях при изучениихимической связи.
При изображении структурных (графических) формул нужно выполнять следующие простые правила.
1. Число чёрточек, исходящих от каждого атома, равно его валентности.
2. В кислородсодержащих кислотах и солях со сложным кислородсодержащим катионом атомы водорода и металла соединяются с кислотообразующим элементом через атомы кислорода.
3. Атомы элементов, у которых стехиометрическая валентность в соединении совпадает с электронной валентностью, не соединяются между собой, т.е. не образуют гомоцепей.
Пример 19.Изобразить структурные формулыa) CrO3; б)Al2S3, в) K2SO4.
Решение.Определяем стехиометрические валентности атомов: V(K) = 1; V(S) = 6; V(O) = 2. Изображаем структурную формулу, пользуясь правилами 13:
При изображении структурных формул солей можно исходить из соответствующих формул кислот, заменяя в них атомы водорода на атомы металла с соблюдением правила валентности, т.е. один атом водорода заменяется одновалентным металлом, два двухвалентным, три трехвалентным и т.д. Например, карбонат кальция (CaCO3) – это средняя соль угольной кислоты H2CO3, поэтому структурную формулу этой соли можно представить так:
Н

 О
О
О
О


 С=О
Са С=О.
С=О
Са С=О.
НО О
Пример 20. Изобразите графические формулы кислой соли гидросульфата натрия и основной соли карбоната гидроксожелеза (III).
Решение. При составлении графических формул солей нужно отчетливо представлять себе графические формулы кислотных и основных остатков. Кислую соль (NaHSO4) можно представить как продукт замещения одного атома водорода в серной кислоте на атом натрия:

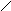



 HО
O HO
O
HО
O HO
O



 S
S
S
S

 HО
O NaO
O .
HО
O NaO
O .
Основную соль (FeOHCO3) можно представить как продукт частичного замещения гидроксогрупп в основанииFe(OH)3на кислотный остаток угольной кислоты:

 О
H HO
О
H HO
F e
O
H ; C = O ;
e
O
H ; C = O ;
 O
H
HO
O
H
HO

 О
О
H
 – O – Fe C = O ;
– O – Fe C = O ;
O
В приведенных примерах углы между связями взяты произвольно. Однако они также могут быть точно указаны и изображены.
Эти правила не распространяются на соединения, в которых электронная и стехиометрическая валентность какого-либо элемента различны, например в пероксо- и персульфо-соединениях:
K S K O
K2S2: K2O2:
K S K O
К такимже соединениям относятся и некоторые кислоты, в которых часть атомов водорода соединяется не с атомами кислорода, а с атомом кислотообразующего элемента непосредственно. Рассмотрим три кислоты., образуемые фофсфором: 1) форфорную, 1) фосфористую и 3) фосфорноватистую.
1. Химическая формула , структурная
2. Химическая формула , структурная
3. Химическая формула , структурная
