
Лекции по физике
.pdf
ре
Рис. 3.
181

Pe
r
P P
θ
P′
Рис. 4.
182
|
2 |
h |
2 |
h |
′ 2 |
h 2 |
|
|
||||||
(mυ ) |
|
= |
ν |
|
+ |
ν |
|
|
− 2 |
|
|
νν ′ cosθ |
, |
(6) |
|
c |
c |
|
|
||||||||||
|
|
|
|
|
|
|
c |
|
|
|
||||
где θ – угол рассеяния фотона.
• Решая совместно уравнения (1) и (6), получим:
|
|
|
λ = |
|
h |
(1− cosθ ) |
, |
(7) |
|||
|
|
|
|
|
|||||||
где |
|
|
|
|
|
m0c |
|
|
|
|
|
|
h |
= |
|
6,63×10 |
-34 |
= 2,43×10-12 ì |
|
||||
|
|
|
|
||||||||
|
|
|
|
, |
|||||||
|
m c |
|
|
|
|
|
|||||
|
9,1×10-31×3×10 |
|
|
|
|||||||
|
0 |
|
|
|
|
|
|
|
|
|
|
что совпадает с комптоновской длиной волны Λ.
Формула (7) – это формула Комптона. |
183 |
Конец лекции по данной теме
184
ФИЗИКА АТОМА
1.Опыт Резерфорда по рассеянию α-частиц. Ядерная модель атома
2.Закономерности в спектре атома водорода
3.Элементарная теория атома водорода (теория Н.Бора)
4.Опыты Франка и Герца.
5.Атом водорода с точки зрения квантовой механики
6.Пространственное квантование (магнитное квантовое число)
7.Опыт Штерна и Герлаха. Спин электрона
8.Принцип Паули. Электронные оболочки атомов
9.Заполнение электронных оболочек. Периодическая система элементов Д.И.Менделеева
185
1. Опыт Резерфорда по рассеянию α-частиц. Ядерная модель атома
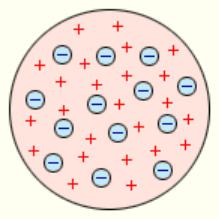
В 1903 году Дж. Дж. Томсон, предложил модель атома: сфера, равномерно заполненная положительным электричеством, внутри которой
находятся электроны (рис. 1). |
Суммарный |
заряд |
|||
|
такой сферы равен нулю. Атом в |
||||
|
целом нейтрален. Из теории такого |
||||
|
атома следовало, что спектр его |
||||
|
излучения |
должен |
быть |
||
Рис. 1 |
сплошным, |
но |
никак |
не ли- |
|
нейчатым, а |
это |
противоречило |
|||
|
|||||
экспериментальным наблюдениям186 .

Другая модель атома была предложена Резерфордом на основе изучения рассеяния α-частиц на чрезвычайно тонкой фольге из золота (рис. 2).
Рис. 2
Энергия α-частиц, излучаемых источником, ~ 5 МэВ.
187
Узкий пучок α-частиц испускался радиоактивным веществом и попадал на фольгу. При прохождении через фольгу α-частицы отклонялись на различные углы. Рассеянные частицы ударялись об экран, покрытый ZnS и вызываемые им вспышки света, сцинцилляции, наблюдались в микроскоп. Микроскоп и связанный с ним экран можно было вращать вокруг оси, проходящей через центр фольги, т.е. можно было всегда измерить угол отклонения α-частиц . Весь прибор помещался в откачиваемый объем, чтобы устранить рассеяние α-частиц за счет столкновений с молекулами воздуха. 188
Обнаружилось, что некоторые α-частицы отклонялись на большие углы, до 180º. Резерфорд понял, что такое отклонение возможно лишь при встрече с положительно заряженной частицей большей массы. А малая вероятность отклонения на большие углы указывала на то, что эта положительная частица имеет малые размеры (~10–15 м). Электроны, по мнению Резерфорда, движутся вокруг ядра.
Но такая модель была в явном противоречии с классической электродинамикой, т.к. электрон, двигаясь по окружности, т.е. с нормальным ускорением, должен был излучать энергию, следовательно, замедлять скорость и упасть на ядро. Таким образом, модель Резерфорда на могла
189
объяснить, почему атом устойчив.
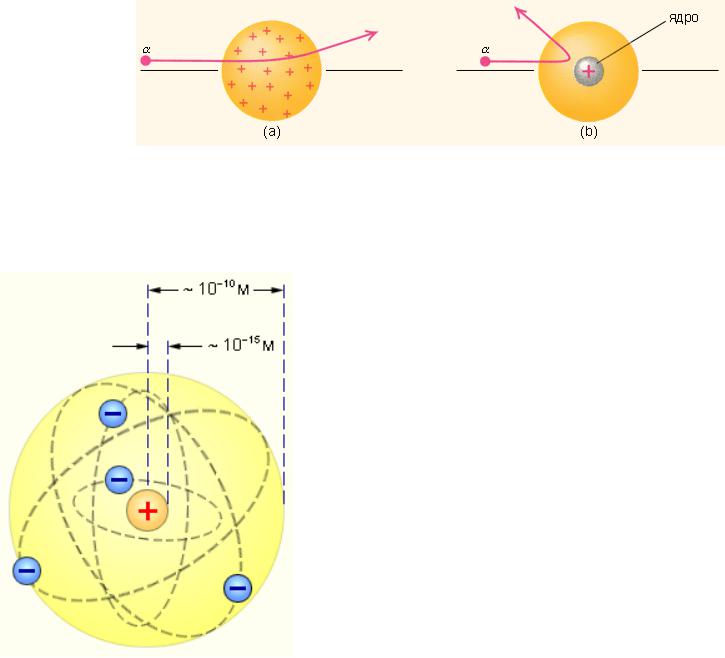
Рис. 3. Рассеяние α-частицы в атоме Томсона (а) и в атоме Резерфорда (b).
Ядерная модель атома Рис. 4 Резерфорда. Показаны круговые
орбиты четырех электронов.
190
