
лекции по нерганической химии
.pdfРОСТОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Шукаев И. Л.
ЛЕКЦИИ ПО ОБЩЕЙ ХИМИИ
Часть 1 ХИМИЧЕСКИЕ ПРОЦЕССЫ И СТРОЕНИЕ АТОМА
Методическое пособие для студентов 1 курса геологических специальностей
Ростов-на-Дону
2001
2
Шукаев И. Л.
ЛЕКЦИИ ПО ОБЩЕЙ ХИМИИ Часть 1
ХИМИЧЕСКИЕ ПРОЦЕССЫ И СТРОЕНИЕ АТОМА Методическое пособие
для студентов 1 курса геологических специальностей
Печатается по решению кафедры общей и неорганической химии Ростовского
государственного университета.
Протокол N 2 от 4 июня 2001 г.
Ответственный редактор − д.х.н., профессор Т. Г. Лупейко.
ВВЕДЕНИЕ………………………………………………………… 3
1. |
ПРЕДМЕТ И ЗАДАЧИ ХИМИИ |
3 |
2. |
ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ |
6 |
ХИМИЧЕСКИЕ ПРОЦЕССЫ …………………………………. 10
3. |
ОСНОВЫ ТЕРМОДИНАМИКИ |
10 |
4. |
ТЕРМОХИМИЯ |
12 |
5. |
ХИМИЧЕСКАЯ КИНЕТИКА |
16 |
6. |
ХИМИЧЕСКОЕ РАВНОВЕСИЕ |
21 |
СТРОЕНИЕ ВЕЩЕСТВА ………………………………………. 28
7. |
ОСНОВЫ КВАНТОВОЙ МЕХАНИКИ |
28 |
8. |
МНОГОЭЛЕКТРОННЫЕ АТОМЫ |
31 |
9. |
ПЕРИОДИЧЕСКИЙ ЗАКОН |
33 |
10. |
ХИМИЧЕСКАЯ СВЯЗЬ |
35 |
3
ВВЕДЕНИЕ
1. ПРЕДМЕТ И ЗАДАЧИ ХИМИИ
Наша первая задача − выяснить, какими вопросами занимается химия и зачем она нужна геологам.
Химия − это наука о веществах, их строении, свойствах и превращениях. Другими словами, химия изучает строение вещества на уровне атомов и свойства
вещества, вызванные взаимодействием атомов.
Химическое вещество имеет определённый качественный и количественный
состав, отражаемый его химической формулой. Примеры индивидуальных веществ: вода (H2O), железо (Fe), сера (S8), сахар (C12H22O11), кислород (O2).
Отличают: простые вещества − состоят из атомов только одного элемента
(графит, сера, ртуть, железо); сложные вещества − состоят из атомов двух и более элементов (вода, поваренная соль, сахар, этиловый спирт).
Очень распространены смеси веществ. Один пример: воздух (азот N2, кислород O2 и понемногу других газов). Другой пример: минеральная вода (вода H2O и растворённые в ней соли, обычно преобладают хлорид натрия NaCl и гидрокарбонат кальция Ca(HCO3)2).
Горные породы иногда состоят из одного вещества (минерала). Так, известняк состоит из карбоната кальция CaCO3 (кальцита). Но чаще в состав породы входят несколько минералов: к примеру, гранит состоит из кварца, слюды и полевого шпата.
По какому признаку в смеси веществ можно провести границу между ними?
Вхимии обычно считают, что внутри одного вещества атомы прочно связаны друг
сдругом (иначе говорят − сильно взаимодействуют), а взаимодействие между атомами разных веществ намного слабее.
Итак, веществами в химии называют большие коллективы сильно взаимодействующих атомов.
Химической реакцией называют превращение одних веществ в другие.
Другими словами, в ходе реакции происходит изменение состава веществ.
При этом некоторые связи между атомами разрываются, зато образуются новые
связи. Например, карбид кальция взаимодействует с водой, превращаясь в гашёную
известь и ацетилен:
4
CaC2 + 2H2O → Ca(OH) 2 + C2H2↑.
Разрываются связи кальций–углерод (Ca−C) и образуются связи Ca−O и C−H.
Вы знаете, что химические реакции обнаруживаются по внешним признакам. Это может быть выпадение или растворение осадка, изменение цвета, выделение или поглощение газа, выделение или поглощение тепла.
Типы химических реакций: |
|
|
1) |
соединение − два или более веществ соединяются в одно: |
|
|
2Al + 3I2 → 2AlI3; |
Fe + S → FeS; |
2) |
разложение − одно вещество распадается на два или более: |
|
|
(NH4)2Cr2O7 → Cr2O3 + 4H2O + N2; |
2Hg(SCN)2=2HgS+CS2+C3N4 |
3) |
замещение − в сложном веществе один фрагмент заменяется другим: |
|
|
CuSO4 + Fe → FeSO4 + Cu; (CH3COO)2Pb + Zn → (CH3COO)2Zn + Pb; |
|
4) |
обмен − два сложных вещества обмениваются фрагментами: |
|
2KI+Pb(NO3)2 → 2KNO3 + PbI2↓.
Химия относится к естественным наукам, потому что изучает явления и объекты природы.
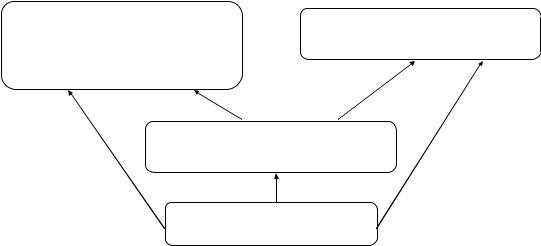
Как вы, вероятно, знаете, естественными науками являются также биология, геология, физика. Эти науки тесно переплетены и границы между ними отсутствуют. Наиболее общая из них − физика, она охватывает всю природу в разных масштабах времени и пространства.
ГЕОЛОГИЯ |
БИОЛОГИЯ |
|
строение Земли, |
||
живые организмы |
||
образование минералов и |
||
|
||
горных пород |
|
ХИМИЯ
атомы и связи между ними
ФИЗИКА
общие законы природы Как видно из схемы, химию больше всего интересует вещество на атомном
уровне: она изучает образование, разрыв и свойства химической связи между
атомами.
Химия имеет длительную историю, она развивалась вместе с другими областями творчества людей. Элементы химических знаний были, например, уже у древних египтян (4-5 тысяч лет назад).
5
Они умели выплавлять металлы, изготовлять керамические изделия и краски, сохранившиеся до нашего времени.
Современная химия как особая наука стала формироваться в 17 веке. В это
время она стала отделяться от физики и минералогии. Можно считать, что к 18 веку наука о рудах и минералах породила и химию, и геологию.
Почему химия важна для геолога?
-Во-первых, Земля на всех уровнях (от атмосферы до ядра) состоит из
химических веществ.
-Во-вторых, геологические процессы всегда либо сопровождаются
химическими (например, лава взаимодействует с горной породой), либо полностью или частично являются химическими (например, при выветривании горных пород одни вещества превращаются в другие).
-В-третьих, одной из задач геологии является поиск сырья для
промышленности. Что будет происходить с сырьём дальше? Химические
реакции. Геолог должен знать, как используются полезные ископаемые.
-В-четвёртых, каждый специалист должен заботиться о поддержании здорового состояния окружающей среды, да и о своём собственном здоровье тоже. Знание химии помогает установить источники опасности и нейтрализовать или избежать их.
Но, главное: химия − это интересная и увлекательная наука. Важнейшее место в химии занимает эксперимент, то есть химические реакции. У вас есть возможность научиться делать новые вещества своими руками.
Вот некоторые наиболее известные продукты химической промышленности:
-горючие вещества − бензин, керосин, дизельное топливо, мазут; это продукты переработки нефти, по химическому составу − углеводороды;
-моющие средства − мыла, шампуни, стиральные порошки; их получают из нефти, растительных и животных жиров с применением щелочей; по химическому составу это обычно натриевые или калиевые соли сложных органических кислот;
-лаки и краски; в них содержится органический растворитель, вещества, формирующие плёнку
икрасящий пигмент; часто это − оксиды металлов, например, в цинковых и титановых белилах.
Можно назвать ещё химические источники тока (аккумуляторы и батареи), средства защиты растений (ядохимикаты, удобрения), лекарства, взрывчатые вещества, строительные и конструкционные материалы и так далее. Зная химию, легче во всём этом разобраться.
6
2. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
Основной объект химии − атом. По современным взглядам, атом − сложная частица, имеющая диаметр несколько десятимиллиардных долей метра (короче:
порядка 10–10 м) и массу порядка 10–24−10–25 кг.
Атомы состоят из более мелких частиц (субатомных или элементарных):
протонов, нейтронов, электронов. Электромагнитное взаимодействие происходит благодаря фотонам. Бывают и другие элементарные частицы.
Атомы заполнены элементарными частицами неравномерно. В них есть
маленькое ядро (диаметром порядка 10–13 м), где сосредоточено более 99,9%
массы. Ядро состоит из протонов p+ и нейтронов n0, имеет положительный заряд, равный числу протонов.
Электроны e− имеют отрицательный заряд и расположены вокруг ядра. Они определяют размер атома и участвуют в образовании химических связей. В нейтральном атоме число электронов равно числу протонов.
Вид атомов с одинаковым числом протонов в ядре называют химическим элементом.
Известно более 100 химических элементов. Они имеют названия и с 19 века обозначаются символами. Иногда слева от символа пишут 2 индекса: вверху −
массовое число (A= число протонов + число нейтронов = Z+N), внизу − заряд ядра, он же порядковый номер элемента (Z= числу протонов). Например, 168S.
Изотопами называются атомы с одинаковым зарядом ядра и разным числом нейтронов (и поэтому − разной массой).
Обычно в природе химические элементы представлены в виде смеси изотопов,
поэтому в Периодической системе некоторые атомные массы сильно отличаются от целых чисел.
Поскольку атомы очень маленькие, их чаще всего рассматривают большими наборами. Обычно количество вещества измеряют в молях.
Моль − это 6,022•10+23 объектов. Данное число называют ещё числом Авогадро
NA. Число молей n называют количеством вещества, n = N/NA , где N − число объктов.
1 моль атомов водорода имеет массу примерно 1 грамм. Удобно то, что масса
моля атомов в граммах почти точно равна массовому числу.

7
Может быть, вы помните из курса физики другое определение моля: моль − это количество структурных единиц, равное числу атомов в 12 граммах изотопа углерода-12. Это количество, конечно же − число Авогадро.
Соотношение изотопов углерода-12 и углерода-14 используется для установления возраста ископаемых остатков в биологии и археологии. Это называется радиоуглеродным методом.
Подобные методы применяют и для выяснения возраста горных пород. Так, собственно, и установлены возраст Земли и её геологическая история.
Химические элементы распространены неодинаково. Во Вселенной в целом преобладают водород H и гелий He, они сосредоточены в звёздах. В земной коре преобладают кислород O и кремний Si.
Напомню важный для химии закон Авогадро: при одинаковых условиях одинаковые количества разных газов занимают одинаковые объёмы. Следствие:
один моль любого газа занимает при так называемых нормальных условиях (0оС и 1 атм) объём 22,4 л (иначе говоря, молярный объём Vm=22,4 л/моль).
Закон Авогадро является следствием уравнения Менделеева-Клапейрона − p V = n R T
(n − число молей, n = m/M, m − масса, M − масса 1 моля вещества; R − газовая постоянная, R = 8,3144 Дж/(моль К); T − абсолютная температура).
Теперь мы имеем 3 выражения для количества вещества: n = N/NA = m/M = V/Vm, последнее особенно удобно для газов.
Для реальных газов уравнение Менделеева-Клапейрона хорошо работает при низких давлениях. Атмосферное давление можно ещё считать низким, а в недрах
Земли газы сжимаются до десятков и сотен тысяч атмосфер и перестают
подчиняться этому уравнению.
Закон Авогадро позволяет по плотности газа ρ оценить его молярную массу M:
ρ= m/V = pR MT ; ρ1/ρ2 = M1/M2 = D.
Величину D называют относительной плотностью газа. Обычно в качестве
газа сравнения используют водород с М= 2 г/моль или воздух с М= 29 г/моль.
8
ПРИМЕР. Плотность газа по воздуху равна 2. Найдём его молярную массу: Mгаза =
D Mвоздуха = 2 29 г/моль = 58 г/моль.
Может получиться так, что в веществе атомы соединяются прочными связями в
группы, а между этими группами связь полностью или почти отсутствует.
Тогда говорят, что вещество имеет молекулярное строение.
Молекулой называют группу прочно связанных атомов, способную двигаться
как единое целое. Например, участвовать в тепловом движении. Молекулы бывают одноатомные (например, у аргона Ar), двухатомные (у кислорода O2, водорода H2,
азота N2, хлора Cl2), трёхатомные (у воды H2O, углекислого газа CO2) и так далее. Молекула сахара C12H22O11 содержит 45 атомов, а белки, например, гемоглобин,
который переносит кислород в крови − десятки тысяч. Обычно молекулами считают
только нейтральные частицы.
Если в частице вещества атомного или молекулярного размера число
протонов отличается от числа электронов, то такая частица имеет электрический заряд и называется ионом. При растворении поваренной соли в
воде, например, получаются положительно заряженные ионы (катионы) натрия и отрицательно заряженные ионы (анионы) хлора: Na+ и Cl−.
Очень многие вещества не состоят из молекул. Так, структура графита содержит бесконечные плоские сетки из атомов углерода. Из отдельных ионов состоят все соли.
Немолекулярны почти все вещества, слагающие земную кору: кварц, слюды,
шпаты, оливин и другие минералы. По сути дела, из молекул состоят только вода и вещества нефти.
Одинаковые по виду формулы веществ совсем не означают одинакового устройства. Углекислый газ CO2 − молекулярное вещество, а кварц SiO2 −
немолекулярное.
Условно строение этих веществ в твёрдом состоянии показано на схеме. В кварце на самом деле сетка связей распространяется бесконечно в трёх пространственных измерениях.
|
9 |
|
|
|
O=C=O O=C=O |
| |
| |
| |
|
− O − Si − O − Si − O − Si − O − |
||||
O=C=O O=C=O O=C=O |
| |
| |
| |
|
− O − Si − O − Si − O − Si − O − |
||||
O=C=O O=C=O |
||||
| |
| |
| |
||
O=C=O O=C=O O=C=O |
− O − Si − O − Si − O − Si − O − |
|||
|
| |
| |
| |
|
Как видно, формулы отражают состав, а не строение веществ. Группа SiO2 называется не молекулой, а формульной единицей. Молярной массой для немолекулярных веществ фактически называют массу числа Авогадро формульных единиц, поэтому правильнее было бы называть её формульной массой.
Для молекулярных веществ и некоторых немолекулярных выполняется закон постоянства состава: соотношения между массами элементов, входящих в состав соединения не зависят от способа получения этого соединения. Вещества постоянного состава называют дальтонидами.
Так, воду можно получить:
-взрывом смеси водорода и кислорода: 2H2+O2 → 2H2O;
-реакцией нейтрализации: NaOH+HCl → H2O+NaCl;
-термическим разложением гидроксидов: Cu(OH)2 → H2O+CuO;
-обугливанием сахара: C12H22O11 → 11H2O+12C
имногими другими способами.
Большинство немолекулярных веществ, в том числе, почти все минералы, имеет переменный состав, зависящий от способа получения. Вещества переменного
состава называют бертоллидами.
Так, в оливине (Mg,Fe)2SiO4 переменным является соотношение между магнием и
железом(+2). В частности, возможны чисто железистый фаялит Fe2SiO4 и чисто магниевый форстерит Mg2SiO4.
Таким образом, сейчас закон постоянства состава имеет только историческое значение − он способствовал формированию современных понятий "атом", "молекула", "уравнение реакции".
10
ХИМИЧЕСКИЕ ПРОЦЕССЫ
3. ОСНОВЫ ТЕРМОДИНАМИКИ
Термодинамика изучает передачу тепла от одних макроскопических объектов к другим. “Макроскопические объекты” − означает большие в сравнении с размером атомов и молекул.
Представьте, что мы рассматриваем какой-нибудь большой коллектив животных, например, стаю воробьёв. При этом нельзя уследить за каждым отдельным животным, но можно говорить о стае в целом. Например − стая снялась и улетела. Даже если при этом один воробей заснул и остался. Термодинамика рассматривает вещество примерно в таком же стиле.
Термодинамика анализирует поведение больших коллективов атомов и
молекул, в которых действуют статистические закономерности. Типичное число частиц в коллективе − порядка числа Авогадро (6,02 10+23). Движение и энергетическое состояние каждой отдельной частицы не рассматривается. Минимальный размер коллектива − около 10−8−10−7 м по диаметру и 10+5−10+8 по числу частиц.
Примеры процессов, которые анализируются термодинамикой: кипение воды, работа двигателя внутреннего сгорания, работа холодильника, тепловые эффекты химических реакций.
Введём некоторые важные понятия, широко применяемые в термодинамике.
Системой называют набор объектов, мысленно или реально отделённых от
остального мира. То, что вне системы, называется внешней средой. Между системой и внешней средой может происходить обмен веществом и энергией. Если такого обмена нет, систему называют изолированной.
По внутреннему строению системы могут быть однородными (гомогенными) и неоднородными. В однородных системах любые части диаметром порядка 10−8−10−7 м и более имеют одинаковый состав и строение. Часто неоднородность так велика, что можно провести чёткую границу: поверхность раздела. Представьте, например,
плавающую льдину. Систему, в которой есть поверхности раздела, называют
гетерогенной.
Внимание, теперь сложное определение: фазой называют совокупность
однородных частей системы, отделённых от других её частей поверхностью
