
- •«Национальный исследовательский
- •1.1. Цели преподаваемой дисциплины
- •1.2. Задачи изложения и изучения дисциплины
- •2. Содержание теоретического раздела дисциплины
- •2.1. Введение. Основные понятия и законы химии
- •2.2. Строение вещества
- •2.2.1. Строение атомов
- •2.2.2. Периодическая система элементов и изменение свойств элементов
- •2.3.2. Химическая кинетика
- •3. Содержание практического раздела дисциплины
- •3.1. Тематика практических занятий
- •3.2. Перечень лабораторных работ
- •4. Элементы теории и вопросы для самопроверки по темам курса. Предисловие
- •1. Химические формулы. Валентность
- •2. Номенклатура
- •3. Классификация неорганических соединений
- •Гидроксиды
- •4. Структурные формулы
- •Тема 1. Атомно-молекулярное учение
- •1.2. Газовые законы
- •1.3. Определение молекулярных масс веществ
- •1.4. Эквивалент. Эквивалентные массы.
- •Тема 1. Атомно-молекулярное учение и стехиометрия
- •Тема 2. Строение атома
- •2.1. Корпускулярно-волновое описание движения электрона в атоме
- •2.2 Волновая теория строения атома.
- •2.3. Квантовые числа
- •2.5. Периодическая система и изменение свойств элементов
- •1) При заполнении уровня и подуровня устойчивость электронной конфигурации возрастает и
- •2) Особой устойчивостью обладают заполненные (s2, p6, d10, f14) и наполовину заполненные (p3, d5, f7) конфигурации.
- •Тема 2. Строение атома
- •Тема 3. Химическая связь
- •3.1. Метод валентных связей (вс)
- •Приведённым схемам вс соответствуют структурные формулы (сф) (рис. 3.3), на которых связывающие электронные пары изображают чёрточками (валентная черта), а несвязывающие электроны – точками.
- •3.2. Метод молекулярных орбиталей (мо)
- •3.3. Теории металлической связи
- •3.4. Межмолекулярные взаимодействия
- •3.5. Кристаллические решетки
- •Тема 3. Химическая связь
- •3.6. Комплексные соединения
- •3.6.1. Определения, составные части и классификация
- •3.6.2. Равновесие в растворах комплексных соединений
- •3.6.3. Изомерия комплексных соединений
- •3.6.4. Химическая связь в комплексных соединениях
- •Тема 4. Элементы термодинамики
- •4.1. Основные понятия и определения
- •4.2. Тепловые эффекты химических реакций
- •4.2.2. Термохимические расчеты.
- •4.3. Направление химических реакций
- •4.3.1. Энтропия
- •4.3.2 Энтальпийный и энтропийный факторы.
- •Тема 4. Химическая термодинамика
- •Тема 5. Химическое равновесие
- •5.1. Химическое равновесие
- •5.2. Константа равновесия
- •Например, для обратимой реакции
- •5.3. Свободная энергия и константа равновесия
- •5.4. Смещение химического равновесия. Принцип Ле Шателье
- •Напоминаем, что в выражение константы равновесия гетерогенной реакции входят только концентрации газообразных веществ, так как концентрации твердых веществ остаются, как правило, постоянными.
- •Тема 5. Химическое равновесие
- •Тема 6. Химическая кинетика
- •6.1. Основные понятия и представления
- •6.2. Зависимость скорости химической реакции
- •6.3. Зависимость скорости от температуры
- •6.4. Катализ
- •Тема 6. Химическая кинетика
- •Тема 7. Концентрация растворов
- •7.1. Способы выражения концентрации растворов
- •Тема 7. Концентрация растворов
- •Тема8. Растворы
- •8.1. Свойства разбавленных растворов неэлектролитов
- •8.2. Растворы электролитов
- •8.2.1. Диссоциация кислот, оснований и солей
- •8.2.2. Свойства разбавленных растворов электролитов
- •8.2.3. Ионные реакции
- •8.2.4. Электролитическая диссоциация воды.
- •8.2.5. Гидролиз солей
- •Тема 8. Свойства растворов
- •Реакции в растворах электролитов
- •Тема 9. Окислительно-восстановительные реакции
- •9.1. Уравнивание овр
- •9.2. Типы окислительно-восстановительных реакций
- •9.3. Эквиваленты окислителя и восстановителя
- •Тема 9. Окислительно-восстановительные реакции
- •Тема 10 .Электрохимические процессы
- •10.1. Химические источники электрической энергии
- •10.2. Электролиз
- •10.3. Количественные законы электролиза
- •2. При прохождении одного и того же количества электричества через раствор или расплав электролита массы (объемы) веществ, выделившихся на электродах, прямо пропорциональны их химическим эквивалентам.
- •10.4. Коррозия металлов
- •Тема 10. Электрохимические процессы
- •Контрольные задания
- •1. Закон эквивалентов. Газовые законы
- •2. Строение атома
- •Периодическое изменение свойств элементов
- •3. Химическая связь
- •4. Энергетика химических реакций
- •Свободная энергия, энтропия. Направление химических реакций
- •Химическое равновесие. Смещение химического равновесия
- •6. Химическая кинетика
- •7. Концентрация растворов
- •8. Свойства разбавленных растворов неэлектролитов
- •Обменные реакции в растворах электролитов
- •Гидролиз солей
- •9. Окислительно-восстановительные реакции
- •10. Электрохимические процессы
- •Электролиз
- •Коррозия металлов
- •Комплексные соединения
- •Жесткость воды
- •Химия элементов
- •1. Цели и задачи учебной дисциплины. . . . . . . . . . . . . . . . . . . 3
- •Тема 2. Строение атома. . . . . . . . . . . . . . . . . . . . . . . . .. . . . . . . . . . . .37
- •Тема 3. Химическая связь. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
- •Тема 4. Элементы термодинамики . . . . . . . . . . . . . . . . . . . . . . .75
- •Тема 5. Химическое равновесие. . . . . . . . . . . . . . . . . . . .. . . . . . . 89
- •Тема 6. Химическая кинетика . . . . . . . . . . . . . . . . . . .. . . . . . . . . .97
- •Тема 7. Концентрация растворов . . . . . . . . . . . . . . . . . . . . . . .. . . 104
- •Тема8. Растворы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .108
- •Тема 9. Окислительно-восстановительные реакции. . . . .126
- •Тема 10. Электрохимические процессы. . . . . .. . . . . . . . . . . . . .132
4. Структурные формулы
В веществах (молекулярных, ионных, ковалентных, металлических) атомы связаны друг с другом в определённой последовательности, а между парами атомов (между химическими связями) имеются определённые углы. Всё это необходимо для характеристики веществ, так как от этого зависят их физические и химические свойства. Сведения о геометрии связей в веществах частично или полностью отражаются в структурных формулах. В этих формулах связь между атомами изображают чертой. Например,
H2O изображают так: H-O-H; Hg2Cl2: Cl-Hg-Hg-Cl;
HNO2: H-O-N=O.
При изображении структурных формул часто принимают, что электронная валентность совпадает со стехиометрической. Такие структурные формулы несут информацию о составе и порядке расположения атомов, но не содержат правильных сведений о связях.
Например, КNO3:



 O
O
O
O


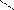 К-O-N
К+[O-N
]-
К-O-N
К+[O-N
]-
 O
O
O
O
(неправильно) (правильно)
здесьV стх(N) = 5, однако Vē (N) = 4.
Структурные формулы, построенные по стехиометрическим валентностям (Vстх), иногда называются графическими.
Соединения,
в которых у всех элементов Vстх
действительно
совпадает с электронной валентностью
(V![]() )
называют простыми соединениями; к
ним относятся только некоторые
молекулярные соединения (например, CO2,
SO2,
SO3,
CH4,
ClF3
и др.). Соединения, в которых это условие
не выполняется, называются сложными.
К ним относятся, например, все комплексные
соединения, CO,
H2O2,
HNO3
и др.
)
называют простыми соединениями; к
ним относятся только некоторые
молекулярные соединения (например, CO2,
SO2,
SO3,
CH4,
ClF3
и др.). Соединения, в которых это условие
не выполняется, называются сложными.
К ним относятся, например, все комплексные
соединения, CO,
H2O2,
HNO3
и др.
Большинство
оксидов, кислот, оснований и солей
существуют в виде твердых или жидких
соединений с частично ионными связями
или в виде растворов, в которых соединения
диссоциированы на ионы, и которые, в
свою очередь, гидратированы. Поэтому
даже при совпадении Vстх
и V![]() графические
формулы не соответствуют структуре, а
носят формальный, условный характер,
показывая как могли бы соединяться
атомы, если бы вещество состояло из
молекул, соответствующих формуле.
Истинную
структурную формулу можно изобразить
лишь на основании исследования реальной
структуры вещества – экспериментально
или теоретически (см. раздел учебников
химии “Химическая
связь”).
графические
формулы не соответствуют структуре, а
носят формальный, условный характер,
показывая как могли бы соединяться
атомы, если бы вещество состояло из
молекул, соответствующих формуле.
Истинную
структурную формулу можно изобразить
лишь на основании исследования реальной
структуры вещества – экспериментально
или теоретически (см. раздел учебников
химии “Химическая
связь”).
При изображении структурных (графических) формул нужно выполнять следующие простые правила:
1.
Число чёрточек, исходящих от каждого
атома, равно его валентности (Vстх
= V![]() ).
).
2. В обычных кислотах и солях со сложным кислородсодержащим катионом атомы H и Me соединяются с кислотообразующим элементом через кислород


 H-O-Э
, Мe-О-Э
.
H-O-Э
, Мe-О-Э
.

3. Одинаковые атомы не соединяются между собой, не образуют гомоцепей, они соединяются через атомы неметалла: a) CrO3; б) K2O; в) Al2S3.


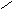

 O
K
S
O
K
S


 а)
Cr
; б) О , в) Al
¾
S
¾
Al
или
а)
Cr
; б) О , в) Al
¾
S
¾
Al
или



 O
O K
S
O
O K
S

 S
S

 Al-S-Al
Al-S-Al
S .
Правила нарушаются в "сложных" соединениях; например, пероксо- и персульфо- соединениях:
K ¾ S K ¾ O
K2S2 : ½ : K2O2 : ½ .
K ¾ S K ¾ O
Некоторые кислоты и соли фосфора также являются сложными соединениями:
H O
| çç
Кислоты: H3PO2 : H-O-P = O , H3PO3 : H-O-P - O -H.
| ç
H H
Из структурной формулы Н3РО2видно, что только один атом водорода соединен через кислород с фосфором, поэтому основность этой кислоты равна 1, а основность Н3РО3-2.
Пример 14.Изобразить структурную формулу K2SO4.
Решение.Определяем стехиометрические валентности атомов: V(K) = 1; V(S) = 6;
V(O) = 2. Изображаем структурную формулу, пользуясь правилами 1÷3:


 K-OOЭта
формула - графическая. На самом деле
таких
K-OOЭта
формула - графическая. На самом деле
таких
 Sмолекул не существует (К2SО4
– формульная единица с
Sмолекул не существует (К2SО4
– формульная единица с

 K-OOионной
кристаллической решеткой твердого
вещества).
K-OOионной
кристаллической решеткой твердого
вещества).
В приведенных примерах углы между связями взяты произвольно. Однако они также могут быть точно указаны и изображены.
Для графического изображения формул солей можно исходить из соответствующих формул кислот, заменяя в них атомы водорода на атомы металла с соблюдением правила валентности, т.е. один атом водорода заменяется одновалентным металлом, два - двухвалентным, три - трехвалентным и т.д. Например, графическое изображение формулы карбоната кальция (CaCO3) можно представить так:
карбонат кальция - это средняя соль угольной кислоты H2CO3:


 Н-О
О
Н-О
О


 С=О
Са С=О.
С=О
Са С=О.
Н -О О
Пример 15. Изобразите графические формулы кислой соли гидросульфата натрия и основной соли карбоната гидроксожелеза (III).
Решение. При составлении графических формул солей нужно отчетливо представлять себе графические формулы кислотных и основных остатков. Кислую соль (NaHSO4) можно представить как продукт замещения одного атома водорода в серной кислоте на атом натрия:
H



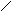
 -О
O H-O
O
-О
O H-O
O




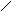 S
S
S
S
H -О
O Na-O
O .
-О
O Na-O
O .
Основную соль (FeOHCO3) можно представить как продукт частичного замещения гидроксогрупп в основании Fe(OH)3 на кислотный остаток угольной кислоты:


 О
¾
H H-O
O-H
О
¾
H H-O
O-H
F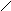
 e¾
O ¾
H ; C = O ; Fe ¾
O
e¾
O ¾
H ; C = O ; Fe ¾
O

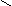
 O
¾
H H-O
C = O.
O
¾
H H-O
C = O.
O
Классификация неорганических соединений
Вопросы для самоконтроля
1. Укажите группу солей:
1) Mn(OH)2 2) CuOHNO3 3) P2O3 4) H2SO3
Fe(OH)3 K2HPO4 Bi2O3 HBrO3
NaOHFeSO4CaOHI
2. Какие кислоты соответствуют кислотным оксидам: Mn2O7,SO2:
1) H2MnO4 2) HMnO4 3) H2MnO3
H2SO4 H2SO3 H2S
3. Какие гидроксиды являются амфотерными:
1) Zn(OH)22)Ba(OH)2 3)Bi(OH)3
Sn(OH)2 Na(OH) Sr(OH)2
4. Ангидридом серной кислоты является:
1) SO2 2)SO3 3)H2S4)FeS2
5. Укажите правильное название соединения (CuOH)3PO4:
1) ортофосфат 2) гидроортофосфат 3) ортофосфат 4) ортофосфат
меди (II) меди (II) гидроксомеди (II) тригидроксомеди (II)
6. Какая соль образуется при взаимодействии 1 моль гидроксида кальция и 2 моль серной кислоты? Изобразить структурную формулу данной соли.
1) сульфат кальция 2) гидросульфат 3) сульфат гидроксокальция
7. Укажите кислую соль:
1) (CuOH)2CO3 2) CaHPO4
3) CuSO4·5H2O 4) NH4NO3
8. Определите реакцию среды после сливания растворов, содержащих 56 г гидроксида калия и 98 г серной кислоты.
1) нейтральная 2) кислая 3) щелочная
