
Взвешивание
Принцип устройства технохимических весов
Технохимические весы (рис. 2) – равноплечные весы, предназначенные для точного взвешивания (точность до 0,01 г). На металлическом коромысле (равноплечный рычаг) имеются три призмы: две на концах и одна посередине его. Средняя призма покоится на пластине, находящейся на центральной колонке весов и являющейся опорной. На боковых призмах лежат пластинки, к которым подвешиваются чашечки весов. Коромысло снабжено длинной стрелкой, которая показывает на шкале величину отклонения коромысла от горизонтального положения. При горизонтальном положении коромысла стрелка находится на нулевой отметке шкалы.
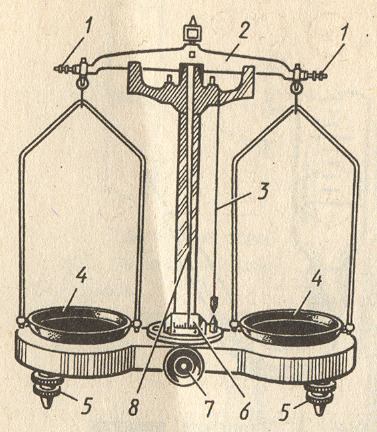
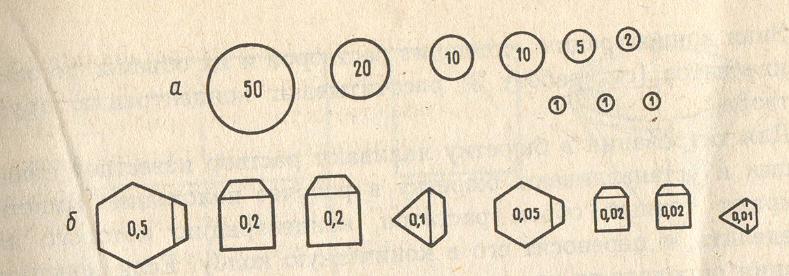
Рис.2. Технохимические весы Рис. 3. Разновес: а – гнезда для
1-балансировочные гайки, 2–коромысла, граммовых гирь, б-форма
3-отвес, 4-чашки, 5-установочные винты, миллиграммовых разновесок
6-шкала, 7-ручка арретира, 8-стрелка
Когда на весах не работают, все движущиеся части их приподняты и ребра призм отделены от пластинок при помощи особого приспособления, называемого арретиром. При таком положении весов коромысло не может колебаться – это предохраняет призмы от излишнего истирания. Для взвешивания на технохимических весах применяются разновесы (рис. 3). Они лежат в ящике в определенном порядке, который необходимо строго поддерживать. «Ушки» миллиграммовых разновесок должны быть повернуты вправо.
Правила взвешивания
Перед взвешиванием необходимо убедиться, что весы исправны. Для этого нужно повернуть ручку арретира по часовой стрелке и наблюдать за качанием стрелки. Если стрелка при качании вправо и влево отклоняется на одинаковое количество делений или качания в обе стороны разнятся не более чем на 1-1,5 делений, можно считать, что весы в порядке. После проверки нулевой точки арретир закрывают. Если при качании весов стрелка отклоняется от нуля не так, как указано, то взвешивание следует прекратить и заявить о неисправности весов преподавателю или лаборанту.
Взвешиваемое вещество нельзя насыпать прямо на чашку весов. Необходимо помещать его на сухое стекло, в бюкс или стаканчик. Масса последних должна быть предварительна отделена. При взвешивании жидкости надо следить, чтобы капли ее не попадали на чашку весов. Взвешиваемое тело должно иметь температуру, одинаковую с температурой весов. На левую чашку весов помещается взвешиваемый предмет, на правую - разновесы. Ящик с разновесами ставится на столик с правой стороны. Разновесы берут только пинцетом и в определенном порядке: начинают с соответствующим большим и затем ставят следующий меньшего значения.
Необходимо помнить, что груз кладут на чашки весов и снимают с них только при арретированных весах.
Взвешивание на технохимических весах можно считать законченным, когда разновеска в 0,01 г оказывается недостаточной, а в 0,02 г - избыточной. По окончании взвешивания массу записывают в журнал и разновесы в определенном порядке кладут в гнездо ящика.
Определение плотности раствора
Плотность раствора - это отношение его массы к объему. Единицей плотности в системе СИ является килограмм на кубический метр. На практике используется единица - грамм на кубический сантиметр или грамм на литр.
Для определения плотности растворов пользуются прибором - ареометром. Он представляет собой стеклянную трубку, расширенную внизу и заполненную на конце дробью, специальной массой или ртутью. Верхняя часть его - узкая трубка, в которой находится шкала с делениями. Каждому делению соответствует определенная плотность. Ареометры обычно находятся в комплекте, позволявшем измерять плотность растворов в широком интервале. Одни ареометры предназначены для жидкостей с плотностью выше единицы, другие только для имеющих плотность ниже единицы, имеются ареометры, пригодные для измерения плотности раствора в довольно ограниченных интервалах (от I до 1,06 и от 1,06 до 1,12 и т.д.). Существуют и специально градуированные ареометры для измерения плотности серной кислоты, спирта и т.д. Действие ареометра основано на законе Архимеда. Если ареометр предназначен для измерения плотностей больших, чем измеряемая, то он тонет в растворе, если наоборот, то жидкость выталкивает его. Поэтому при измерении плотности жидкости нужно хотя бы ориентировочно знать плотность исследуемого раствора.
Так как между плотностью раствора и его концентрацией существует определенная взаимосвязь, то измерив ареометром плотность, можно по таблицам найти концентрацию раствора. Для целого ряда кислот, щелочей, солей имеются таблицы, в которые сведена плотность растворов в зависимости от концентрации.
Для измерения плотности раствора жидкость наливают в цилиндр и осторожно опускают в нее ареометр так, чтобы он не касался дна и стенок цилиндра, свободно плавал в растворе. Деление шкалы ареометра, до которого он погрузился в раствор, покажет плотность раствора. После определения плотности жидкости ареометр промывают водой и убирают в коробку с набором ареометров.
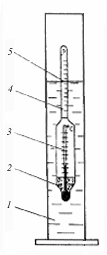
Рис.4. Определение плотности жидкости ареометром
(денсиметром): 1 — цилиндр с изучаемой жидкостью; 2 — балласт; 3 — шкала встроенного термометра (часто ареометры бывают без термометра); 4 — шкала плотности (или концентрации); 5 — уровень жидкости и деление шкалы, соответствующее ее плотности
Лабораторная работа 2
Скорость химических реакций
Опыт 1. Влияние степени измельчения на скорость реакции. Вытеснение меди железом из раствора соли.
В две пробирки налейте по 1 мл раствора сульфата меди (II). В первую пробирку прибавьте немного железных опилок, во вторую – кнопку. Сравните время изменения окраски раствора в каждом случае.
Составьте уравнение реакции между железом и сульфатом меди (II). Сделайте вывод о влиянии степени измельчения твердых веществ на скорость реакции.
Опыт 2. Зависимость скорости реакции от концентрации реагирующих веществ. Взаимодействие цинка с хлороводородной кислотой.
В две пробирки поместите по одной грануле цинка. В первую пробирку налейте 1 мл 10% раствора хлороводородной кислоты, во вторую – 1 мл. 30 % раствора хлороводородной кислоты. Сравните интенсивность образования пузырьков газа в каждом случае.
Составьте уравнение реакции между цинком и хлороводородной кислотой. Сделайте вывод о зависимости скорости реакции от концентрации реагирующих веществ.
Опыт 3. Зависимость скорости химической реакции от температуры. Взаимодействие оксида меди (II) с серной кислотой при различных температурах.
В две пробирки поместите немного порошка оксида меди (II) и по 1 мл раствора серной кислоты. Первую пробирку нагрейте. Сравните время растворения оксида меди (II) при комнатной температуре и при нагревании.
Составьте уравнение реакции между оксидом меди (II) и серной кислотой.
Опыт 4. Зависимость скорости химической реакции от природы реагирующих веществ. Взаимодействие цинка с различными кислотами.
В две пробирки поместите по одной грануле цинка. В первую добавьте 10 % раствор хлороводородной кислоты, во вторую – 1 мл 10 % раствора уксусной кислоты. Сравните интенсивность образования пузырьков газа в каждом случае.
Составьте уравнение реакции взаимодействия цинка с хлороводородной и уксусной кислотами.
Опыт 5. Зависимость скорости химической реакции от катализатора. Каталитическое разложение пероксида водорода.
В пробирку налейте 1 – 2 мл. пероксида водорода и внесите тлеющую лучину не прикасаясь к жидкости. Что наблюдаете? Теперь в пробирку прибавляем немного порошка оксида марганца и с помощью тлеющей лучины определяем выделившийся газ.
Составьте уравнение реакции разложения пероксида водорода под действием катализатора.
Лабораторная работа 3
Химическое равновесие
Опыт 1. Влияние концентрации реагирующих веществ на смещение химического равновесия.
В стакан поместить 5 мл 0,0025 н. раствора хлорида железа (III) и 5 мл 0,0025 н. роданида калия. Содержимое разлейте поровну в 4 пробирки.
В первую пробирку добавляем немного концентрированного раствора роданида калия. Во вторую – концентрированного хлорида железа (III). В третью – кристаллический хлорид калия. Перемешайте. Четвертая пробирка остается для сравнения. Сравните цвет жидкостей в пробирках.
Запишите уравнение обратимой реакции. На основании принципа Ле-Шателье сделайте вывод о смещении химического равновесия при изменении концентрации реагирующих веществ.
FeCl3 + 3 KCNS ↔ Fe(CNS)3 + 3 KCl
Роданид железа (оданид железРрFe(CNS)3) малодиссоциируемое соединение кроваво-красного цвета. По изменению интенсивности окраски судят об изменении концентрации (оданид железРрFe(SCN)3), то есть о смещении равновесия.
Полученные данные свести в таблицу согласно следующей схеме:
|
№ п/п пробирок |
Взаимодействие реагирующих веществ |
Цвет раствора |
Изменение направления равновесия |
|
1 |
FeCl3 + KCNS эталонный раствор |
|
|
|
2 |
эталонный раствор + KCl (кр) |
|
|
|
3 |
эталонный раствор + FeCl3 (конц.) |
|
|
|
4 |
эталонный раствор+ KCNS(конц.) |
|
|
Опыт 2. Влияние температуры на смещение химического равновесия
В пробирку наливаем 2 мл. раствора крахмала-клейстера и 1-2 капли раствора йода. Что наблюдаете?
Содержимое нагрейте до исчезновения синей окраски, затем охладите в холодной воде. Что наблюдаете? Изменение цвета объясняется тем, что соединение, получившиеся при взаимодействии йода с крахмалом, при нагревании разрушается.
Объясните наблюдаемые изменения окраски, укажите которая из данных реакций является эндо- и которая экзотермической.
Лабораторная работа 4
Ионное произведение воды. гидролиз солей.
Опыт 1. Окраска индикаторов в различных средах.
Окраска метилового оранжевого в различных средах
В три пробирки добавляем 4-5 капель воды и 1-2 капли метилового оранжевого.
В первую пробирку прибавляем хлороводородную кислоту.
Во вторую – гидроксид калия.
Отметить изменение цвета индикатора в различных средах.
Окраска фенолфталеина в различных средах
В три пробирки добавляем 4-5 капель воды и 1-2 капли фенолфталеина.
В первую пробирку прибавляем хлороводородную кислоту.
Во вторую – гидроксид калия.
Отметить изменение цвета индикатора в различных средах.
Окраска нейтрального лакмуса в различных средах
В три пробирки добавляем 4-5 капель воды и 1-2 капли нейтрального лакмуса.
В первую пробирку прибавляем хлороводородную кислоту.
Во вторую – гидроксид калия.
Отметить изменение цвета индикатора в различных средах.
Окраска универсальной индикаторной бумаги
На универсальную индикаторную бумагу наносим каплю воды
На универсальную индикаторную бумагу наносим каплю хлорной кислоты
На универсальную индикаторную бумагу наносим каплю гидроксида калия
Отметить изменение цвета индикатора в различных средах.
Написать уравнения диссоциации хлорной кислоты и гидроксида калия в водных средах.
Результаты опытов записать в таблицу.
|
Название индикатора |
Реакция среды | ||
|
кислая |
нейтральная |
щелочная | |
|
Метилоранж |
|
|
|
|
Фенолфталеин |
|
|
|
|
Лакмус |
|
|
|
|
Универсальный индикатор |
|
|
|
|
|
рН= |
рН= |
рН= |
Опыт 2. Определение характера среды в растворах солей
В пяти пробирках растворить в 8—10 каплях дистиллированной воды по 2—3 кристаллика следующих солей: в первой — ацетат натрия CH3COONa, во второй — карбонат натрия Na2CO3, в третьей — хлорид аммония NH4C1, в четвертой — сульфат алюминия A12(SO4)3, в пятой — хлорид натрия NаC1
Определить рН растворов: в первой, третьей и пятой пробирках с помощью универсальной индикаторной бумаги, во второй — с помощью фенолфталеина, в четвертой — с помощью метилоранжа. Затем в первую пробирку добавить 1—2 капли фенолфталеина, в третью — 1—2 капли лакмуса, а в пятую – 1-2 капли метилоранжа. Изменится ли окраска растворов в первой и третьей пробирках? Записать и объяснить наблюдения. Написать уравнения реакций гидролиза взятых солей в молекулярной и ионной формах. Результаты опыта занести в таблицу:
|
Формула соли |
Окраска индикаторов |
Среда раствора |
Природа кислоты и основания, образующих соль | ||
|
Метилоранжа |
Фенолфталеина |
Лакмуса | |||
|
CH3COONa |
|
|
|
|
|
|
Na2CO3 |
|
|
|
|
|
|
NH4C1 |
|
|
|
|
|
|
A12(SO4)3 |
|
|
|
|
|
|
NаC1 |
|
|
|
|
|
Опыт 3. Необратимый гидролиз
По таблице растворимости определить соли, не существующие в растворе, т. е. подвергающиеся полному (необратимому) гидролизу. К 4—5 каплям раствора сульфата алюминия A12(SO4)3 прибавить столько же раствора соли карбоната натрия Na2CO3. Как доказать, что выпавший осадок не является солью? Написать уравнение реакции с учетом полного гидролиза A12(СO3)3.
Опыт 4. Влияние разбавления на гидролиз
В пробирку поместить несколько капель раствора хлорида сурьмы SbCl3 или висмута(Ш) BiCl3 и постепенно разбавлять дистиллированной водой. Что наблюдается? Написать уравнения реакций гидролиза в молекулярной и ионной формах, учитывая, что при разбавлении гидролиз идет по второй ступени, при этом образуется малорастворимый хлорид оксосурьмы (Ш) SbOCl или хлорид оксовисмута(Ш) BiOCl за счет отщепления от дигидроксосоли молекулы воды:
Sb(OH)2Cl - Н2О = SbOCl.
С помощью индикатора отметить характер среды раствора. Затем прибавить несколько капель НС1 до растворения осадка. Снова прилить воду. Объяснить смещение ионного равновесия гидролиза взятой соли.
Лабораторная работа 5
Коллоидные растворы
Опыт 1. Получение коллоидного раствора Fe(ОН)3 методом конденсации при гидролизе соли железа и изучение его оптических свойств.
Пробирку заполните водой (примерно до 1/2 ее объема) и поставьте в горячую водяную баню. Через 5—7 мин внесите в пробирку 2—3 капли концентрированного раствора FеCl3. Наблюдайте образование красно-оранжевого золя Fe(OH)3.
Пользуясь осветительной установкой, убедитесь в том, что получен коллоидный раствор.
Раствор сохраните для проведения опыта 4.
Конденсация частиц молекулярной дисперсности может происходить в процессе гидролиза солей некоторых поливалентных металлов, например FеCl3. Гидролиз иона Fe3+ протекает по ступеням:
Fe3+ +H20 = FeOH2+ + H+ (I)
FeOH2++H20 = Fe(0H)2+ + H+ (II)
Fe(OH)+2+ H20=Fe(OH)3+ H+ (III)
Гидроксид железа Fe(OH)3 не выпадает в осадок, так как степень гидролиза FеCl3 по третьей ступени мала.
Зарядообразующими ионами в процессе образования золя могут быть Fe3+, FeOH2+ и Fe(OH)2+, а противоионами - С1-.
При оформлении результатов опыта укажите:
1. Состав ядра коллоидной частицы полученного золя.
2. Состав коллоидной частицы полученного золя.
3. Состав мицеллы полученного золя.
4. Объясните наблюдаемый оптический эффект (эффект Тиндаля) и причину агрегативной устойчивости золя.
Опыт 2. Получение золя гидроксида железа (III) методом диспергирования осадка Fe(OH)3
Примером получения золей методом диспергирования может служить получение коллоидного раствора Fe(OH)3 путем химического дробления осадка гидроксида железа (III), называемого пептизацией. Пептизатором может быть электролит с одноименным ионом, входящим в состав осадка, например FeCl3 (Fe3+ — одноименный ион).
Добавление пептизатора к небольшому количеству осадка в водной среде приводит к тому, что ионы Fe3+ проникают в глубь осадка и разрыхляют его, постепенно дробя до коллоидной дисперсности. Дробление называют химическим потому, что ионы не просто проникают в осадок, а, взаимодействуя с его частицами, образуют дисперсную фазу положительного заряда. Ионы Fe3 являются зарядообразующими в составе коллоидных частиц получающегося золя, а ионы С1- — противоионами.
В стакан объемом 50 мл к 25 мл воды добавьте 10 капель 20% раствора FeCl3. Перемешайте содержимое стакана и после этого добавьте по каплям (!) раствор гидроксида аммония NH4OH до полного осаждения гидроксида Fe(OH)3.
После того как осадок уплотнится на дне стакана, осторожно слейте с него избыток жидкости. Осадок промойте 2—3 раза, добавляя к нему небольшие порции воды и сливая эту воду после того, как между ней и осадком четко обозначится граница раздела.
К осадку гидроксида железа (Ш) прилейте 25 мл Н2О и 3 капли 20% раствора FeCl3. Смесь хорошо перемешайте. Для ускорения процесса пептизации нагрейте раствор на водяной бане. Прекратите нагревание тогда, когда раствор приобретет устойчивую красно-оранжевую окраску.
Пользуясь осветительной установкой, убедитесь в том, что получен коллоидный раствор.
Сохраните полученный коллоидный раствор для проведения опыта 4.
При оформлении результатов опыта укажите:
1. Состав ядра коллоидной частицы полученного золя.
2. Состав коллоидной частицы полученного золя.
3. Состав мицеллы полученного золя.
4. Объясните роль пептизатора в процессе получения золя и причину наблюдаемого оптического эффекта.
Опыт 3. Получение золя желатина из твердого коллоида
При набухании твердого желатина в воде образуется гель, а потом (при нагревании) — золь.
Поместите в пробирку кусочек твердого желатина и прилейте к нему примерно 10 мл воды. Через 10—15 мин нагрейте пробирку на водяной бане для ускорения процесса образования коллоидного раствора.
Пользуясь осветительной установкой, убедитесь в том, что получен золь. Оставьте пробирку с золем желатина в штативе на 20—30 мин и наблюдайте образование геля.
При оформлении результатов опыта ответьте на следующие вопросы:
1. Какой метод был использован при получении золя желатина — конденсации или диспергирования?
2. Какое вещество было использовано в качестве пептизатора?
3. Как вы убедились в том, что получили коллоидный раствор желатина?
4. Какие стадии протекают в процессах получения гидрофильных золей из твердых коллоидов?
5. В чем разница между составом ядер коллоидных частиц гидрофобных и гидрофильных золей?
Опыт 4. Коагуляция золя действием электролита
Нарушение агрегативной и кинетической устойчивости золей происходить при добавлении электролита.
К коллоидным растворам, полученным в опытах 1и 2, добавьте по нескольку капель концентрированного раствора сульфата алюминия Al2(SO4)3. Через 2-3 мин наблюдайте укрупнение частиц и образование осадка.
При оформлении результатов опыта укажите:
1. Состав частицы дисперсной фазы коллоидной системы:
а) до введения Al2(SO4)3;
б) после введения Al2(SO4)3
2. Состав образовавшегося осадка.
3. Объясните роль Al2(SO4)3 в процессе коагуляции золя. Какими процессами сопровождаются нарушения агрегативной и кинетической устойчивости золей?
Лабораторная работа 6
КОРРОЗИЯ МЕТАЛЛОВ
Опыт 1. Коррозия при контакте металлов неодинаковой активности
В согнутую под прямым углом и закрепленную в штативе стеклянную трубочку влить 0,01н. раствор серной кислоты. В одно колено трубки ввести цинковую пластинку и наблюдать медленное выделение водорода. Ввести в другое колено медную проволоку, не доводя её до соприкосновения с цинком. Наблюдается ли выделение водорода на меди? Погрузить медную проволоку так, чтобы она контактировала с цинком. Объяснить выделение водорода на меди в этом случае.
Составить схему действия образовавшейся гальванопары. Как повлиял контакт с медью на коррозию цинка?
Опыт 2. Коррозия при анодном и катодном покрытии железа.
В кислой среде.
Наполнить на 2/3 объема две пробирки 0,01н. раствором серной кислоты и добавить в них по 2-3 капли раствора гексациано(Ш)-феррата калия. Затем в одну из них положить кусочек железа, скрепленного с цинком, а в другую - кусочек железа, скрепленного с оловом, и наблюдать за ходом реакции по скорости образования синей окраски от возникновения гексациано(Ш)-феррата железа. У какой из пар коррозия начинается скорее? Составить схему действия коррозионных гальвано пар.
В нейтральной среде.
Проделать аналогичный опыт, взяв вместо серной кислоты раствор хлорида натрия. Какие из металлов являются анодом и катодом в парах железо-цинк и железо-олово? Какие происходят реакции?
Опыт 3. Аэрационная коррозия
При неодинаковом доступе кислорода к поверхности металла на ней возникает гальваническая пара особого рода: участок, более адсорбирующий кислород является катодом, а менее адсорбирующий -анодом. Вследствие сферической сплющенности капли воды кольцевая зона под ее краем окажется катодной, а под центральной частью - анодной.
Очистить поверхность стальной пластинки, промыть и вытереть фильтровальной бумагой. На очищенную поверхность нанести каплю реактива (состав: 3%-ного раствора хлорида натрия - 10 мл, растворов гексациано(Ш)-феррата калия и фенолфталеина ~ по 2-3 капли).
Наблюдать появление синей окраски в центральной окислительной зоне и розовой - в кольцевой восстановительной зоне.
Объяснить происходящие процессы (кислородной деполяризации), составить схему действия коррозионных гальванопар.
Лабораторная работа 7
КАЧЕСТВЕННЫЙ АНАЛИЗ КАТИОНОВ
Опыт 1. Открытие катионов щелочных и щелочноземельных металлов (Na+, K+, Ca2+, Sr2+, Ba2+) по окрашиванию пламени
Погрузите нихромовую или медную проволоку в соляную кислоту, затем окуните её в кристаллы NaCl и внесите в бесцветное пламя спиртовки. Каждый раз предварительно очищая проволоку в кислоте, проделайте то же с кристаллами КС1, СаС12, SrCL2, ВаС12.
Отметьте, в какой цвет окрашивает пламя каждая соль.
Na+ окрашивает пламя в желтый цвет, эта реакция обладает исключительно высокой чувствительностью, окрашивание проявляется при ничтожно малых количеств натрия.
K+ окрашивает пламя в фиолетовый цвет, при одновременном присутствии солей натрия, последние дают желтую окраску, которая маскирует фиолетовую.
Ba2+ окрашивает бесцветное пламя горелки в желто-зеленый цвет.
Sr2+ окрашивает пламя горелки в карминово-красный цвет.
Ca2+ - в кирпично-красный цвет.
Опыт 2. Обнаружение катионов Ba2+ с помощью сульфат-ионов
2-3 капли анализируемого раствора поместить в пробирку, прибавить 2 капли раствора Н2SO4. При наличии катионов Ba2+ появляется белый осадок, нерастворимый в разбавленных кислотах. Записать уравнение реакции. Взаимодействие Ba2+с какими ионами вызывает появление белого осадка?
Опыт 3. Обнаружение катионов аммония (NН4+)
А) Стеклянную палочку, смоченную концентрированной соляной кислотой, держать в парах NН3 над пробиркой, не касаясь стенок пробирки и анализируемого раствора. Появление белого «дыма» вокруг палочки обусловлено образованием мельчайших кристалликов NH4C1. Записать уравнение реакции.
Б) Бумажку, смоченную азотнокислой ртутью, держать в парах NН3 над пробиркой, не касаясь стенок пробирки и анализируемого раствора. Почернение бумажки обусловлено выделением металлической ртути.
4NН3 +2Нg2(NO3)2 + H2O → [NН2Нg2O]NO2+2Нg↓+ 3NH4NO3
Опыт 4. Обнаружение катионов Ag+, Pb2+, Нg2+
А) Действие соляной кислоты.
2-3 капли исследуемого раствора помещают в пробирку, прибавляют 2-3 капли раствора соляной кислоты. При наличии катионов Ag+, Pb2+ или Нg2+ выпадают белые малорастворимые осадки соответствующих хлоридов.
Хлорид серебра растворим в растворах аммиака и карбоната аммония. Характерной особенностью хлорида свинца является его растворимость в горячей воде. Хлориды свинца и серебра растворимы в избыточном количестве концентрированной соляной кислоты с образованием комплексных ионов.
Б) Действие иодида калия.
2-3 капли исследуемого раствора помещают в пробирку, прибавляют 2-3 капли раствора иодида калия. При наличии катионов Ag+ или Pb2+ - выпадает желтый осадок, при наличии Нg2+ - зеленый. В случае осадка желтого цвета, сливают с него жидкость, прибавляют 5-6 капель 2н. раствора уксусной кислоты и нагревают, приливая понемногу воду, до тех пор, пока осадок весь не растворится. Затем содержимое пробирки медленно охлаждают. При наличии Pb2+ выделяются золотисто-желтые кристаллы иодида свинца.
Определить состав катионов в исследуемом растворе. Записать уравнения реакций.
Опыт 5. Обнаружение катиона Al3+. Реакция с водным раствором аммиака
2-3 капли соли алюминия помещают в пробирку, прибавляют 2-5 капель водного раствора аммиака, нагревают на водяной бане. В результате реакции образуется белый осадок AI(OH)3, который полностью растворяется в избытке едкой щелочи с образованием алюмината, не разлагающегося при кипячении. Записать уравнение реакции.
Опыт 6. Обнаружение катиона Cr3+.
2-3 капли исследуемого раствора поместить в пробирку, прибавить 5-6 капель 8н. раствора едкого натра, 2-3 капли 3 %-ного раствора пероксида водорода и нагреть на водяной бане. При наличии Cr3+ -ионов раствор окрашивается в желтый цвет.
Последовательный ход процесса:
CrС13 + ЗNaОН = Сг(0Н)3↓ + 3NaCl
Сг(0Н)3 + NaОН = NaСг02 + 2H2O
2NaСг02+ 3H2O2+ 2NaОН = 2Na2Сг04+ 4H2O
2Сг02- +3H2O2 +2 OH-= 2Сг04-2+ 4H2O
Опыт 7. Обнаружение катиона Zn2+ с помощью гексацианоферрата (III) калия К3[Fe(CN)6]
2-3 капли исследуемого раствора поместить в пробирку, прибавить каплю серной кислоты и 2-3 капли К3[Fe(CN)6]. В случае присутствия Zn2+ образуется желтый осадок.
Zn2++ ЗК+ + [Fe(CN)6]-3 → КZn [Fe(CN)6]↓+ 2К+
Опыт 8. Обнаружение катиона Fe3+
А) Реакция с гексацианоферратом (II) калия К4[Fe(CN)6]
2-3 капли исследуемого раствора поместить в пробирку, прибавить 1-2 капли К4[Fe(CN)6]. В случае присутствия Fe3+ образуется темно-синий осадок гексацианоферрата железа Fe4[Fe(CN)6]3, так называемую берлинскую лазурь, нерастворимую в соляной кислоте.
4Fe3+ + 3[Fe(CN)6]-4 → Fe4[Fe(CN)6]3↓
Б) Реакция с роданидом аммония NH4CNS
2-3 капли исследуемого раствора поместить в пробирку, прибавить 1-2 капли хлористоводородной кислоты и 2-3 капли роданида калия или аммония. При наличии Fe3+ раствор окрашивается в красный цвет. Записать уравнение реакции.
Опыт 9. Обнаружение катиона Mn2+
2-3 капли исследуемого раствора помещают в пробирку, прибавляют 5-6 капель едкого натра и 2-3 капли перекиси водорода, смесь нагревают на водяной бане. При наличии Mn2+ выделяется буро-черный осадок Н2MnО3.
Опыт 10. Обнаружение катиона Bi3+ с помощью иодида калия
2-3 капли исследуемого раствора помещают в пробирку. С помощью стеклянной палочки вносят в анализируемый раствор одну капельку раствора иодида калия; при наличии катиона Bi3+ образуется черный осадок, при избытке внесенного иодида калия раствор окрашивается в красновато-желтый цвет. Записать уравнение реакции.
Опыт 11. Обнаружение катиона Сu2+
А) Реакция с раствором аммиака NH4ОН
Катионы Сu2+ в избытке раствора аммиака переходят в комплексный ион [Сu(NН3)4], который обладает характерным лазурно-синим цветом.
2-3 капли исследуемого раствора нитрата меди (либо сульфата меди и 2-3 капель азотной кислоты для усиления окраски) помещают в пробирку, прибавляют водный раствор аммиака NH4ОН. Отметить окраску.
Б) Реакция с роданидом аммония или калия (NH4CNS либо КCNS).
С NH4CNS или КCNS катионы Сu2+ образуют черный осадок двухвалентной меди Сu(CNS)2, который с течением времени постепенно белеет вследствие разложения его на родан CNS2 и роданид одновалентной меди СuCNS. Осадок Сu(CNS)2 и СuCNS в избытке КCNS нерастворим.
2-3 капли исследуемого раствора помещают в пробирку, прибавляют 1-2 мл насыщенного раствора NH4CNS или КCNS. Отметить цвет полученного осадка, записать уравнение реакции
В) Действие сероводорода H2S.
Действие сероводорода на солянокислый или сернокислый раствор соли меди приводит к образованию осадка СuS черного цвета, который может раствориться в азотной кислоте при нагревании.
СuSО4 + H2S = СuS↓ + H2SО4
По окончании всех опытов заполните общую таблицу по всей лабораторной работе
|
Обнаруживаемый катион |
Реактив |
Наблюдение |
|
|
|
|
Лабораторная работа 8
КАЧЕСТВЕННЫЙ АНАЛИЗ АнИОНОВ
Опыт 1. Обнаружение сульфат-аниона SO42-. Реакция с хлоридом бария.
SO24 – ионы реагируют с хлоридом бария, образуя белый осадок.
Налейте в пробирку исследуемого раствора 3-4 капли, затем добавьте 0,5 м. раствора хлорида бария. Выпадает белый кристаллический осадок. Добавьте в пробирку 2м. раствора серной кислоты, встряхните пробирку. Осадок не растворяется, что указывает на присутствие в растворе сульфат-аниона. Написать уравнение реакции.
Опыт 2. Обнаружение сульфит-аниона SO32-.
А) Реакция с раствором йода.
SO3 2-– ион обесцвечивает элементарный иод в растворе
SO32- +J2+H2O → SO42- + 2J- + 2H+
К 2-3 каплям раствора иода прибавьте 2-3 капли исследуемого раствора. В присутствии иона SO2-3 происходит обесцвечивание раствора иода.
Б) Реакция с раствором перманганата калия.
SO2-3 ионы обесцвечивают раствор перманганата калия . Реакция протекает в кислой среде, раствор KMnO4 должен быть очень разбавленный (капля раствора KMnO4 на половину пробирки воды).
Реакция протекает по уравнению
5 SO32- + 2MnO4- + 6H+ = 2Mn2+ + 5 SO42- + 3H2O
Налейте в пробирку несколько капель исследуемого раствора, прибавьте 2-3 капли 2 н раствора соляной кислоты и разбавленного перманганата калия. Обесцвечивание раствора указывает на присутствие иона SO3 2- .
Опыт 3. Обнаружение хлорид аниона Cl- Реакция с нитратом серебра
C1- - ионы образуют с нитратом серебра белый осадок хлорида серебра, нерастворимый в минеральных кислотах, но растворимый в водных растворах аммиака, карбоната аммония, цианида калия и тиосульфата натрия
Ag+ + Cl- = AgCl ↓
2-3 капли исследуемого раствора поместите в пробирку, прибавьте каплю 2н. раствора азотной кислоты и 2-3 капли раствора AgNO3 . В случае присутствия C1- ионов образуется белый осадок.
Опыт 4. Обнаружение нитрат-аниона NO3-
А) Реакция с металлическим цинком.
NO3- - ионы восстанавливаются металлическим цинком в щелочной среде до аммиака
NO3- + 4Zn + 7OH - = NH3 ↑ + 4ZnO22- + 2H2O
Поместите в пробирку 2-3 капли исследуемого раствора, добавьте 5-6 капель концентрированного раствора гидроксида натрия, всыпьте туда же немного цинковой пыли и нагрейте. Выделяющийся аммиак окрашивает фильтровальную бумагу, смоченную фенолфталеином в красный цвет.
Б) Реакция с медью.
NO3- - ионы с медью в присутствии кислоты образуют газ NO2 , который лучше всего заметен, если пробирку поместить над листом белой бумаги и смотреть в нее сверху.
2 NO3- + 3Сu + 8H+ = 3Cu2+ +4H2O + 2NO↑
2NO + O2 (воздуха) = 2NO2 ↑
К 2-3 каплям исследуемого раствора добавьте концентрированную серную кислоту и кусочек металлической меди. Содержимое пробирки нагрейте. Выделение бурного газа свидетельствует о наличии иона NO3- .
Опыт 5. Обнаружение нитрит-аниона NO2- Реакция с йодидом калия.
NO2- - ионы окисляют иод ионы в кислой среде в элементарный иод.
Выделившийся иод скрашивает крахмал в синий цвет.
2J- + 2NO2- + 4H+ = J2 + 2NO↑ +2H2O
На фильтровальную бумагу, пропитанную крахмалом, поместите каплю исследуемого раствора, 1-2 капли уксусной кислоты и каплю иодида калия. В присутствии NO2- образуется синее пятно.
По окончании всех опытов заполните общую таблицу по всей лабораторной работе
|
Обнаруживаемый анион |
Реактив |
Наблюдение |
|
|
|
|
Лабораторная работа 9
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Опыт 1. Титриметрический анализ. Определение содержания хлороводорода в исследуемом растворе соляной кислоты.
Соляная кислота является сильной кислотой и при титровании ее рабочим раствором щелочи NаОН образуется соль, которая не подвергается гидролизу. Поэтому в точке эквивалентности раствор имеет нейтральную среду; т.е. рН = 7.
Рабочим 0,1н раствором щелочи NaOH (КОН) заполнить бюретку выше нулевого деления, затем открыть кран и заполнить носик бюретки раствором так, чтобы в нем не осталось пузырьков воздуха. Если необходимо, долить раствор щелочи в бюретку выше нуля и затем избыток жидкости из бюретки выпустить в подставленный стакан, пока нижний мениск жидкости не установится на нулевом делении бюретки.
Пробу анализируемого раствора количественно переносят в мерную колбу на 100мл, разбавляют дистиллированной водой до метки и тщательно перемешивают. В колбу для титрования переносят мерной пипеткой 10 мл приготовленного раствора и добавляют 1-2 капли фенолфталеина.
Колбу для титрования помещают на листе белой бумаги под носиком бюретки. Кончик носика должен находиться на уровне горлышка колбы.
При проведении титрования рабочий раствор щелочи приливают небольшими порциями, а колбу осторожно встряхивают для быстрого перемешивания раствора. При первом появлении малиновой окраски в месте падения капли рабочего раствора его приливают по одной капле. Титрование прекращают, когда розовая окраска раствора не исчезает в течение 10 секунд.
Опыт повторяют не менее трех раз.
По данным титрования рассчитать нормальность раствора и массу НС1 в исследуемом растворе по формулам:
Сн НС1 = V NaOH * Сн NaOH / Vал , где Vал – объем аликвоты (10 мл)
m НС1 = Vк * Э НС1* Сн НС1 / 1000, где Vк – объем колбы (100 мл)
Опыт 2. Гравиметрический анализ. Определение бария в кристаллическом хлориде бария
Для количественного определения бария его осаждают в виде сульфата бария BаSO4. Ионы SO42- , необходимые для осаждения ионов Ва2+, прибавляют в виде H2SO4.
Взвесить часовое стекло. На взвешенном стекле взять навеску 0.5-0.7 г кристаллического хлорида бария. Навеску перенести в чистый стакан емкостью 200-300 мл. Держа стекло наклонно над стаканом, струей воды хорошо обмыть стекло, направляя всю стекающую жидкость в стакан. Полученный раствор разбавить водой до 75-100 мл, помешивая стеклянной палочкой. Палочку нельзя вынимать из стакана до полного окончания осаждения. Прибавить 2-3 мл 2 н НС1. Нагреть почти до кипения, но не кипятить.
В другой небольшой стакан налить 5-6 мл 2н H2SO4. Разбавить раствор водой до 40-50 мл и нагреть до кипения. К горячему раствору хлорида бария прибавить горячий раствор серной кислоты медленно, тонкой струей, постоянно помешивая стеклянной палочкой. Вначале добавлять серную кислоту медленно, а последние 3-5 мл быстрее.
Стакан с осадком тотчас же поставить на кипящую водяную баню. Дать смеси отстоятся. Осаждение при нагревании и медленное охлаждение на нагретой водяной бале способствует образованию крупнокристаллического осадка. Когда раствор над осадком станет прозрачным, проверить полноту осаждения. Для этого осторожно влить в раствор по стенке стакана 2-3 капли серной кислоты. Если в месте падения капель кислоты не образуется мути, осаждение считается законченным.
Взять плотный, предварительно взвешенный фильтр, уложить в воронку, смочить дистиллированной водой. Декантировать через фильтр прозрачную жидкость над осадком. Для этого по плотно приставленной к носику стакана палочке осторожно слить с осадка жидкость так, чтобы не взмучивать его. Отмыв осадок, закрыть воронку влажным куском фильтровальной бумаги и высушить осадок в сушильном шкафу при 120-125 °С.
Расчет
Определить сколько бария входит в состав осадка сульфата бария и сколько процентов бария в пробе.
Допустим, взято для анализа 0.5850 г хлорида бария, осадок 0.5642 г сульфата бария.
Молекулярный вес BaSO4 233.40. Атомный вес бария 137.34, следовательно,
233.40г BaSO4 - 137.34 г Ва
0.5642 г BaSO4 - Х г Ва
Х = 0.3321 г Ва
Это количество бария содержится во взятой навеске образца хлорида бария.
Содержание бария в процентах к взятой навеске:
0.5850 г образца - 0.3321 г Ва
100 г образца - У г Ва
У = 56.75%
