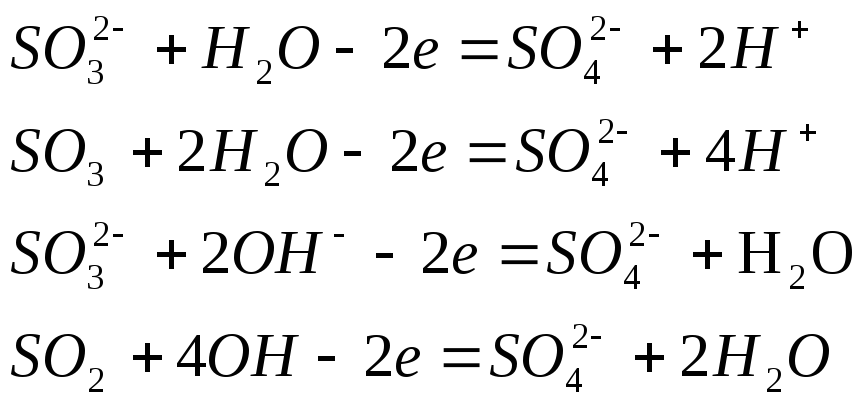- •Е.С. Денисова
- •Министерство транспорта Российской Федерации Федеральное агентство морского и речного транспорта___
- •Е.С. Денисова
- •Раздел 1. Общая и неорганическая химия Лекция 1. Количественные законы химии и стехиометрические расчёты
- •Лекция 2. Строение атома и периодическая система Менделеева
- •Электронные конфигурации атомов элементов Периодической системы.
- •Периодическая система д.И. Менделеева
- •Лекция 3. Химическая связь
- •Металлическая связь
- •Водородная связь
- •Лекция 4. Химия элементов
- •Химия s- элементов
- •Химия р- элементов
- •Атомы элементов подгруппы в основном состоянии имеют следующее строение внешней электронной оболочки: ns2np2 , в возбужденном ns1np3.
- •Характеристика элементов главной подгруппы V группы Атомы элементов подгруппы имеют следующее строение внешней электронной оболочки: ns2np3.
- •Лекция 5. Основные классы неорганических соединений
- •Кислоты
- •Основания или гидроксиды металлов
- •Раздел 2. Физическая химия Лекция 6. Энергетика химических процессов
- •Скорость химической реакции
- •Химическое равновесие
- •Лекция 8. Растворы
- •Растворы электролитов
- •Гидролиз солей
- •Лекция 9. Окислительно-восстановительные реакции
- •Лекция 10. Электролиз как окислительно-восстановительный процесс
- •Теоретическое обоснование процессов электролиза.
- •Равен 2,010 в, что значительно превышает стандартный потенциал окисления воды (1,228 в). Стандартный потенциал окисления иона f- имеет ещё большее значение (2,87 в).
- •Лекция 11. Коррозия металлов и методы защиты от коррозии
- •Раздел 3. Коллоидная химия Лекция 12. Поверхностные явления и адсорбция
- •Лекция 13. Дисперсные системы. Коллоидные растворы
- •Методы получения лиофобных коллоидов.
- •Свойства коллоидных растворов
- •Ответ: для коагуляции требуется 0,17 мл раствора сульфата алюминия. Коллоидные растворы в природе и технике.
- •Качественный анализ вещества
- •Примеры качественных реакций на катионы
- •Примеры качественных реакций на анионы
- •Лекция 15. Количественный анализ вещества
- •Инструментальные методы анализа
- •Раздел 5. Высокомолекулярные соединения Лекция 16. Полимеры
- •Общая характеристика и классификация
- •Методы получения полимеров
- •Свойства полимеров
- •Лекция 17. Применение полимеров
- •Углеводы
- •Нуклеотиды Известно четыре нуклеотида, которые называются аденин, гуанин, тимин, цитозин и урацил, они являются азотистыми основаниями.
- •Библиографический список
- •644099, Г. Омск, ул. И. Алексеева, 4
- •644012, Г. Омск, ул. 9 Дунайская, 20
Лекция 9. Окислительно-восстановительные реакции
Общие понятия и определения. Степень окисления. Классификация окислительно-восстановительных реакций. Составление уравнений окислительно-восстановительных реакций.
Все многообразие химических реакций можно свести к двум типам. Если в результате реакции степени окисления элементов не изменяются, то такие реакции называют обменными, в противном случае – окислительно-восстановительными реакциями.
Протекание химических реакций обусловлено обменом частицами между реагирующими веществами. Например, в реакции нейтрализации происходит обмен между катионами и анионами кислоты и основания, в результате образуется слабый электролит – вода:
![]()
Часто обмен сопровождается переходом электронов от одной частицы к другой. Так, при вытеснении цинком меди в растворе сульфата меди (II)
![]()
электроны от атомов цинка переходят к ионам меди:

или
![]() .
.
Процесс потери электронов частицей называют окислением, а процесс приобретения электронов – восстановлением. Окисление и восстановление протекают одновременно, поэтому взаимодействия, сопровождающиеся переходом электронов от одних частиц к другим, называют окислительно-восстановительными реакциями.
Степень окисления – величина, численно равная формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому данного соединения.
Используя понятие степени окисления, можно дать более общее определение процессов окисления и восстановления. Окислительно - восстановительными называют химические реакции, которые сопровождаются изменением степеней окисления элементов участвующих в реакции веществ. При восстановлении степень окисления элемента уменьшается, при окислении – увеличивается. Вещество, в состав которого входит элемент, понижающий степень окисления, называют окислителем; вещество, в состав которого входит элемент, повышающий степень окисления, называют восстановителем.
Степень окисления элемента в соединении определяют в соответствии со следующими правилами:
степень окисления элемента в простом веществе равна нулю;
алгебраическая сумма всех степеней окисления атомов в молекуле равна нулю;
алгебраическая сумма всех степеней окисления атомов в сложном ионе, а также степень окисления элемента в простом одноатомном ионе равна заряду иона;
отрицательную степень окисления проявляют в соединении атомы элемента, имеющего наибольшую электроотрицательность;
максимально возможная (положительная) степень окисления элемента соответствует номеру группы, в которой расположен элемент в Периодической системе Д.И. Менделеева.
Степень
окисления атомов элементов в соединении
записывают над символом данного элемента,
указывая вначале знак степень окисления,
а затем ее численное значение, например
![]() .
.
Ряд элементов в соединениях проявляет постоянную степень окисления, что используют при определении степеней окисления других элементов:
фтор, имеющий наивысшую среди элементов электроотрицательность, имеет степень окисления -1;
водород проявляет степень окисления +1, кроме гидридов металлов (-1);
металлы IA подгруппы имеют степень окисления +1;
металлы IIA подгруппы, а также цинк и кадмий имеют степень окисления +2;
степень окисления алюминия +3;
степень
окисления кислорода равна -2, за исключением
соединений, в которых кислород присутствует
в виде молекулярных ионов:
![]() - пероксидного аниона,
- пероксидного аниона,![]() - озонидного аниона, а также фторидов
кислорода ОxF2.
- озонидного аниона, а также фторидов
кислорода ОxF2.
Пример 1. Вычислите степень окисления хрома в соединении K2Cr2O7. Калий имеет постоянную степень окисления +1, т.к. находится в I группе главной подгруппе; у кислорода степень окисления -2, степень окисления хрома обозначим через х. Составим алгебраическое уравнение:
2∙(+1) + 2∙х + 7∙(-2) = 0; 2х = 14 - 2 = 12; х = +6
Следовательно, в соединении K2Cr2O7 хром имеет высшую степень окисления +6.
Соединения,
в состав которых входят атомы элементов
с максимальной (положительной) степенью
окисления могут только восстанавливаться,
выступая в качестве окислителей,
например,
![]() Соединения,
содержащие элементы с минимальной
степенью окисления, например,
Соединения,
содержащие элементы с минимальной
степенью окисления, например,![]() могут
только окисляться и выступать в качестве
восстановителей.
могут
только окисляться и выступать в качестве
восстановителей.
Вещества,
содержащие элементы с промежуточными
степенями окисления, например,
![]() обладаютокислительно
- восстановительной двойственностью.
В зависимости от партнера по реакции
такие вещества способны и принимать
(при взаимодействии с более сильными
восстановителями), и отдавать (при
взаимодействии с более сильными
окислителями) электроны.
обладаютокислительно
- восстановительной двойственностью.
В зависимости от партнера по реакции
такие вещества способны и принимать
(при взаимодействии с более сильными
восстановителями), и отдавать (при
взаимодействии с более сильными
окислителями) электроны.
Классификация. Различают четыре типа окислительно-восстановительных реакций.
1. Если окислитель и восстановитель разные вещества, то такие реакции относятся к межмолекулярным.
2. При термическом разложении сложных соединений, в состав которых входят окислитель и восстановитель в виде атомов разных элементов, происходят окислительно-восстановительные реакции, называемые внутримолекулярными:

3. Реакции диспропорционирования (дисмутации или, согласно устаревшей терминологии, самоокисления - самовосстановления) могут происходить, если соединения, содержащие элементы в промежуточных степенях окисления, попадают в условия, где они оказываются неустойчивыми (например, при повышенной температуре). Степень окисления этого элемента и повышается, и понижается:

4. Реакции контрпропорционирования (конмутации) – это процессы взаимодействия окислителя и восстановителя, в состав которых входит один и тот же элемент с разными степенями окисления. В результате продуктом окисления и восстановления является вещество с промежуточной степенью окисления атомов данного элемента:

Существуют также реакции смешанного типа. Например, к внутримолекулярной реакции контрпропорционирования относится реакция разложения нитрата аммония
![]()
Составление уравнений.
Уравнения окислительно-восстановительных реакций составляют, основываясь на принципах равенства числа одних и тех же атомов до и после реакции, а также учитывая равенство числа электронов, отдаваемых восстановителем, и числа электронов, принимаемых окислителем, т.е. электронейтральность молекул. Реакцию представляют в виде системы двух полуреакций – окисления и восстановления, суммирование которых с учетом указанных принципов приводит к составлению общего уравнения процесса.
Для составления уравнений окислительно-восстановительных реакций наиболее часто используют метод электронно-ионных полуреакций и метод электронного баланса.
Метод электронно-ионных полуреакций применяют при составлении уравнений реакции, протекающих в водном растворе, а также реакции с участием веществ, степень окисления элементов которых трудно определить (например, KNCS, CH3CH2OH).
Согласно этому методу, выделяют следующие главные этапы составления уравнения реакций.
а) записывают общую молекулярную схему процесса с указанием восстановителя, окислителя и среды, в которой протекает реакция (кислотная, нейтральная или щелочная). Например
![]()
б) учитывая диссоциацию электролитов в водном растворе, данную схему представляют в виде молекулярно-ионного взаимодействия. Ионы, степени окисления атомов которых не изменяются, в схеме не указывают, за исключением ионов среды (Н+, ОН-):
![]()
в) определяют степени окисления восстановителя и окислителя, а также продуктов их взаимодействия:
окисление восстановителя восстановление окислителя
![]()
![]()
(Данный этап не является обязательным и его можно опустить, если определение степеней окислителя затруднительно. Скобки при записи аниона обычно не используются, но в данном случае необходимы, чтобы избежать путаницы при определении степени окисления элемента и заряда аниона.)
г) записывают материальный баланс полуреакции окисления и восстановления:
окисление восстановителя восстановление окислителя
![]()
![]()
д) суммируют полуреакции, учитывая принцип равенства отданных и принятых электронов:

и, сокращая одноименные частицы, получают общее ионно-молекулярное уравнение
![]()
е) добавляют ионы, не участвовавшие в процессе окисления – восстановления, уравнивают их количество слева и справа, и записывают молекулярное уравнение реакции
![]()
Наибольшие трудности возникают при составлении материального баланса полуреакций окисления и восстановления, когда изменяется число атомов кислорода, входящих в состав частиц окислителя и восстановителя. Следует учитывать, что в водных растворах связывание или присоединение кислорода происходит с участием молекул воды и ионов среды.
В процессе окисления на один атом кислорода, присоединяющийся к частице восстановителя, в кислотной и нейтральной средах расходуется одна молекула воды и образуются два иона Н+; в щелочной среде расходуются два гидроксид-иона ОН- и образуется одна молекула воды (табл. 3).
Для связывания одного атома кислорода окислителя в кислотной среде в процессе восстановления расходуются два иона Н+ и образуется одна молекула воды; в нейтральной и щелочной средах расходуется одна молекула Н2О образуются два иона ОН- (табл. 3,4).
Достоинства метода электронно-ионных полуреакций заключается в том, что при составлении уравнений окислительно-восстановительных реакций учитываются реальные состояния частиц в растворе и роль среды в протекании процессов, нет необходимости использования формального понятия степени окисления.
Таблица 3
Присоединение атомов кислорода к восстановителю в процессе окисления
|
Среда |
Частицы, участвующие в присоединении одного атома кислорода |
Образующиеся частицы |
Примеры полуреакций окисления |
|
Кислотная, нейтральная
Щелочная |
Н2О
2ОН- |
2Н+
Н2О
|
|
Таблица 4
Связывание атомов кислорода окислителя в процессе восстановления
|
Среда |
Частицы, участвующие в связывании одного атома кислорода |
Образующиеся частицы |
Примеры полуреакций восстановителя |
|
Кислотная
Нейтральная, щелочная |
2Н+
Н2О
|
Н2О
2ОН-
|
|
Метод электронного баланса, основанный на учете изменения степени окисления и принципе электронейтральности молекулы, является универсальным. Его обычно используют для составления уравнений окислительно-восстановительных реакций, протекающих между газами, твердыми веществами и в расплавах.
Последовательность операций, согласно методу, такая:
1) записывают формулы реагентов и продуктов реакции в молекулярном виде:
![]()
2) определяют степени окисления атомов, меняющих ее в процессе реакции:
![]()
3) по изменению степеней окисления устанавливают число электронов, отдаваемых восстановителем, и число электронов, принимаемых окислителем, и составляют электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов:

4) множители электронного баланса записывают в уравнение окислительно-восстановительной реакции как основные стехиометрические коэффициенты:
![]()
5) подбирают стехиометрические коэффициенты остальных участников реакции:
![]()
При составлении уравнений следует учитывать, что окислитель (или восстановитель) может расходоваться не только в основной окислительно-восстановительной реакции, но и при связывании образующихся продуктов реакции, то есть выступать в роли среды и солеобразователя.
Примером, когда роль среды играет окислитель, служит реакция окисления металла в азотной кислоте, составленная методом электронно-ионных полуреакций:

или
![]()
Примером, когда восстановитель является средой, в которой протекает реакция, служит реакция окисления соляной кислоты дихроматом калия, составленная методом электронного баланса:

или
![]()