
- •Кристаллографическая природа пластической деформации
- •Равновесие фаз
- •[Править]Условие равновесия фаз
- •[Править]Уравнение Клапейрона — Клаузиуса
- •[Править]Правило фаз Гиббса
- •[Править]Определения (для систем с постоянным числом частиц)
- •[Править]Каноническое уравнение состояния
- •[Править]Метод термодинамических потенциалов. Соотношения Максвелла
- •[Править]Системы с переменным числом частиц. Большой термодинамический потенциал
- •[Править]Потенциалы и термодинамическое равновесие
- •Отпуск сталей. Превращения в стали при отпуске, изменение микроструктуры и свойств
[Править]Правило фаз Гиббса
Рассмотрим
теперь систему, вообще говоря, химически
неоднородную (состоящую из нескольких
веществ). Пусть ![]() —
число компонентов (веществ) в системе,
а
—
число компонентов (веществ) в системе,
а ![]() —
число фаз. Условие равновесия фаз для
такой системы можно записать в виде
системы из
—
число фаз. Условие равновесия фаз для
такой системы можно записать в виде
системы из ![]() уравнений:
уравнений:
Здесь ![]() — химический
потенциал для
i-го компонента в j-й фазе. Он однозначно
определяется давлением, температурой
и концентрацией каждого компонента в
фазе. Концентрации компонетнов не
независимы (их сумма равна 1). Поэтому
рассматриваемая система уравнений
содержит
— химический
потенциал для
i-го компонента в j-й фазе. Он однозначно
определяется давлением, температурой
и концентрацией каждого компонента в
фазе. Концентрации компонетнов не
независимы (их сумма равна 1). Поэтому
рассматриваемая система уравнений
содержит ![]() неизвестных
(
неизвестных
(![]() —
концентрации компонентов в фазах, плюс
температура и давление).
—
концентрации компонентов в фазах, плюс
температура и давление).
Система разрешима, вообще говоря, если число уравнений не превышает числа неизвестных (система, не удовлетворяющая этому условию, также может быть разрешима, однако это исключительный случай, с которым в физике можно не считаться). Поэтому
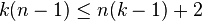 ,
,
отсюда
 ,
,
то есть число фаз в равновесной системе может превышать число компонентов не более, чем на два.
Последнее неравенство называется правилом фаз Гиббса. В частном случае для однокомпонентной (химически однородной системы) оно превращается в условие
 .
.
Термодинами́ческие потенциа́лы (термодинамические функции) — характеристические функции в термодинамике, убыль которых в равновесных процессах, протекающих при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе.
Термин был введён Пьером Дюгемом, Гиббс в своих работах использовал термин «фундаментальные функции».
Выделяют следующие термодинамические потенциалы:
внутренняя энергия
энтальпия
свободная энергия Гельмгольца
потенциал Гиббса
большой термодинамический потенциал
|
[Править]Определения (для систем с постоянным числом частиц)
[править]Внутренняя энергия
Определяется в соответствии с первым началом термодинамики, как разность между количеством теплоты, сообщенным системе, и работой, совершенной системой над внешними телами:
![]() .
.
[править]Энтальпия
Определяется следующим образом:
![]() ,
,
где ![]() — давление,
а
— давление,
а ![]() — объём.
— объём.
Поскольку
в изобарном
процессе работа
равна ![]() , приращение энтальпии
в квазистатическом изобарном
процессе равно количеству теплоты,
полученному системой.
, приращение энтальпии
в квазистатическом изобарном
процессе равно количеству теплоты,
полученному системой.
[править]Свободная энергия Гельмгольца
Также часто называемый просто свободной энергией. Определяется следующим образом:
![]() ,
,
где ![]() — температура и
— температура и ![]() — энтропия.
— энтропия.
Поскольку
в изотермическом процессе количество
теплоты, полученное системой, равно ![]() ,
то убыль свободной
энергии в квазистатическом изотермическом
процессе равна работе, совершённой
системой над внешними
телами.
,
то убыль свободной
энергии в квазистатическом изотермическом
процессе равна работе, совершённой
системой над внешними
телами.
Потенциал Гиббса
Также называемый энергией Гиббса, термодинамическим потенциалом, свободной энергией Гиббса и даже просто свободной энергией (что может привести к смешиванию потенциала Гиббса со свободной энергией Гельмгольца):
![]() .
.
Термодинамические потенциалы и максимальная работа
Внутренняя энергия представляет собой полную энергию системы. Однако второе начало термодинамики запрещает превратить всю внутреннюю энергию в работу.
Можно показать, что максимальная полная работа (как над средой, так и над внешними телами), которая может быть получена от системы в изотермическом процессе, равна убыли свободной энергии Гельмгольца в этом процессе:
![]() ,
,
где ![]() —
свободная энергия Гельмгольца.
—
свободная энергия Гельмгольца.
В
этом смысле ![]() представляет
собой свободную энергию,
допускающую преобразование в работу.
Оставшаяся часть внутренней энергии
может быть названа связанной.
представляет
собой свободную энергию,
допускающую преобразование в работу.
Оставшаяся часть внутренней энергии
может быть названа связанной.
В некоторых приложениях приходится различать полную и полезную работу. Последняя представляет собой работу системы над внешними телами, исключая среду, в которую она погружена. Максимальная полезная работа системы равна
![]()
где ![]() —
энергия Гиббса.
—
энергия Гиббса.
В этом смысле энергия Гиббса также является свободной.

