
kse_lect_2010_zao_2
.pdf
Принцип соответствия:
свойства объектов микромира при их усложнении непрерывно, без скачков переходят в свойства объектов макромира.
Таким образом, квантовая механика не противоречит классической физике, а лишь дополняет её на микроскопических масштабах, и в
пределе больших энергий и в случае, когда квантовая система взаимодействует с внешним миром, уравнения квантовой механики переходят в уравнения классической физики.

Классическая ньютоновская механика с ее однозначными законами требует исчерпывающе полного, детерминированного описания движения тел. Однако микропроцессам свойственны статистические закономерности, а сами микрообъекты описываются в терминах вероятностей их обнаружения в том или ином состоянии – с помощью так называемых
волновых функций.
Статистический характер законов движения частиц выражается количественно соотношениями неопределенностей Гейзенберга:
∆x·∆p ≥ h ∆E·∆t ≥ h
Невозможно, например, локализовать положение электрона в атоме – он 'размыт' по орбите, зато можно определить вероятность его обнаружения на этой орбите.
Еще одной особенностью частиц одного любого сорта является их неразличимость, тождественность. В следствие этого в системе неразличимых частиц должна иметь место симметрия или антисимметрия относительно перестановки любой пары частиц. Свойство перестановочной (анти)симметрии является характерным признаком данного сорта частиц. Соответственно, все частицы делятся на два класса: частицы с симметричными свойствами (и целым спином) называются бозонами, а с антисимметричными (и полуцелым спином) — фермионами.
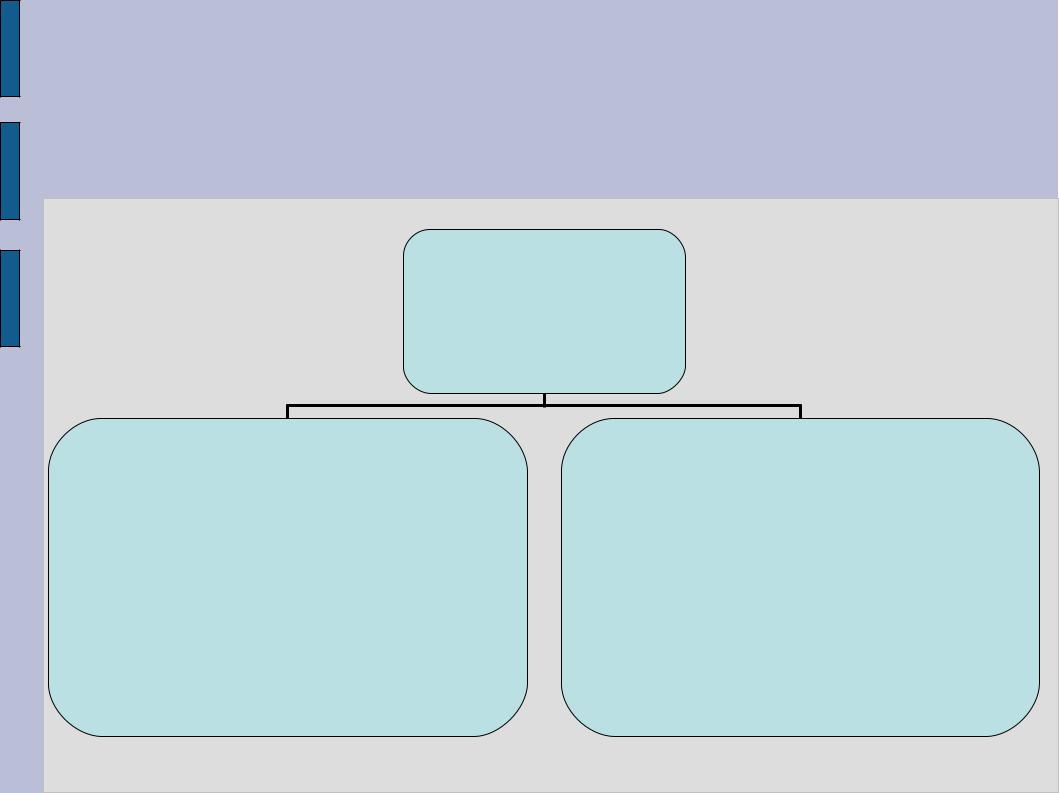
Классификация частиц в зависимости от спина (т.е. внутреннего момента импульса) и роли во взаимодействиях
элементарные
частицы
ФЕРМИОНЫ
(полуцелый спин, 1/2, 3/2 ...) |
фундаментальные калибровочные |
||
частицы, образующие вещество |
БОЗОНЫ |
||
( p, n, |
e, |
…) |
(целый спин, 0, 1, 2 ...) |
↓ |
↓ |
↓ |
частицы – кванты взаимодействий |
(фотон, гравитон, …) |
|||
адроны |
лептоны |
кварки |
|

Принцип (запрет) Паули:
два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях.
Этот принцип определяет, в частности, последовательность заполнения электронами орбит в атоме – периодический закон Д.И. Менделеева, а также специфику поведения бозонов, например, электронных пар, обеспечивающих эффект сверхпроводимости.

Структура атомов и Периодическая система элементов
Еще в первые десятилетия ХIX века обнаружилось, что некоторые свойства химических элементов (например, инертность благородных газов, легкость окисления щелочных металлов, потенциал ионизации и др.) периодически зависят от их атомной массы. В 1869-1871 годах Д.И.Менделеев сформулировал общий периодический закон:
«Химические и физические свойства элементов находятся в периодической зависимости от их атомного веса» и построил первую таблицу элементов, наглядно выражающую этот закон.
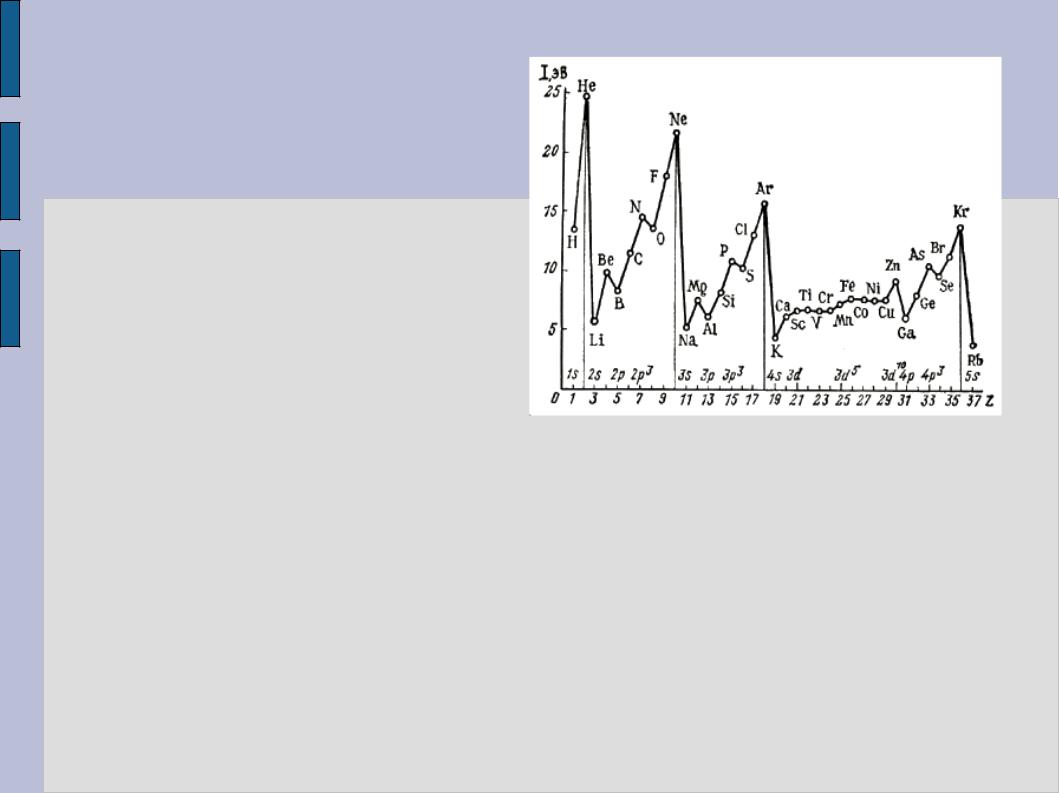
В основе периодического закона находятся фундаментальные принципы строения атома, открытые в 20-е годы ХХ века и ставшие его теоретическим обоснованием. Важное уточнение было сделано еще в 1913 году Г. Мозли, установившим, что
положение элементов в таблице определяется скорее зарядом атомного ядра (незадолго до этого открытого Резерфордом), чем атомной массой. Полная теория периодической системы была предложена Н. Бором в 1922 году как следствие его же теории строения атома.

? ?
Теория строения атома Бора дала в виде постулатов описание характера заполнения электронных оболочек атома в планетарной модели (предложенной ранее Резерфордом на основании экспериментов по рассеянию альфа-частиц) при последовательном увеличении заряда ядра и числа электронов на единицу. С точки зрения классической теории планетарная модель оказывалась полностью несостоятельной, т.к. электроны, двигающиеся по круговым или эллиптическим орбитам, должны излучать непрерывно во всем диапазоне частот. Значит, спектры атомов должны были бы быть сплошными, чего не наблюдается. Кроме того, темп потерь энергии на излучение оказывается настолько большим, что электроны практически моментально должны были бы падать на атомные ядра.
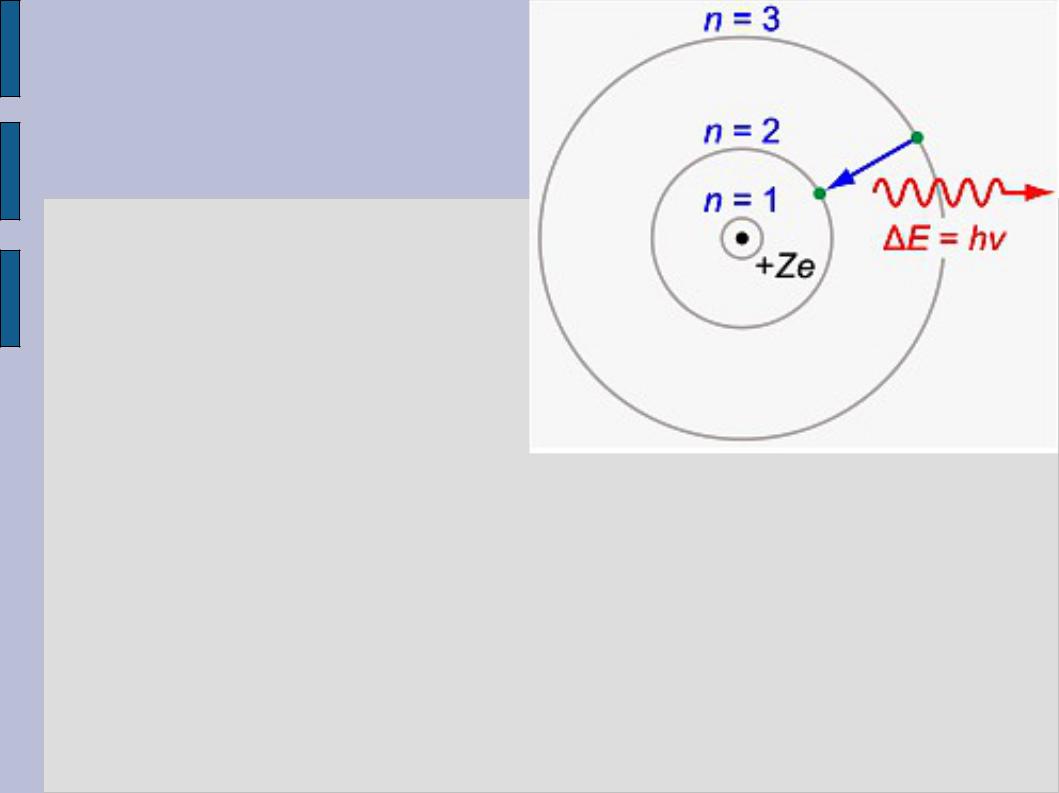
Постулаты теории Бора
1)электрон в атоме может находиться только в состояниях со строго определенными значениями (уровнями) энергии E, каждому из которых соответствует своя устойчивая (стационарная) орбита
2)пока электрон находится в любом из стационарных состояний, его движение не сопровождается излучением или поглощением энергии
