
А.С. Богатырева Определение коэффициентов тепло- и массопереноса газовых смесей
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Государственное образовательное учреждение высшего профессионального образования
«КУЗБАССКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Кафедра теоретической и геотехнической механики
ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТОВ ТЕПЛО- И МАССОПЕРЕНОСА ГАЗОВЫХ СМЕСЕЙ
Методические указания по выполнению лабораторной работы по дисциплине "Термодинамика" для студентов специальности 070600 "Физические процессы
горного производства"
Составители А.С. Богатырева В.Д. Богатырев
Утверждены на заседании кафедры Протокол № 9 от 17.03.03
Рекомендованы к печати учебно-методической комиссией специальности 070600 Протокол № 9 от 17.03.03 Электронная копия находится в библиотеке главного корпуса ГУ КузГТУ
КЕМЕРОВО 2003
1
ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТОВ ТЕПЛО-
ИМАССОПЕРЕНОСА ГАЗОВЫХ СМЕСЕЙ
1.Цель работы
Освоить расчет коэффициентов динамической вязкости, теплопроводности, диффузии методом точной кинетической теории газов Чапмена–Энского.
2.Обозначения и размерность физических величин, принятые
вработе
µ– коэффициент динамической вязкости, г см-1 с-1;
µсм – коэффициент динамической вязкости газовой смеси, г см-1 с-1;
Т– температура чистого газа или газовой смеси, оК;
σ– параметр потенциала Леннарда–Джонса (диаметр эффективного поперечного сечения соударения молекул), значения приведены в табл. 5, Ао; ε – параметр потенциала Леннарда–Джонса (максимальная энергия
притяжения между парой молекул), значения ε /k приведены в табл. 5, г см2 с-2;
Ωµ = Ωλ – интегралы столкновения Леннарда–Джонса, значения которых для коэффициентов вязкости и теплопроводности приведены в табл. 6;
ΩD – интеграл столкновения Леннарда–Джонса, значения которого для коэффициента массовой диффузии приведены в табл. 6;
n – число компонентов газовой смеси;
xi , xj – мольные доли i, j компонентов газовой смеси;
µi , µj – коэффициенты динамической вязкости компонентов i и j при заданных значениях температуры и давлении, г см-1 с-1;
Мi , Мj – молекулярные веса соответствующих компонентов газовой смеси;

2
DАВ – коэффициент молекулярной диффузии для двухкомпонентной смеси А↔В, см2 с-1;
DАА – коэффициент молекулярной самодиффузии А↔А , см2 с-1;
P– давление, атм;
λ– коэффициент теплопроводности, кал см-1 с-1 оК-1 ;
λсм – коэффициент теплопроводности газовой смеси, кал см-1 с-1 оК-1.
3.Порядок выполнения работы
3.1. Определение коэффициента динамической вязкости
1. Вычислим коэффициент динамической вязкости чистого одно-
атомного газа по формуле |
|
|
µ = 2,6693·10–5 |
MT /(σ 2Ωµ ). |
(1) |
Пример 1. Вычислить вязкость углекислого газа СО2 при температурах 200, 300, 800 ОК и давлении 1 атм.
Решение. Значение параметров Леннарда–Джонса для углекислого газа приведены в табл. 5 и составляют ε /k = 190 оК ; σ = 3,996 Ао. Молекулярный вес СО2 равен 44,01. Подставим найденные значения М
иσ в уравнение (1), получим:
µ= 2,6693·10-5  44,01T (3.9962 Ωµ) = 1,109 10-5
44,01T (3.9962 Ωµ) = 1,109 10-5  T /Ωµ .
T /Ωµ .
Результаты дальнейших вычислений приведены в табл. 1
|
|
|
|
|
Таблица 1 |
|
Т |
Т/190 |
T |
Ωµ |
µ 105 |
µ 105 |
|
расчет |
эксперимент |
|||||
|
|
|
|
|||
|
|
|
|
|
|
|
200 |
1,053 |
14,14 |
1,548 |
1,013 |
1,015 |
|
300 |
1,58 |
17,32 |
1,286 |
1,494 |
1,495 |
|
800 |
4,21 |
28,28 |
0,9595 |
3,269 |
нет данных |
3
2. Вычислим коэффициент динамической вязкости многокомпонентной газовой смеси по формуле
n |
)/ ( |
n |
) ), |
(2) |
µсм = ∑(( xi µi |
∑ xj Фij |
|||
i=1 |
|
j =1 |
|
|
где Фij = 0,353557 (1+ Mi / Mj )0,5 (1+( µi / µj) 0,5 (Mj / Mi ) 0,25 )2 – безраз-
мерный параметр, Фij = 1 при i = j.
Пример 2. Исходя из приведенных в табл. 2 данных для чистых компонентов рассчитать динамическую вязкость следующей смеси газов, находящихся под давлением 1 атм при температуре 293 оК.
Таблица 2
Номер |
Вещество |
Мольная |
Молекулярный |
Вязкость |
||
|
|
доля |
вес М |
µ |
10 |
4 |
|
|
xi |
i |
i |
|
|
|
|
|
|
|
|
|
1 |
CO2 |
0,133 |
44,01 |
1,462 |
||
2 |
O2 |
0,039 |
32 |
2,031 |
||
3 |
N2 |
0,828 |
28,016 |
1,754 |
||
Решение. Воспользуемся уравнениями (1) и (2). Все проделанные вычисления поместим в табл. 3, которая иллюстрирует основные этапы расчета.
Таблица 3
|
|
|
|
|
n |
|
i |
j |
Mi / Mj |
µi / µj |
Фij |
∑ xjФij |
|
j=1 |
||||||
|
|
|
|
|
||
|
1 |
1,000 |
1,000 |
1,000 |
|
|
1 |
2 |
1,375 |
0,720 |
0,730 |
0,763 |
|
|
3 |
1,571 |
0,834 |
0,727 |
|
|
|
1 |
0,727 |
1,389 |
1,394 |
|
|
2 |
2 |
1,000 |
1,000 |
1,000 |
1,057 |
|
|
3 |
1,142 |
1,158 |
1,006 |
|
|
|
1 |
0,637 |
1,200 |
1,370 |
|
|
3 |
2 |
0,884 |
0,864 |
0,993 |
1,049 |
|
|
3 |
1,000 |
1,000 |
1,000 |
|

4
Подставим исходные и найденные значения параметров в уравнение (2), получим:
µсм = |
0,133 1,462 10−4 |
+ |
0,039 2,03110−4 |
+ |
0,828 1,754 10−4 |
= |
|
0,763 |
1,057 |
1,049 |
|||||
|
|
|
|
= 1,714 10-4, г см -1с -1 .
Экспериментальное значение µсм = 1,739 10-4 г см-1с-1.
3.2. Определение массового коэффициента диффузии
Вычислим коэффициент молекулярной диффузии для двухкомпонентной смеси А↔В по формуле
|
|
1 |
|
1 |
|
ρσ2AB ΩD,AB . |
|
|
DBA = 0,0018583 |
T |
+ |
|
(3) |
||||
|
|
|||||||
|
МA |
M B |
|
|
||||
Параметры Леннарда–Джонса для молекул А и В вычисляют по формулам: σ АВ = 0,5 (σ А+σ В), ε АВ = 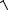
 εАεВ , а для изотопных пар мо-
εАεВ , а для изотопных пар мо-
лекул σ АА = σ А = σ А , ε АА = ε А = ε А .
Пример 3. Рассчитать массовый коэффициент диффузии DАВ для смесей аргона (А) и кислорода (В) при температуре 293,3 оК и общем давлении 1 атм.
Решение. Из табл. 5, 6 находим следующие постоянные:
MА = 39,944; MВ = 32,00; σ А = 3,418 А; σ В = 3,433 А; ε А/k = 124 оК;
ε В/k = 113 оК. Параметры σ АВ и ε АВ /k |
для столкновения молекул арго- |
|||||||||||
на и кислорода определим по приведенным выше уравнениям: |
||||||||||||
σ АВ = 0,5 (3,418+3,433) = 3,426 А; |
ε АВ /k = |
|
|
|
= 118 оК. |
|||||||
124 113 |
||||||||||||
Отношение k Т/ε АВ = 293,2/118,5 = 2,47; далее находим по табл. 5 |
||||||||||||
значение интеграла столкновения ΩD, АВ = 1,003. Подставляя получен- |
||||||||||||
ные величины в уравнение (3), находим |
|
|
|
|
|
|
|
|||||
|
(293,2) |
3 |
|
1 |
+ |
1 |
|
|
||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|||||||
DАВ = 0,0018583 |
|
|
39,944 |
|
32,00 |
|
|
= 0,188 см2 с–1. |
||||
(1,0)(3,426)2 (1,003) |
|
|
||||||||||
|
|
|
|
|
|
|||||||

5
Этот результат совпадает с измеренным значением коэффициента диффузии, равным 0,2 см2 с-1.
3.3. Определение коэффициента теплопроводности
1. Вычислим коэффициент теплопроводности одноатомного газа по формуле
λ=1,984·10-4 
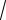 MT /(σ 2·Ωµ ). (4)
MT /(σ 2·Ωµ ). (4)
Пример 4. Рассчитать теплопроводность неона при температуре 373 оК и давлении 1 атм.
Решение. Параметры Леннарда-Джонса для неона равны (табл. 5) σ = 2,789 А; ε АВ /k = 35,7 оК, молекулярный вес составляет 20,179. Следовательно, при Т = 373 оК отношение k Т/ε = 372,2 35,7 = 10,45. Далее, по табл. 6 находим Ωµ = Ωλ = 0,821. Подставим числовые значения Т, М, σ ,Ωλ в формулу (4), получим:
λ=1,984·10–4 (373,2/20,179)0.5/((2,789)2 0,821)) = = 1,398·10–4, кал см–1 с–1 0К–1.
Экспериментальное значение коэффициента теплопроводности неона при тех же условиях равно 1,35·10–4 кал см–1 с–1 оК–1.
2. Вычислим коэффициент теплопроводности смеси газов по фор-
муле
n |
λi |
)/ ( |
n |
) ). |
(5) |
λсм = ∑(( xi |
∑ xj Фij |
||||
i=1 |
|
|
j=1 |
|
|
Пример 5. Рассчитать теплопроводность смеси газов СО2 , О2 , N2 при атмосферном давлении и температуре 293 оК. Данные о составе смеси и физических свойствах чистых компонентов при давлении 1 атм и температуре 293 оК приведены в табл. 4.
|
|
|
|
|
Таблица 4 |
Компонент |
|
Мольная |
Молекулярный |
Вязкость |
Теплопроводность |
|
доля xi |
вес Мi |
µi 104 |
λi 105 |
|
СО2 |
1 |
0,133 |
44,010 |
1,462 |
3,83 |
О2 |
2 |
0,039 |
32,000 |
2,031 |
6,12 |
N2 |
3 |
0,828 |
28,013 |
1,754 |
6,27 |
6
Решение. Вычисления будем производить по формуле (5). С целью сокращения расчета заметим, что параметры Фij для рассматриваемой смеси для тех же значений температуры и давления вычислены в
n
примере 1, в том же примере были рассчитаны суммы ∑ xjФij , входя-
|
|
|
|
|
j=1 |
щие в формулу (5): |
|
|
|
|
|
n |
Ф1j = 0,763 ; |
n |
Ф2j = 1,057; |
n |
Ф3j = 1,049 . |
∑ x1 |
∑ x2 |
∑ x3 |
|||
j=1 |
|
j=1 |
|
j=1 |
|
Подставляя эти суммы и исходные данные в формулу (5), полу-
чим:
λсм = |
0,133 3,83 |
+ |
0,039 6,12 |
+ |
0,828 6,27 |
10 –5 = |
|
0,763 |
|
1,057 |
1,049 |
||||
|
|
|
|
|
|||
= 5,84 10 –5 кал см–1 с–1 оК–1.
Таблица 5
Вещество |
Молеку- |
σ , |
ε /k |
Вещество |
Молеку- |
σ , |
ε /k |
|
лярный |
Ао |
оК |
|
лярный |
Ао |
оК |
|
вес |
|
|
|
вес |
|
|
|
|
|
|
|
|
|
|
Воздух |
28,97 |
3,617 |
97,00 |
F2 |
38,010 |
3,653 |
112,0 |
N2 |
28,02 |
3,681 |
91,50 |
Cl2 |
70,910 |
4,115 |
357,0 |
O2 |
32,00 |
3,433 |
113,0 |
Br2 |
159,83 |
4,268 |
520,0 |
CO |
28,01 |
3,590 |
110,0 |
I2 |
253,82 |
4,982 |
550,0 |
CO2 |
44,01 |
3,996 |
190,0 |
H2 |
2,0160 |
2,915 |
38,00 |
C2H4 |
16,04 |
4,221 |
137,0 |
He |
4,0030 |
2,576 |
10,20 |
NO |
30,01 |
3,470 |
119,0 |
Ne |
20,183 |
2,789 |
35,70 |
N2O |
44,02 |
3,879 |
220,0 |
Ar |
39,944 |
3,418 |
124,0 |
SO2 |
64,07 |
4,290 |
252,0 |
Kr |
83,800 |
3,498 |
225,0 |
7
Контрольные вопросы
1.Сформулировать закон вязкости Ньютона.
2.Сформулировать закон теплопроводности Фурье.
3.Сформулировать закон диффузии Фика.
4.Сравнить закон теплопроводности Фурье с законом вязкости Ньютона.
5.Каков порядок коэффициентов вязкости, теплопроводности, диффузии газов при комнатной температуре и атмосферном давлении?
6.Как определяется объемная мольная доля вещества в многокомпонентной смеси?
|
|
|
|
|
Таблица 6 |
k Т/ ε |
Ωµ = Ωλ |
ΩD, АВ |
k Т/ ε |
Ωµ = Ωλ |
ΩD, АВ |
0,30 |
2,785 |
2,662 |
2,50 |
1,093 |
0.9996 |
0,35 |
2,628 |
2,476 |
2,60 |
1,081 |
0,9878 |
0,40 |
2,492 |
2,318 |
2,70 |
1,069 |
0,9770 |
0,45 |
2,368 |
2,184 |
2,80 |
1,058 |
0,9672 |
0,50 |
2,257 |
2,066 |
2,90 |
1,048 |
0,9576 |
0,55 |
2,156 |
1,966 |
3,00 |
1,039 |
0,9490 |
0,60 |
2,065 |
1,877 |
3,10 |
1,030 |
0,9406 |
0,65 |
1.982 |
1,798 |
3,20 |
1,022 |
0,9328 |
0,70 |
1,908 |
1,729 |
3,30 |
1,014 |
0,9256 |
0,75 |
1,841 |
1,667 |
3,40 |
1,007 |
0,9186 |
0,80 |
1,780 |
1,612 |
3,50 |
0,9999 |
0,9120 |
0,85 |
1,725 |
1,562 |
3,60 |
0,9870 |
0,9058 |
0,90 |
1,675 |
1,517 |
3,70 |
0,9811 |
0,8998 |
0,95 |
1,629 |
1,476 |
3,80 |
0,9755 |
0,8942 |
1,00 |
1,587 |
1,439 |
3,90 |
0,9700 |
0,8888 |
1,05 |
1,549 |
1,406 |
4,00 |
0,9649 |
0,8836 |
1,10 |
1,514 |
1,375 |
4,10 |
0,9600 |
0,8788 |
1,15 |
1,482 |
1,346 |
4,20 |
0,9533 |
0,8740 |
8
Продолжение табл. 6
k Т/ ε |
Ωµ = Ωλ |
ΩD, АВ |
k Т/ ε |
Ωµ = Ωλ |
ΩD, АВ |
1,20 |
1,452 |
1,320 |
4,30 |
0,9507 |
0,8694 |
1,25 |
1,424 |
1,296 |
4,40 |
0,9464 |
0,8652 |
1,30 |
1,399 |
1,273 |
4,50 |
0,9422 |
0,8610 |
1,35 |
1,375 |
1,253 |
4,60 |
0,9382 |
0,8568 |
1,40 |
1,353 |
1,233 |
4,70 |
0,9343 |
0,8530 |
1.45 |
1,333 |
1,215 |
4,80 |
0,9305 |
0,8492 |
1,50 |
1,314 |
1,198 |
4,90 |
0,9269 |
0,8456 |
1,55 |
1,296 |
1,182 |
5,00 |
0,8963 |
0,8422 |
1,60 |
1,279 |
1,167 |
6,00 |
0,8727 |
0,8124 |
1,65 |
1,264 |
1,153 |
7,00 |
0,8538 |
0,7896 |
1,70 |
1.248 |
1,140 |
8,00 |
0,8538 |
0,7712 |
1,75 |
1,234 |
1,128 |
9,00 |
0,8379 |
0,7556 |
1,80 |
1,221 |
1,116 |
10,0 |
0,8247 |
0,7424 |
1,85 |
1,209 |
1,105 |
20,0 |
0,7432 |
0,6640 |
1,90 |
1,197 |
1,094 |
30,0 |
0,7005 |
0,6232 |
1,95 |
1,186 |
1,084 |
40,0 |
0,6718 |
0,5960 |
2,00 |
1,175 |
1,075 |
50,0 |
0,6504 |
0,5756 |
2,10 |
1,156 |
1,057 |
60,0 |
0,6335 |
0,5596 |
2,20 |
1,138 |
1,041 |
70,0 |
0,6194 |
0,5464 |
2,30 |
1,122 |
1,026 |
80,0 |
0,6076 |
0,5352 |
2,40 |
1,107 |
1,012 |
90,0 |
0,5973 |
0,5256 |
Список рекомендуемой литературы
1.Берд Р. Явления переноса / Р. Берд, В. Стьюарт, Е. Лайтфут.–
М.: Химия, 1974.– 687 с.
2.Гиршфельдер Д. Молекулярная теория газов и жидкостей / Д. Гиршфельдер, Ч. Кертис, Р. Берд.– М.: Издатинлит, 1961.– 929 с.
Составители:
Богатырева Альбина Сергеевна Богатырев Виктор Дмитриевич
ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТОВ ТЕПЛО– И МАССОПЕРЕНОСА ГАЗОВЫХ СМЕСЕЙ
Методические указания по выполнению лабораторной работы по дисциплине "Термодинамика" для студентов специальности 070600 "Физические процессы горного производства"
Редактор А.В. Дюмина
Подписано в печать 28.03.03 Формат 60×84/16. Бумага офсетная. Отпечатано на ризографе. Уч.-изд. л. 0,7. Тираж 60 экз. Заказ ГУ КузГТУ, 650026, Кемерово, ул. Весенняя, 28.
Типография ГУ КузГТУ, 650099, Кемерово, ул. Д. Бедного, 4А.
